Src蛋白在肝癌HepG2细胞增殖凋亡中作用的初步研究
2010-06-15毛成毅郑继军李增鹏
毛成毅,郑继军,杜 娟,马 瑜,林 俐,李增鹏,陈 芳
(第三军医大学大坪医院野战外科研究所:1.病理科;2.肿瘤中心,重庆400042)
原癌基因Src在调节正常细胞的生长、发育、增殖和凋亡等方面发挥着重要作用,其异常表达和肿瘤的发生、发展密切相关。在人类许多肿瘤中(如结肠癌、乳腺癌和胰腺癌)都存在Src蛋白的过度表达和活化。肝癌细胞的浸润、转移是临床上治疗肝癌失败的重要因素。近年来国内外研究表明,许多肝癌组织中存在高度活化的Src蛋白,然而其在肝癌中的作用还未完全阐明[1-3]。本文中应用免疫组化、流式细胞术以及MTT法检测Src蛋白在HepG2细胞中的表达以及细胞增殖和凋亡情况,同时用特异性Src蛋白酪氨酸激酶抑制剂PP2作用于肝癌细胞株HepG2细胞,研究Src蛋白对肝癌细胞增殖凋亡的影响。
1 材料与方法
1.1 材料 (1)人肝癌细胞株HepG2细胞由第三军医大学西南医院感染科惠赠;(2)DMEM培养基,小牛血清,胰蛋白酶,PBS;(3)兔抗人单克隆抗体Src(Cell Signaling公司);(4)PP2(Calbiochem公司);(5)羊抗兔辣根过氧化物酶标记的二抗(北京中杉公司);(6)SP免疫组化试剂盒(北京中山公司);(7)MTT,DMSO(Sigma公司);(8)倒置显微镜(Olympuls公司);(9)6、96孔细胞培养板,细胞培养瓶(Corning公司);(10)CO2细胞培养箱(Thermo公司);(11)AnnexinV/FITC及PI试剂盒(北京晶美生物有限公司);(12)DMN-9602酶标分析仪(北京普朗新技术有限公司)。
1.2 免疫组化染色 取对数生长期人肝癌细胞株HepG2细胞,以0.25%胰酶消化传代后,加至24孔板中经酸和乙醇处理的盖玻片上。待HepG2细胞在盖玻片表面贴附适当后,置37℃、5%CO2孵箱孵育 24h 后,按照 5、10、20、40μ mol/mL 4种浓度PP2分别加入培养板中,继续培养4h后,倒去培养基,加95%酒精室温固定30min后取出盖玻片用DPX粘在载玻片上,4℃冰箱过夜。用3%过氧化氢处理10min,再用PBS洗后,依次滴加一抗(1∶300,37℃恒温箱孵育40min)、增敏剂、辣根过氧化物酶标记的二抗(1∶300,37℃恒温箱孵育30min)。PBS洗后,以 DAB显色、苏木素衬染,然后常规脱水、封片,用光镜观察结果。
1.3 M TT法检测PP2对HepG2细胞增殖的抑制作用 取对数生长期的细胞,经胰酶消化后吹打成单细胞悬液,调整浓度为5×105/mL,接种于 96孔培养板中,每孔 200μ L。24h后,弃原培养液,按照 5、10、20、40μ mol/mL 4种浓度的 PP2 加入新培养液,每种浓度设3个平行复孔,另设阴性对照组。置37℃、5%CO2培养48h,各孔加入 MT T(5mg/mL),继续培养4h,弃上清液,然后加入DMSO,振荡 10min,用酶标仪检测OD值(波长=490nm)。根据下列公式计算各浓度对HepG2细胞增殖的抑制率:平均细胞增殖抑制率IR=(1-处理组OD值/对照组OD值)×100%。以抑制剂浓度为横坐标,增殖率为纵坐标,绘制细胞增殖曲线。
1.4 流式细胞仪检测细胞凋亡 收集不同浓度PP2处理48h的HepG2细胞,常规胰酶消化后,制成单细胞悬液,离心后弃上清液,再经预冷的 PBS洗2次,按 AnnexinV/FITC及 PI试剂盒提供方法依次加入结合缓冲液、AnnexinV/FITC及PI,4℃避光30min后上机测试。采用FACScort流式细胞仪对样品进行检测,每次计细胞数10 000个,激发波长488nm,用分析软件Cell Quest计算凋亡率。
2 结 果
2.1 Src蛋白在HepG2细胞中的表达 Src蛋白阳性表达定位于HepG2细胞的细胞浆,阳性着色为棕黄色颗粒状。PP2抑制剂 5、10、20、40μ mol/mL 分别处理 HepG2 细胞后,Src 蛋白在HepG2细胞中表达降低,棕黄色颗粒状减少,颜色变浅,见图1。
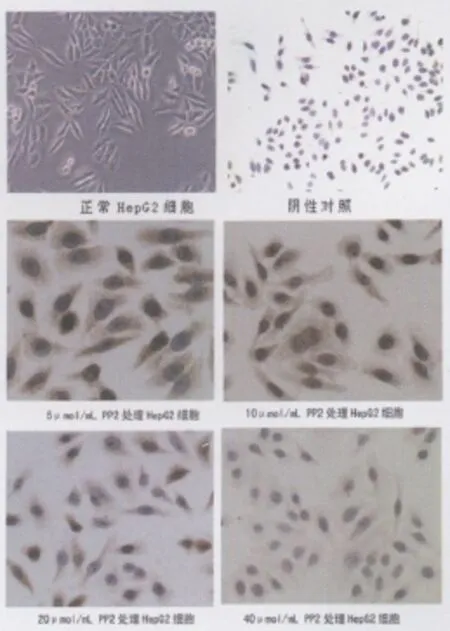
图1 正常HepG2细胞、阴性对照及不同 PP2浓度下Src蛋白在HepG2细胞中表达情况
2.2 细胞凋亡分析 PP2作用于HepG2细胞 48h后,流式细胞仪检测到细胞凋亡,且细胞凋亡率随着PP2浓度增高而增高。处理组与对照组之间差异有统计学意义(P<0.01),低浓度组与高浓度组间差异有统计学意义(P<0.01),见图2。
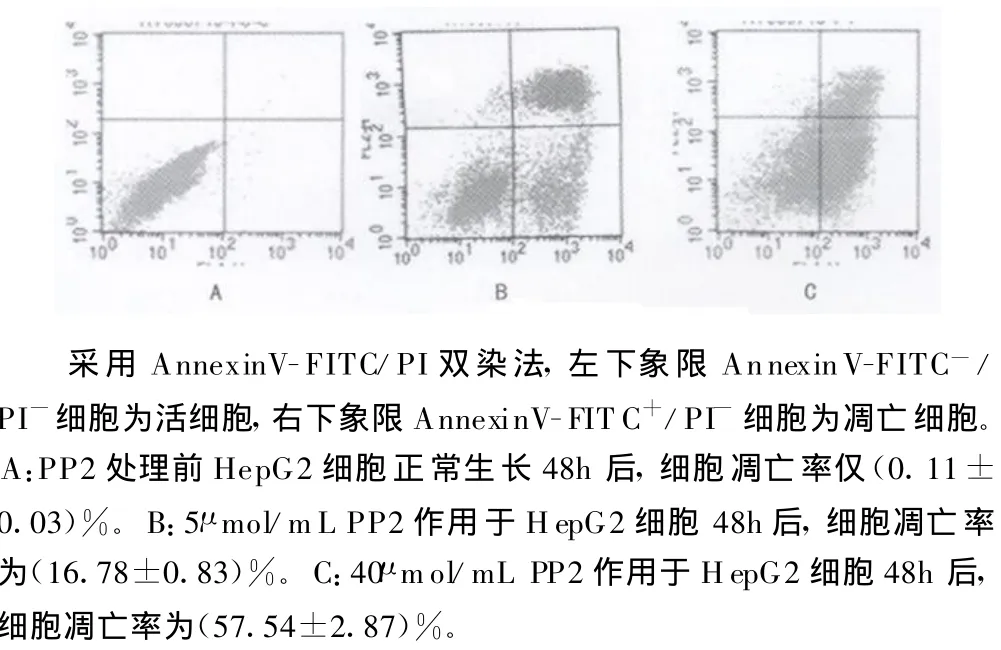
图2 PP2诱导HepG2细胞凋亡情况
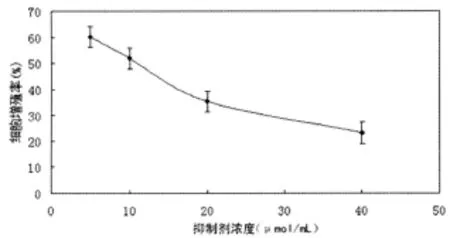
图3 不同浓度PP2对HepG2细胞增殖抑制作用
2.3 M TT法检测PP2对HepG2细胞增殖的抑制作用HepG2细胞经PP2抑制剂 5、10、20、40μ mol/mL 4种浓度作用48h后,随着抑制剂浓度的增加,抑制作用明显增加,呈现浓度依赖性,5、10、20、40μ mol/mL 4 种浓度的抑 制率分别为39.66%、48.00%、64.63%、76.89%,低浓度组(5、10μ mol/L)与高浓度组(20、40μ mol/L)相比差异有统计学意义(P<0.05),见图 3。
3 讨 论
肝细胞性肝癌(HCC)是最常见的恶性肿瘤之一,随着慢性肝炎、肝硬化发生率的提高,HCC的发病率也不断上升。虽然目前肝癌诊断治疗水平有提高,但其治疗效果仍不理想。因此,需要进一步阐明HCC的发病机制。近年来,许多证据表明癌基因Src蛋白在肝癌的发生和发展中起着重要的作用。Src蛋白是由原癌基因c-Src编码的一个相对分子质量为60kd的磷酸化蛋白质,是第1个被发现具有酪氨酸蛋白激酶活性的癌蛋白。Src蛋白在调节正常细胞的发育、增殖和凋亡等方面发挥着重要作用。在恶性肿瘤细胞中Src蛋白大量聚集在核周,而在正常的细胞内Src蛋白相对均匀的散布于细胞质内。目前研究发现Src蛋白在结肠癌中活性极高,尤其是在肿瘤转移到肝脏之后[4-7]。
本实验证明了Src蛋白在人肝癌HepG2细胞中高表达,Src酪氨酸蛋白激酶抑制剂PP2抑制HepG2细胞中Src蛋白酪氨酸激酶后,Src蛋白在人肝癌HepG2细胞中表达降低,细胞中棕黄色细颗粒状减少。HepG2细胞被Src酪氨酸蛋白激酶抑制剂PP2抑制后,培养的肝癌细胞伪足减少,增殖显著降低,呈现剂量依赖性,随着抑制剂浓度的升高细胞增殖随之降低。作者发现,应用特异性Src蛋白酪氨酸激酶抑制剂PP2能够抑制HepG2细胞,使 Src蛋白失活,从而抑制HepG2细胞的增殖。并且随着抑制剂浓度的增加和对Src蛋白的抑制增强,HepG2细胞增殖抑制率上升。
Src蛋白过度表达或活化对肿瘤细胞的生长影响还不是十分清楚。有研究发现,应用反义寡核苷酸减少Src蛋白表达,能够抑制HT29结肠癌细胞的体外和体内的生长。本研究表明,活化的Src蛋白在肝癌细胞株HepG2细胞凋亡中发挥重要作用,抑制Src蛋白磷酸化,能够抑制HepG2细胞的增殖,增强细胞凋亡。但是,不同的肿瘤,或者同一肿瘤的不同类型,Src蛋白对细胞增殖凋亡影响是不同的[8-11]。
Src蛋白作为胞质内蛋白,其过表达与相当多肿瘤疾病(乳腺癌、肝癌、结肠癌和肺癌等)有关,有研究认为其与生长因子有协同作用,具有癌基因活性。其可被整合素受体、生长因子受体等细胞膜受体激活,从而激活不同的信号通路,引起细胞增殖、凋亡多种生理效应。Src蛋白家族可对Fak起调节作用,通过色氨酸同源区域(SH)连接其他胞内蛋白激酶,引起激酶链反应。整合素受体耦联ECM与胞内肌动蛋白骨架,ECM与整合素受体的结合促使整合素β亚基的胞质端形成黏着斑,并诱发Src-Fak复合体的形成及黏着斑蛋白的磷酸化,激活PI-3K,引起细胞的黏附、迁移。尤其是在肿瘤转移期,Fak与Src蛋白关系更加密切[9-12]。
综上所述,Src蛋白在人肝癌细胞株HepG2细胞增殖和凋亡过程中起重要作用。Src蛋白可以通过其自身多个位点同多种蛋白直接作用,影响肝癌细胞增殖、凋亡、浸润和转移等多种生物学行为,提供了针对Src蛋白靶点对肝癌进行分子靶向治疗的理论依据。仅可以开拓它本身的应用领域,还可为设计更理想的新药提供新的独特的化学结构,后者可被用为创制新药的先导化合物,经验表明这种做法可以更经济的筛选发现新药。在抑制肿瘤的同时,有研究认为该药物还具有逆转多药耐药的作用。本实验结果也证实姜黄素同时可以在体外有效逆转某些实体瘤(乳腺腺癌 MCF-7/ADR)和白血病(急性早幼粒细胞白血病HL60/ADR)细胞系的多药耐药,姜黄素组和阿霉素组的敏感性分别比对照组增加3.39倍和4.18倍。根据RT-PCR和Western Blot检测结果,其逆转靶点可能为M RP基因,同时细胞系的凋亡也可能通过Bcl-2蛋白途经得到了加强。肿瘤细胞的多药耐药机制很多,但一般认为药泵是其主要并且是最易进行逆转的途径;Mdr1以及MRP基因的编码产物为药物转运蛋白通过外排泵作用使细胞内药物浓度下降导致耐药[9-10],通过RT-PCR检测发现MRP基因在两种耐药细胞系中表达均有所下调,而流式细胞仪检测加入姜黄素后的细胞内阿霉素荧光强度明显高于单独使用阿霉素的试验组,说明姜黄素可能通过抑制转运蛋白的药泵功能使药物有效进入细胞内部达到治疗的结果。同时其抑制效应不但作用于实体瘤细胞而且作用于白血病细胞系,提示姜黄素的作用不仅仅是针对某一类肿瘤(实体和血液病),其具有较好的广谱逆转效应。实验同时显示,姜黄素对耐药细胞系有明显的促凋亡作用,并对Bcl-2蛋白的表达有所抑制。姜黄素能否在体内试验中同样逆转多药耐药,以及是否通过促进凋亡以及抑制药泵在体内起到逆转耐药作用还需进一步研究。
[1]谭耀红,杨纯正.乳腺癌转移复发肿瘤标志物研究进展[J].国外医学肿瘤分册,2002,29(3):206.
[2]Carmixhael J,DeGraff WG,Gazadar AF,et al.Evaluation of a tetrazolium-based semiautomated colorimetric assay:assessment of chemosensitivity testing[J].Cancer Res,1987,47(4):936.
[3]刘宝,薛妍,慕利梅.姜黄素和阿霉素联合应用对人肝癌细胞SMMC 7721抑制作用的研究[J].肿瘤研究与临床,2000,12:372.
[4]李光耀,谭耀红,杨纯正,等.白血病患者可溶性耐药相关钙结合蛋白基因的表达及其临床意义[J].中华血液学杂志,2002,23:293.
[5]Tan YH,Li GY,Zhao CH,et al.Expression of sorcin predicts poor outcome in acute myeloid leukemia[J].Leuk Res,2003,27(2):125.
[6]林溪,许建华,柯丹如.姜黄素与阿霉素联合用药的体外抗肿瘤作用[J].中国药理学通报,2000,16:522.
[7]杨家荣,杨慧,潘铁军.姜黄素对膀胱肿瘤细胞组织蛋白酶 D表达的影响[J].重庆医学,2008,37(14):1540.
[8]陈忠,章咏裳,李家贵,等.人膀胱癌细胞耐药株多基因蛋白表达的意义[J].中华泌尿外科杂志,1998,19(12):707.
[9]Schuetz EG,Schinkel AH.Drug disposition as determined by the interplay between drugtransporting and drug-metabolizing systems[J].J Biochem Mol Toxicol,1999,13:219.
[10]吴晓健,吴凯南,董蒲江.姜黄素诱导人乳腺癌 MCF-7细胞凋亡的研究[J].重庆医学,2005,34(12):1768.
