卵巢癌患者PD-L1的表达研究
2010-06-13于晓伟李春红张松灵张晓霞张丽宏崔满华
于晓伟,李春红,张松灵,张晓霞,何 津,张丽宏,崔满华
(1.吉林大学第一医院 妇产科,吉林 长春130021;2.吉林大学基础医学院病理教研室,吉林 长春130021;3.吉林大学第二医院妇产科,吉林 长春130041)
PD-L1、PD-L2是新发现的B7家族共刺激分子配体,二者具有共同的受体PD-l,并通过与受体PD-1结合抑制T细胞的增殖和过度活化,在细胞免疫应答过程中起负调控作用,同时通过影响细胞因子的分泌对体液免疫也发挥了调控作用。PD-Ll、PDL2/PD-1路径在机体自身免疫耐受和肿瘤细胞逃逸机体免疫监控过程中都发挥着重要作用。目前研究发现许多肿瘤表达PD-Ll。PD-L1在肿瘤细胞上的表达削弱其免疫原性,影响其产生特异性T细胞应答,抑制肿瘤免疫应答的产生。肿瘤细胞表达的PDLl能通过诱导特异性T细胞的凋亡而使肿瘤细胞发生免疫逃逸。
1 材料与方法
1.1 材料
实验组:卵巢癌症患者40例,来源于2005年3月-2007年10月期间在吉林大学第一医院妇产科的住院手术患者,年龄45-70岁,平均年龄(58.3±13.7)岁。卵巢癌患者术前均未行放疗、化疗。所有病例均经手术病理确诊为浆液性上皮性卵巢癌。
对照组:子宫肌瘤患者经病理证实的正常卵巢组织10例,来源于同期在吉林大学第一医院妇产科行子宫切除术及附件切除术的患者,年龄45-60岁,平均年龄(50.3±4.21)岁。
卵巢癌组织及正常卵巢组织标本固定于10%的福尔马林固定液中,经取材、脱水、透明、浸蜡、包埋后,切片。切片厚为4 μ m,烤干后备用。
1.2 免疫组织化学法
1.2.1主要试剂及试剂盒 兔抗多克隆抗体PD-L1,浓缩型,购自于Santia公司,工作液为1∶100;
通用型SP试剂盒,及DAB显色试剂盒购于福州迈新公司
1.2.2具体步骤 (1)石蜡切片常规脱蜡至水洗;(2)柠檬酸盐95℃热修复5 min后,室温冷却;(3)PBS洗5 min,洗3次;(4)阻断剂(试剂A)去内源性过氧化酶,室温15min;(5)PBS洗5 min,洗3次;(6)加封闭液(试剂B)室温封闭15 min;(7)滴加一抗,4℃过夜;(8)PBS洗5min,洗3次;(9)滴加生物素标记的抗鼠/兔IgG的第二抗体(试剂C),室温15 min;(10)PBS洗5 min,洗3次;(11)滴加辣根过氧化酶标记的链霉菌抗生物素蛋白(试剂D)室温15 min;(12)PBS洗5 min,洗3次;(13)滴加显色剂DAB,光镜下观察,显色适当后用水终止;(14)Mayer苏木素复染细胞核,水洗;(15)弱氨水返蓝,水洗;(16)脱水、透明、中性树胶封片。
1.2.3结果判定 阳性结果:细胞胞浆或(和)胞膜呈棕黄色颗粒。在局部阳性染色区域内评估PD-L1+癌细胞占所有癌细胞的比例。
1.3 统计分析
正态数据采用Microsoft Excel 2003的统计学工具进行统计学处理,结果以s表示,经方差齐性检验后,组间比较采用 t检验。所有数据均用SPSS10.0 for windows软件包处理。
2 结果
PD-L1主要表达在卵巢癌上皮细胞的胞浆内或(和)胞膜上(见图1:a-b);而正常卵巢组织不表达PD-L1。在400×显微镜下分析PD-L1表达情况。在局部阳性染色区域内评估PD-L1+癌细胞占所有癌细胞的比例。每400×视野至少200个癌细胞。癌细胞中PD-L1+癌细胞的平均比例51.2±11.0%,范围12.1-80.1%。
3 讨论
在免疫应答的过程中,除了通过APC递呈MHC处理过的抗原给抗原特异T细胞以提供第一信号外,还需共刺激分子作为辅助信号的协同作用,达到生理阈值后才能使T细胞活化,产生正常的应答反应。目前己知的共刺激分子分为3个家族,即免疫球蛋白超家族、TNF家族和细胞因子家族。其中免疫球蛋白超家族是唯一能从APC单向传递信号到T细胞的共刺激分子。PD-L1、PD-L2是新发现的B7家族共刺激分子配体,二者具有共同的受体PD-l,并通过与受体PD-1结合抑制T细胞的增殖和过度活化,在细胞免疫应答过程中起负调控作用,同时通过影响细胞因子的分泌对体液免疫也发挥了调控作用。PD-Ll、PD-L2/PD-1路径在机体自身免疫耐受和肿瘤细胞逃逸机体免疫监控过程中都发挥着重要作用。
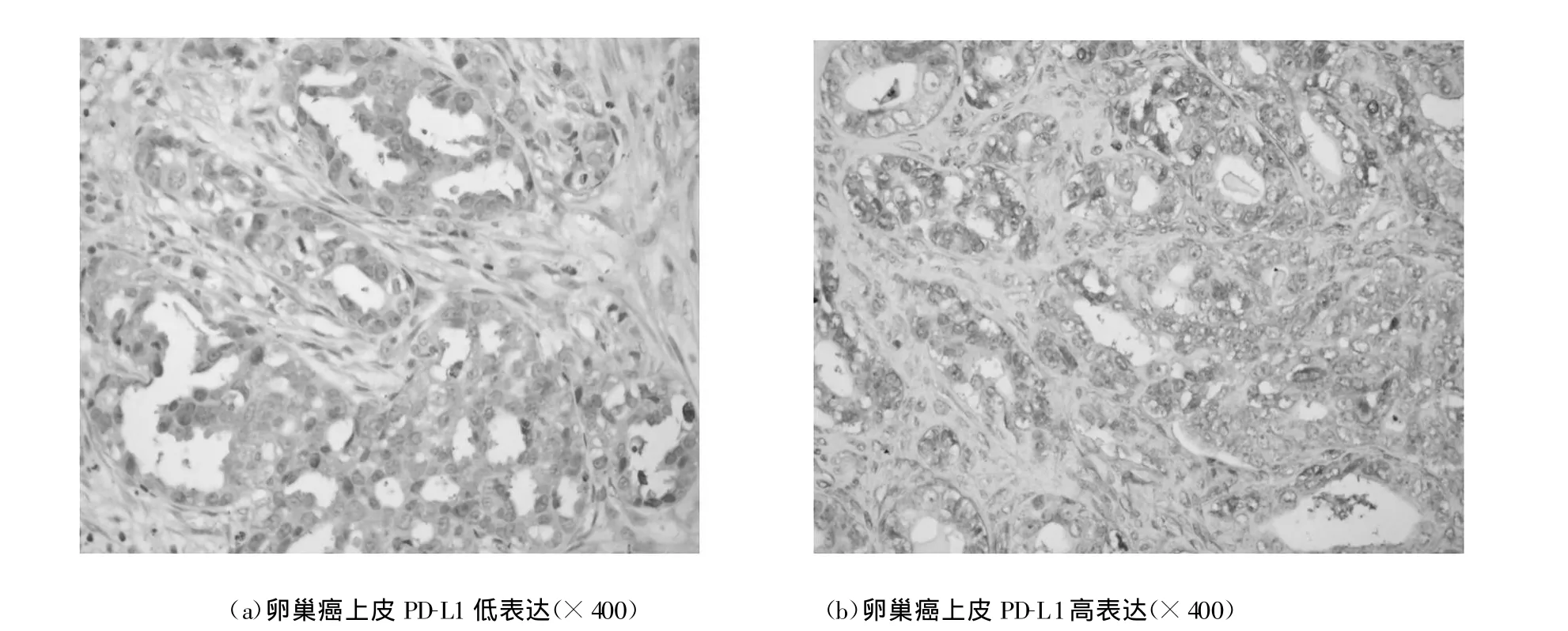
图1 卵巢癌上皮细胞PD-L1的表达
肿瘤表达的抗原能够被宿主的T细胞识别,但是肿瘤的清除却很少。这一失败的原因部分归于肿瘤微环境的免疫抑制的存在。例如肿瘤细胞分泌各种免疫抑制分子例如TGF-β和可溶性MHCI类链相关分子[1、2]表达免疫抑制性分子Fas配体[3],诱导T细胞表达CTLA-4[4]。
近年来发现免疫抑制性受体PD-1在肿瘤的免疫逃逸中发挥重要作用。PD-1表达在活性T细胞及B细胞上,通过募集酪氨酸磷酸酶SHP-2来抑制它们的活性。T细胞、B细胞、DC、巨噬细胞、间充质干细胞等表达PD-Ll[5]。在非淋巴组织有广泛表达,胸腺组织高表达 PD-L1,心脏、脾、肾、肝、肺、皮肤、肌肉也有不同程度的中等表达。此外有报道胎盘也表达PD-LI。
表达在抗原提呈细胞上的PD-Ls通过作用于T细胞上的PD-1,诱导T细胞无能或凋亡,因此外周组织表达PD-Ls直接抑制自身反应性淋巴细胞。近来研究发现许多肿瘤表达PD-Ll,包括乳腺癌、肺癌、结肠癌、卵巢癌、黑色素瘤、膀胱癌、肝癌、胃癌、神经胶质瘤、甲状腺癌等均有报道[6-14]。此外PD-1在肿瘤浸润淋巴细胞上调,这可能诱导免疫抑制[109]。PD-L1表达于卵巢癌上皮内,而非间质和浸润CD8+T细胞,提示PD-L1抑制肿瘤内CD8+T细胞的移动[15]。值得注意的是近来研究还发现,表达PD-L1的肿瘤患者预后不好,例如肾癌、卵巢癌、膀胱癌,胃癌、乳腺癌和胰腺癌,此外这些研究提示肿瘤细胞高表达PD-L1的患者临床分期晚,转移早。
本研究中所有被检测的卵巢癌患者肿瘤细胞的胞浆或(和)胞膜均表达PD-L1,癌细胞中PD-L1+癌细胞的平均比例51.2±11.0%,范围12.1-80.1%。目前研究认为肿瘤细胞表达PD-Ll通过下列方面削弱机体对肿瘤的免疫应答:(1)PD-L1在肿瘤细胞上的表达削弱其免疫原性,影响其产生特异性T细胞应答,抑制肿瘤免疫应答的产生。(2)肿瘤细胞表达的PD-Ll能通过诱导特异性CTL的凋亡而使肿瘤细胞发生免疫逃逸[16]。(3)肿瘤组织中的巨噬细胞分泌的IL-10以及肿瘤细胞产生的VEGF均可上调DC表面PD-L1的表达,直接影响其激发T细胞产生抗肿瘤免疫应答的能力。
与其他肿瘤相比,卵巢癌PD-L1表达要高于其他恶性肿瘤,例如肺癌(50%),食道癌(44%),胃癌(42%),肾癌(37%)等,说明PD-L1可能在卵巢癌的抑制宿主免疫反应中发挥重要作用。Junzo研究发现接近50%卵巢癌患者表达PD-L2,与肺癌和食道癌相近。他还同时分析了PD-Ls与卵巢癌患者预后的关系,发现高表达PD-L1的患者与低表达或不表达PD-L1的患者相比预后差,而且PD-L1的表达与临床病理分期和肿瘤的病理类型无相关性,和其他的预后指标例如淋巴结转移及残余病灶等相比PDL1的表达是独立的预后指标。在肾癌食道癌及胃癌研究中发现PD-L1的表达也是独立的预后指标[17-19]。但也有相反报道在肺癌中PD-Ls表达与预后的无相关性[20]。
在有关肿瘤细胞表达PD-Ls抑制CD8+T细胞功能的研究中,Junzo发现卵巢癌上皮内CD8+TIL可以预测患者的预后。卵巢癌PD-L1的表达与卵巢癌上皮内CD8+TIL的计数呈负相关,而PD-L2的表达与卵巢癌上皮内CD8+TIL的计数无关。
肿瘤表达PD-L1诱导肿瘤免疫逃逸,导致肿瘤生长,提示PD-1/PD-L1途径可以作为肿瘤免疫治疗的新靶点。实际上已有各种动物实验研究发现阻断PD-1或PD-L1,可以有效地清除肿瘤。
[1]Groh V,Wu J,Yee C,et al.Tumour-derived soluble MIC ligands impair expression of NKG2D and T-cell activation[J].Nature,2002,419(6908):734.
[2]Pardoll DM.Spinning molecularimmunology into successful immunotherapy[J].Nat Rev Immunol.2002(4):227.
[3]Lang K,Entschladen F,Weidt C,et al.Tumor immune escape mechanisms:impact of the neuroendocrine system[J].Cancer Immunol Immunother.2006,55(7):749.
[4]Collins M,Ling V,Carreno BM.The B7 family of immune-regulatory ligands[J].Genome Biol,2005;6(6):223.
[5]Yamazaki T,Akiba H,Iwai H,et al.Expression of programmed death 1 ligands by murine T cells andAPC[J].J Immunol,2002,169(10):5538.
[6]Dong H,Strome SE,Salomao DR,et al.Tumor-associated B7-H1 promotes T-cell apoptosis:a potential mechanism of immune evasion[J].Nat.Med.2002,8(8):793.
[7]Hamanishi J,Mandai M,Iwasaki M,et al.Programmed cell death 1 ligand 1 and tumor-infiltrating CD8+T lymphocytes are prognostic factors of human ovarian cancer[J].Proc.Natl.Acad.Sci.USA,2007,104(9):3360.
[8]Strome SE,Dong H,Tamura H,etal..B7-H1 blockade augments adoptive T-cell immunotherapy fors quamous cell carcinoma[J].Cancer Res,2003,63(19):6501.
[9]Inman BA,Sebo TJ,Frigola X,et al.PD-L1(B7-H1)expressionby urothelial carcinoma of the bladde rand BCG-induced granulomata:asso-ciations with localized stage progression[J].Cancer,2007,109(8):1499.
[10]Konishi J,Yamazaki K,Azuma M,et al.B7-H1 expression on nonsmall cell lung cancer cells and its relationship with tumor-infiltratin glymphocytes and their PD-1 expression.Clin[J].Cancer Res,2004,10(15):5094.
[11]Nakanishi J,Wada Y,Matsumoto K,et al.Over expression of B7-H1(PD-L1)significantly associates with tumor grade and postoperative prognosis in human urothelial cancers[J].Cancer Immunol Immunother,2007,56(8):1173.
[12]Nomi T,Sho M,Akahori T,Hamada K,et al.Clinical significance and therapeutic potential of the programmed death-1 ligand/programmeddeath-1 pathway in humanpancreatic cancer[J].Clin CancerRes,2007,13(7):2151.
[13]Thompson RH,Gillett MD,Cheville JC,et al.Costimulatory B7-H1 in renal cell carcinoma patients:indicator of tumor aggressiveness and potential therapeutic target[J].Proc.Natl.Acad.Sci.USA,2004,101(49):17174.
[14]Wu C,Zhu Y,Jiang J,et al.Immunohistochemical localization of programmed death-1ligand-1(PD-L1)ingastric carcinoma and its clinical significance[J].Acta Histochem,2006,108(1):19.
[15]Hamanishi J,Mandai M,Iwasaki M,et al.Programmed cell death 1 ligand 1 andt umor-infiltrating CD8 T lymphocytes are prognostic factors of humanovarian cancer[J].Proc.Natl.Acad.Sci.USA,2007,104(9):3360.
[16]Hirano F,Kaneko K,Tamura H,et al.Blockade of B7-H1 and PD-1 by monoclonal antibodies potentiates cancer therapeutic immunity[J].Cancer Res,2005,65(3):1089.
[17]Thompson RH,Kuntz SM,Leibovich BC,et al.Tumor B7-H1 is associated with poor prognosis in renal cell carcinoma patients with long-term follow-up[J].Cancer Res,2006,66(7):3381.
[18]Ohigashi Y,Sho M,Yamada Y,et al.Clinical significance of programmed death-1 ligand-1 and programmed death-1 ligand-2 expression in human esophageal cancer[J].Clin Cancer Res,2005,11(8):2947.
[19]Wu C,Zhu Y,Jiang J,et al.Immunohistochemical localization of programmed death-1 ligand-1(PD-L1)in gastric carcinoma and its clinical significance[J].Acta Histochem.2006;108(1):19.
[20]Konishi J,Yamazaki K,Azuma M,et al.B7-H1 expression on non-small cell lung cancer cells and its relationship with tumor-infiltrating lymphocytesand their PD-1 expression[J].Clin Cancer Res,2004,10(15):5094.
