甲状腺癌组织中STAT3激活及VEGF 、Cyclin D1的表达
2010-06-13张纯海毕丽荣崔俊生
周 乐,张纯海,毕丽荣,崔俊生,孙 辉*
(1.吉林大学中日联谊医院甲状腺外科;吉林长春130033;2.吉林大学中日联谊医院病理科,吉林长春130033)
转录因子类癌基因STAT3的异常表达和激活在恶性黑素瘤、乳腺癌、前列腺癌、胃癌等多种肿瘤组织与细胞系中已证实存在[1]。笔者率先报道了STAT3在甲状腺癌组织中的表达,但其作用机制尚待进一步阐释。本实验研究甲状腺癌组织中活化STAT3(pSTAT3)蛋白表达以及STAT3信号传导通路成员(VEGF、Cyclin D1)的表达,以期了解 STAT3基因在人甲状腺癌发生、发展过程中的意义。
1 材料和方法
1.1 临床资料
24例甲状腺标本取自吉林大学中日联谊医院2007年7月-2007年12月手术切除组织,其中12例为甲状腺癌组织,包括乳头状癌10例,滤泡癌1例,髓样癌1例。另12例标本为相应癌组织旁1cm内甲状腺组织,作为对照组,病理类型包括结节性甲状腺肿、慢性淋巴细胞性甲状腺炎、正常甲状腺组织。取材后 20 min内迅速保存在液氮中,用于STAT3相关检测。
1.2 主要试剂
Trizol试剂购自 Invitrogen 公司。STAT3、pSTAT3、VEGF、Cyclin D1第一抗体均为DAKO产品。
1.3 方法
1.3.1总蛋白的提取 分别取甲状腺癌及癌旁对照组织各约100 mg,液氮环境下研磨成粉末,加入Trizol试剂,从有机相中提取总蛋白,参照Santa Cruz公司提取方法进行。
1.3.2Western blot分析 分别将50 μ g蛋白样品沸水中热变性,上样,进行电泳。电泳结束后将凝胶中蛋白转移至硝酸纤维素(polyvinyldifluori-de)膜上,Blocking Buffer(5%脱脂奶粉)室温封闭2 h。将亲和层析纯化的小鼠抗人pSTAT3多克隆一抗1∶300稀释溶于TBST中,4℃与膜孵育过夜,TBST洗膜10 min×3;加入1:300稀释的生物素标记的羊抗小鼠IgG二抗,室温孵育60 min,TBST洗膜10 min×3;再加入辣根过氧化物酶标记的三抗,室温孵育60 min,TBST洗膜10 min×3,末次用TBS洗膜10 min。加入DAB显色,待特异性条带信号清晰可见时用Stop Buffer终止染色。特异性条带的信号采用上海天能科技有限公司GIS凝胶图像分析系统处理。同样方法分析Cyclin D1、VEGF的蛋白表达情况。
1.3.3免疫组化分析 标本组织均经10%甲醛固定,石蜡包埋,5 μ m连续切片,用于STAT3免疫组化检测。切片常规脱蜡、水化后,用3%过氧化氢室温孵育10 min,以阻断内源性过氧化物酶。抗原微波修复,冷却至室温后,蒸馏水洗,PBS充分洗。正常血清封闭20 min,弃血清后,加入小鼠抗人STAT3多克隆抗体(稀释度为1∶300)后4℃冰箱过夜。滴加通用型IgG抗体(Fab段)-HRP多聚体,37℃孵育30 min,DAB显色,苏木素轻度复染,乙醇梯度脱水,二甲苯透明,中性树胶封片,光镜观察。阴性对照以磷酸盐缓冲液(PBS)代替一抗而其他条件均相同。参考Campbell等[1]的标准,采用半定量方法,免疫组化染色以细胞中出现棕黄色颗粒为阳性。按阳性细胞数来计算评分:着色细胞少于5%为阴性(-),着色细胞占5%-25%为弱阳性(+),着色细胞占26%-50%为阳性(++),着色细胞大于50%为强阳性(+++)。结果由两位高年资的病理科医生评估。
1.4 统计学处理
统计分析采用SPSS软件进行,采用Fisher精确检验,P<0.05作为评判统计学意义标准。
2 结果
2.1Western blot检测结果
2.1.1STAT 3的表达 在12例甲状腺癌标本中,蛋白表达阳性者12例,癌旁对照组3例见阳性表达25.0%(3/12),两组比较差异显著(P<0.01)。表达阳性者在90 KD的位置可见相应的条带,如图1所示。

图1 pSTAT3蛋白的Western blot检测结果
2.1.2相关因子CyclinD1、VEGF的蛋白表达 在12例甲状腺癌标本中,Cyclin D1、VEGF蛋白表达均呈阳性;癌旁对照组也可见阳性表达,但表达强度明显低于甲状腺癌组,经灰度扫描分析比较,两组均存在显著差异(P<0.01)。如图2,图3所示。

图2 VEGF、Cyclin D1蛋白的Western blot检测结果
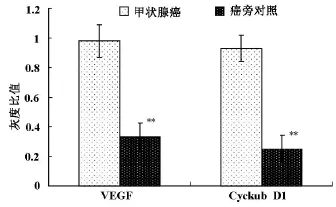
图3 VEGF、Cyclin D1蛋白灰度值与β-actin灰度值的比值分析结果
2.2STAT3的免疫组织化学结果STAT3在甲状腺癌组织中过表达,阳性信号主要定位于癌细胞的细胞浆,如图4所示。STAT3在甲状腺癌旁组织中不表达或呈微弱表达。统计显示,12例甲状腺癌组织中,STAT3阳性率为100%(12/12)。以上结果与WB检测结果相一致。
3 讨论

图4 STAT3在甲状腺乳头状癌中的表达,400×
STAT3是信号转导与转录激活因子家族的重要成员,大量研究表明STAT3与肿瘤的增殖、分化、细胞凋亡、血管生成、侵袭转移和免疫逃避密切相关,被定义为新的癌基因[2]。在恶性黑素瘤、乳腺癌、前列腺癌、胃癌等多种肿瘤组织与细胞系中已证实存在STAT3的异常表达和激活。笔者率先报道了STAT3在人甲状腺癌组织中的表达,本研究Western blot结果表明,12例甲状腺癌组织中pSTAT3蛋白的阳性率为100%(12/12),癌旁对照组3例见阳性表达25.0%(3/12),两组比较差异显著(P<0.01)。表明STAT3在人甲状腺恶性肿瘤中也产生作用,但其作用机制尚待进一步阐释。
STAT3转导信号和活化转录的详细机制迄今尚未完全阐明。作为Jaks的下游信号,激活STATs的酪氨酸激酶功能是由与受体结合的Janus激酶(Jak)所担任的[3]。通过上述过程,STAT3将CK激发的短暂的胞浆信号转化为长期的表达改变,从而调控细胞的多种生理功能。在不同细胞系中反应可不同,STAT3作用于一系列不同的靶基因,持续的细胞周期是肿瘤细胞增殖的重要特点。cyclin D1作为STAT3的下游基因,他们之间的相互作用很复杂,在Alvarez等[4]的研究报告中,证明CyclinD1在一定的条件下可被STAT3激活,而促进细胞的增殖。CyclinD1直接参与了癌肿的形成和存活 ,STAT3的组成性激活有诱导它的作用。我们研究发现STAT3下游基因Cyclin D1、VEGF在甲状腺癌组织与癌旁对照组中的表达具有显著的差异性,且STAT3和Cyclin D11、VEGF之间具有明显的的相关性。所以提示STAT3可能在甲状腺癌的发病机制中起一定作用。STAT3被异常激活后可能促进甲状腺癌细胞的增生,抑制细胞的凋亡,协助肿瘤细胞的转移过程等。其可能机制是STAT3与 Cyclin D1、VEGF启动子上的STAT3位点结合,促进了甲状腺组织中癌细胞的形成及转移。
甲状腺癌是内分泌系统最常见的恶性肿瘤,预后较好,但仍有10%-20%的难治性甲状腺癌如未分化甲状腺癌、复发甲状腺癌等利用现有治疗手段(手术、核素、内分泌治疗)难以取得较好疗效,而且甲状腺癌对放疗、化疗不敏感,所以探索基因治疗等新的治疗方式也成为甲状腺癌研究的热点[5]。鉴于STAT3基因在一系列常见肿瘤中起着中心作用,且对大多数成人的正常细胞、组织并不是必须的,所以靶向阻断STAT3治疗恶性肿瘤不但会是有效的,而且是合理的,在基因治疗方面表现出很大的前景。在多种细胞系和动物模型中已经证明,通过关键区域的阻断剂或RNA干涉等技术阻断STAT3的活化能导致肿瘤难以生存和增殖[6]。
综上,本研究提示在甲状腺癌中STAT3与Cyclin D1、VEGF作用密切相关,三者可能协同参与了甲状腺癌的发病进程,这将有助于加深对甲状腺癌的分子发生机制的认识。STAT3激活可能是肿瘤发生的早期事件,参与了Cyclin D1、VEGF基因的转录调控。因此可以考虑应用基因沉默技术干扰STAT3的表达或抑制其活性,进而抑制恶性肿瘤的发生或发展。
[1]Rahaman SO,Harbor PC,Chernova O,et al.Inhibiti on of concstitutively active STAT3 suppresses proliferation and induces apoptosis in glioblastoma multiforme cell[J].Oncogene,2002,21(55):8404.
[2]Bromberg JF,Wrzeszczymska MH,Devgan G,et al.Stat3 as an oncogene[J].Cell,1999,98(3):295.
[3]Darnell JEJr,Kerr IM,Stark GR,etal.Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins[J].Science,1994,264:1415.
[4]Avarez JV,Febbo PG,Ramaswamy S,et a1.Identification of genetic signiture of activated STAT3 in human tumors[J].Cancer Res,2005,65(12):5054.
[5]DeGroot LJ,Zhang R.Gene therapy for thyroid cancer:where do we stand[J].J Clin Endocrinol Metab,2001,86(7):2923.
[6]Mora LB,Buettner R,Seigne J,et al.Constitutive activation of Stat3 in human prostate tumors and cell lines:direct inhibition of Stat3 signaling induces apoptosis of prostate cancer cells[J].Cancer Res,2002,62(22):6659.
