BMP-2重组质粒转染骨髓间充质干细胞及表达的检测
2010-06-13张明磊高忠礼刘光耀
张明磊,常 非,高忠礼,柳 扬,刘光耀
(吉林大学中日联谊医院骨科,吉林长春130021)
骨髓间充质干细胞(BMSCs)作为骨组织工程常用种子细胞之一,具有很强的成骨分化能力,在特定环境中可以被诱导分化为成骨细胞,促进骨修复过程。但其成骨速度、成骨效率、修复骨缺损的效果并不令人满意[1]。基因治疗及转基因技术的发展为解决这些问题提供了一条有效的道路,将编码细胞因子的基因导入BMSCs中,植入骨缺损部位,在局部持续产生细胞因子,以自分泌和旁分泌的方式诱导成骨。本实验中将 BMP-2基因转染BMSCs,表达BMP-2,促进骨修复效应,为治疗临床上治疗骨缺损奠定良好的基础。
1 材料和方法
1.1材料pEGFP-N1/BMP-2真核表达质粒(吉林大学中日联谊医院骨科构建),LIPofectamineTM脂质体转染试剂盒(Gibco公司),DMEM培养基(美国Gibco公司),胎牛血清(美国Hyclone公司),SP免疫组化试剂盒、DAB(福州麦新生物技术有限公司),兔抗人BMP-2抗体(Santa Cruz)。
1.2方法
1.2.1质粒的制备 将质粒的转化保种菌液复苏至室温,各吸取 200 μ l至含有25 ml含 30 mg/ml的LB液体培养基中,37℃剧烈震荡(1 000 rpm)培养24 h。将扩增菌液收集于50 ml离心管中,于4℃6 000 g离心15 min,弃去培养液,低温干燥细菌沉淀。抽提、纯化质粒。-80℃低温保存用于细胞转染。
1.2.2BMSCs的培养 将液氮中冻存的BMSCs于42℃水中迅速复温,转移至75 ml培养瓶内,补充含10%低糖DMEM培养基至5 ml,在 37℃,含5%CO2的饱和湿度的CO2细胞培养箱中培养6 h,待细胞贴壁后,立即更换新鲜培养液。细胞铺满瓶底达70-80%左右时采用胰酶消化法按1∶4传代,观察细胞生长状态良好时,准备转染。
1.2.3细胞的转染 转染前一天,采用胰酶消化法将处于对数生长期的细胞制备成单个细胞液,计数后调整细胞浓度为2×105细胞/ml,接种于6孔板,每孔2ml。次日细胞融合铺满板底80%左右时进行转染。转染采用LIPofect-amineTM试剂盒进行。
1.2.4转染后的观察及计算转染率 细胞转染48小时,光镜和荧光显微镜下观察细胞转染后荧光表达情况。荧光显微镜观察:将盖玻片在荧光显微镜下,激发波长488 nm、发射波长507 nm荧光显微镜下直接观察细胞中绿色荧光强度及可显示绿色荧光细胞的比例,以此了解质粒在BMSCs的表达情况。
转染效率计算:在100倍下测量10个均匀分布的视野,并计算每个视野内的细胞总数和转染阳性细胞数:10个视野转染阳性细胞树之和/细胞总数之和=该孔细胞转染效率。
1.2.5ELISA方法检测BMP-2的表达 参照试剂盒说明 ,分别于1 d 、4 d、7 d、10 d、15 d、21 d 采用ELISA方法检测转染了各组质粒的BMSCs培养液中BMP-2蛋白的表达。
1.2.6免疫组织化学染色分析BMP-2、I型胶原、ALP及骨钙素 将细胞以1×105/mL、2mL/孔,接种于铺有经多聚赖氨酸处理过的盖玻片的24孔培养板中,培养24 h。PBS轻洗3次,4%的多聚甲醛4℃固定,血清封闭,室温孵育 10 min。倾去血清,滴加抗体,滴加50 μ L生物素标记的 1∶100稀释的二抗,37℃孵育 30 min,PBS冲洗,滴加 50 μ L新配置的DAB显色剂溶液,显色后,自来水冲洗,苏木素复染。梯度乙醇脱水,二甲苯透明,中性树胶封片。
2 结果
2.1 荧光显微镜下观察
荧光显微镜下观察,pEGFP-Nl/BMP2转染组发出绿色荧光。通过计算,转染率为38.4%。
2.2 ELISA方法检测BMP-2
结果显示正常BMSCs及BMP-2转染组均有目的蛋白的分泌,对两组组间进行统计学分析,BMP-2转染组与正常细胞有显著性差别(P<0.05)。
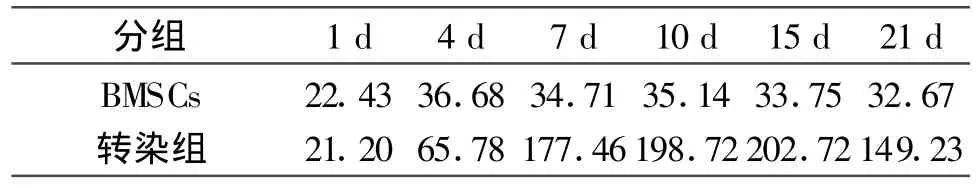
表1 各组平均BMP-2(pg/ml)
2.3 免疫组化染色
显微镜下观察,转染组细胞中均可见深棕黄色染色。提示BMP-2基因转染后在细胞中表达目的基因,并促进成骨方向转化。见图1。
3 讨论
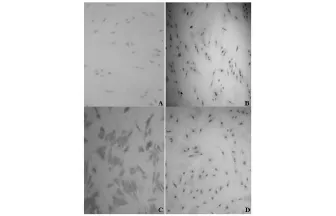
图1 A.BMP-2免疫组化染色;B.ALP免疫组化染色;C.I型胶原免疫组化染色;D.骨钙素免疫组化染色(×200)
1965年Urist[1]报道将脱钙骨基质植入同种动物的肌肉内,结果可诱导异位新骨形成,后来DBM经进一步分离提纯被证明是蛋白质分子,因此命名为骨形态发生蛋白,并证明了骨诱导学说。研究证实,BMPs是一组同源二聚体蛋白,为疏水性、酸性糖蛋白,由半胱氨酸结合的两条特异性链组成,分子量约30 kD。1988年 Wozney[2]等报道了人 BMP-1、BMP-2A、BMP-2B(BMP-4)和BMP-3的CDNA 克隆及表达,此后,学者们在这方面进行了大量的研究工作,到目前为止,已发现至少存在21种BMPs亚型。其中,BMP-2的研究较为广泛和深入,并被认为是诱导成骨活性最强,其对细胞的作用主要是促进细胞分化[3],能明显诱导从骨髓中分离得到的多潜能干细胞向软骨细胞、骨细胞分化,并且抑制其向脂肪细胞、肌细胞的分化方向。研究已证实BMP在植入局部的聚集比BMP的总剂量更重要,且BMP的剂量必须超过一个阈值才能有效诱导骨形成。在外伤骨折应用的剂量浓度为1.5 mg/mL,而低浓度无效[4]。体内、体外研究显示,BMSCs转染 BMP-2基因后,比单纯应有化学物诱导干细胞的成骨作用更明显。
在骨形成的过程中会产生许多骨代谢的生化标志物,这些能够直接反应骨性成的特异性指标被称为骨形成标记。常用的指标有I型胶原、碱性磷酸酶和骨钙素。I型胶原占骨组织有机成分中90%,是主要的骨结构蛋白。碱性磷酸酶是成骨细胞早期分化的标志,骨钙素(OC)的出现标志着成骨细胞的成熟。通过分析ALP、I型胶原和骨钙素的表达可以反应骨的形成过程。
骨组织中含有大量的ALP,存在于成骨细胞周围及其表面,ALP主要定位于粗面内质网网、高尔基体、胞浆膜及核膜上,是骨代谢的重要蛋白质,在矿化过程中起非常重要的作用,钙化多发生在ALP阳性区。极易释放入血,因而当成骨细胞增殖、骨生长亢进时会出现血清ALP活性上升。ALP的高表达是成骨细胞早期分化的标志[5]。
骨钙素又称为骨γ-羧基谷氨酸蛋白(bone carboxyglutamic acid Protein,BGP),占骨组织中非胶原蛋白的10-20%,是成骨细胞合成和分泌的特异性产物,为成骨细胞分化成熟的标志,反映了成骨细胞的成骨能力[6]。
本实验成功的利用脂质体将质粒转染入BMSCs,目的基因可以持续高表达,在生物化学和组织化学上,转染后的BMSCs具有富含ALP,可合成I型胶原,并且分泌骨钙素等典型特征,是广泛采用的成骨细胞鉴定标准,并作为成骨作用和代谢调节的评价指标[7]。通过免疫组化染色的方法证明,转染后的细胞向成骨方向分化。为利用BMP-2基因促进骨组织修复提供了实验基础。
[1]Urist MR.Bone formation by autoinduction[J].Science,1965,150(698):893.
[2]Wozney JM,Rosen V,Celeste AJ,et al.Novel regulators of bone formation:molecular clones and activities[J].Science,1988,242(4885):1528.
[3]Noden DM.Factors and mechnaisms influencing bone growth[M].New York:Alan.R.liss.1982:167.
[4]Mussano F,Ciccone G,Ceccarelli M,et al.Bone morphogenetic proteins and bone defects:a systematic review[J].Spine,2007,32(7):824.
[5]Jin YJ,Lien WH,Jsa WC,et al.Distinct regulation of genes by bFGF and VEGF-A in endothelial cells[J].Angiogenesis,2001,4(4):313.
[6]Marie PJ,Connes D,Hott M,et al.Comparative effects of a novel vitamin D analogne Mc-903 and 1.25-dihydroxy vitamin D3 on alkaline phosphatasea activity,osteocalcin and DNA synthesis by human osteblastic cell in culture[J].Bone,1990,1(3):171.
[7]Alborzi A,Nac-KG,Lackin CA,et al.Endochondral and intramenbranous fetal bone development:osteoblastic cell proliforation and expressing of alkaline phosphatase,mtwist and histone H4[J].J Crnaifac Genet Dev Biol,1996,16(2):94.
