紫杉醇-抗HER2MAb偶联物体外抗肿瘤活性的研究
2010-06-13郭晓雷张秋影佟青曲成刚韩智星张桂荣
张 玲,郭晓雷,张秋影,佟青,曲成刚,施 维,韩智星,张桂荣*
(1.吉林大学第一医院 检验科,吉林 长春130021;2.南航吉林分公司航卫室,吉林 长春130031;3.吉林大学白求恩医学院生化教研室,吉林长春130021;4.吉林大学分子酶学工程教育部重点实验室,吉林长春130012)
利用单克隆抗体对肿瘤细胞表面抗原的选择特 异性,对抗癌药物进行主动靶向设计研究,可提高抗癌药物对肿瘤细胞的选择性,实现靶向治疗,降低对正常器官的毒性。1958年,Mathe首次将抗鼠白细胞免疫球蛋白与甲氨蝶偶联用于靶向治疗,随后出现了各种抗癌药物与各种抗体的偶联物。目前,抗体偶联的靶向抗癌药物研究正在成为生物技术药物领域的新热点,并具有良好的前景。
本课题组采用活化酯法将抗癌化学药紫杉醇与抗HER2单克隆抗体偶联,合成了免疫偶联物(TAX-抗HER2MAb)靶向抗癌药,本文以乳腺癌MCF-7细胞为药物作用对象,研究免疫偶联物TAX-抗HER2MAb的体外抗肿瘤活性,为乳腺癌的靶向治疗提供了实验基础。
1 材料与方法
1.1 材料
TAX-抗HER2MAb偶联物为本课题组先期合成;人乳癌细胞株MCF-7由吉林大学生命科学院酶工程实验室提供;HER-2抗原Biovision;HRP-羊抗鼠IgG华特生生物技术有限公司;BSA Sigma产品;MTT Genview产品;RPMI-1640美国Hyclone产品;FCS杭州四季青生物工程材料公司;V-FITC细胞凋亡检测试剂盒Annexin;DYY-Ⅲ稳压稳流高压电泳仪(北京六一仪器厂);Tanon GLS-2010凝胶成像(上海天能);Horaues型二氧化碳培养箱(日本SANYO公司);ELTIE型流式细胞仪(美国Coulter公司);BHZ型光学显微镜(日本OLYMPUS公司);转膜系统(Bio-Rad)。
1.2 方法
1.2.1MTT法检测T AX-抗HER2MAb偶联物对肿瘤细胞增殖的抑制作用 实验设空白对照组(正常培养的MCF-7乳癌细胞悬液)、试剂对照组(加DMSO)、TAX药物组及偶联物药物组(设5个药物浓度:1.28×10-2nmol/L、6.4×10-2nmol/L、3.2×10-1nmol/L、1.6 nmol/L、8 nmol/L),每组均设3个平行孔。
取对数生长期的乳癌MCF-7细胞,以0.25%胰蛋白酶消化1.5min,1 000 rpm离心5 min,沉淀细胞以RPMI-1640培养液制成5×104个浓度单细胞悬液,接种于 96 孔培养板,每孔 100 μ l,37℃、5%CO2饱和湿度培养24 h后,观察细胞生长良好,换培养液;按实验分组向各孔加药,置37℃、5%CO2饱和湿度培养 20h;每孔加 5 mg/ml的MTT 20 μ l,继续培养4h终止培养,吸去培养液,每孔加DMSO 150 μ l,振荡使甲溶解,酶标仪570 nm检测各孔吸光度值(A值)。按[(1-实验组平均A值/肿瘤细胞对照组平均A值 )×100%]计算肿瘤细胞的生长抑制率;以药物浓度的对数为横坐标,以细胞生长抑制率为纵坐标绘制半对数曲线,计算半数抑制药物浓度IC50。
1.2.2FCM检测细胞凋亡率 实验分组:设阴性对照组(正常培养的MCF-7乳癌细胞)及加药组(分设为1.6 nmol/L TAX组、1.6 nmol/L偶联物组及1.6 nmol/L TAX+1.6 nmol/L单抗组)。
对数生长期MCF-7细胞,0.25%的胰蛋白酶消化后,制备5×104/ml单细胞悬液接种于新培养瓶中,37℃,5%CO2培养24 h完全贴壁,把细胞培养液吸出至离心管内,PBS洗涤贴壁细胞,0.25%的胰蛋白酶液消化;加入上步收集的细胞培养液,混匀,转移至离心管,1 000 rpm离心5min,收集细胞,用PBS轻轻重悬细胞并计数。
细胞凋亡检测参照Annexin V-FITC试剂盒说明书操作程序操作。
取5-10万个重悬的细胞,1 000 rpm离心5min,弃上清,加入 195 μ l Annexin V-FITC 结合液轻轻重悬细胞 ;加入 5 μ l Annexin V-FITC,轻轻混匀 ;室温避光孵育10 min;1 000 rpm离心5 min,弃上清,加入190 μ l Annexin V-FITC结合液轻轻重悬细胞;加入10 μ l PI染色液,轻轻混匀,冰浴避光放置;流式细胞仪检测设空白对照组、PI空白对照组及Annexin VFITC空白对照组分析细胞凋亡情况。
1.2.3琼脂糖凝胶电泳分析细胞基因组DNA TE饱和酚法分别提取TAX和偶联物作用24h的肿瘤细胞DNA,琼脂糖凝胶电泳,凝胶成像系统分析。
1.2.4Western-blot检测细胞HER2蛋白表达 以浓度均为1.6 nmol/L的偶联物及TAX分别加入培养24 h贴壁生长良好的MCF-7细胞继续培养24 h,离心收集细胞;以细胞裂解液裂解细胞;10 000 rpm 4℃离心3 min,取上清;SDS-PAGE电泳,分离胶浓度15%,积层胶浓度5%,积层胶电压8 V/cm,分离胶电压14 V/cm,电泳时间根据溴酚蓝指示。考马斯亮蓝染液,脱色。电泳凝胶片按目的蛋白的位置切割并做出标记放入转移液中;半干式转移装置转PVDF膜,转膜电流1 mA/cm2,1.5 h;丽春红染色10 min;室温去离子水漂洗PVDF膜,直至蛋白条带消失;5%脱脂奶粉封闭,先后与一抗及HRP-羊抗鼠二抗反应,DAB显色,摄像保存;β-Tubulin作内参。
1.2.5统计学分析 MTT结果以均数±标准差表示,两两均数之间的比较使用 t检验;以P<0.05为具有统计学意义。数据分析采用SPSS11.5软件进行统计学处理。
2 结果
2.1 MTT法检测TAX-抗HER2MAb偶联物对肿瘤细胞增殖的抑制作用
对细胞的抑制作用TAX实验组与TAX-抗HER2MAb偶联物实验组在相同药物浓度时,偶联物组抑制率明显高于TAX组,经统计学处理具有统计学意义(P<0.05),见表2.1和图2.1。半数抑制率药物浓度(IC50)TAX组为6.00 nmol/L,偶联物组为3.97 nmol/L,二者相比较具有统计学意义(P<0.05)。

图2.1 TAX-抗HER2MAb偶联物与TAX对MCF-7细胞的生长抑制率
表2.1 各组吸光度值与细胞生长抑制率(s)

表2.1 各组吸光度值与细胞生长抑制率(s)
*P<0.05
分组 吸光度 抑制率DMSO溶剂对照组 0.1766±0.0023肿瘤细胞对照组 0.6656±0.0050紫杉醇组nmol/L 1.28×10-2 0.552 6±0.0047 0.198 2±0.012 5 6.4×10-2 0.531 0±0.0052 0.258 9±0.011 2 3.2×10-1 0.498 0±0.0010 0.335 1±0.009 0 1.28×10-2 0.492 3±0.004 00.327 0±0.007 8*6.4×10-2 0.469 3±0.001 50.385 6±0.006 0*3.2×10-1 0.450 3±0.003 70.433 7±0.012 0*
2.2 FCM检测细胞凋亡率
经流式细胞仪检测,肿瘤细胞对照组即阴性对照组中细胞凋亡率为1.5%,TAX组细胞凋亡率为12.5%,TAX+抗HER2单抗组细胞凋亡率为13.9%,而偶联物组细胞凋亡率为25.9%,图2.2。

图2.2 Annexin V/PI双染色法检测MCF-7细胞凋亡率图谱
2.3 琼脂糖凝胶电泳分析凋亡细胞DNA
由图2.3可以看出,经TAX和偶联物处理的MCF-7乳腺癌细胞均出现了细胞凋亡DNA特征性梯状条带,偶联物组较TAX组凋亡数多;对照组细胞基因组DNA比较完整。表明药物对肿瘤细胞有促进凋亡作用,并且偶联物组促凋亡效果明显。

图2.3 肿瘤细胞凋亡DNA琼脂糖凝胶电泳图
2.4 Western-blot检测细胞HER2蛋白表达水平
转膜后内参蛋白和HER2蛋白的免疫印迹图谱如图2.4。由图可见HER2蛋白表达量偶联物药物组低于TAX组,TAX组低于对照组。
3 讨论
随着对恶性肿瘤发生和发展分子机制的深入研究,分子靶向治疗在肿瘤的治疗领域越来越受到重视。靶向药物最显著特点是能将药物最大限度地运送到靶区,使药物在靶区浓集,直接作用于病变组织、器官和细胞,延长药物与靶部位的作用时间,从而减少用药量和药物的毒副作用[1]。根据药物分子的大小,可将分子靶向抗肿瘤药物分为大分子单克隆抗体类和小分子化合物类[2]。
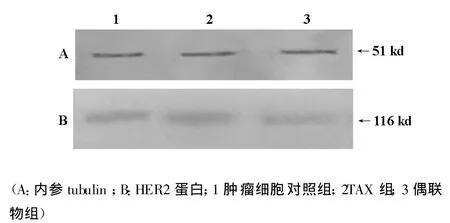
图2.4 Western-blot图谱
单克隆抗体靶向药物是利用单抗对肿瘤表面相关抗原特异性识别,把药物直接导向肿瘤细胞,提高药物的疗效,降低药物对循环系统及其他部位的毒性。目前抗肿瘤单克隆抗体可以分为两类:①单克隆抗体:单克隆抗体作为药物能特异结合到肿瘤细胞表面,通过直接的抗原-抗体反应导致细胞调亡。1997年以来,美国FDA已先后批准9种抗体药物用于肿瘤治疗。②抗肿瘤单克隆抗体偶联物,又称免疫偶联物(immunoconjugate),即单克隆抗体与抗癌化学药、毒素等的偶联复合体。
紫杉醇(paclitaxel)系FDA于1992年12月批准上市的抗癌药,由于其抗癌谱广、副作用相应小于其他抗肿瘤药物,已成为临床上广泛使用的首选抗癌药物。紫杉醇抗癌作用机制比较复杂,现在普遍认同的机制有:①微管稳定作用;②免疫机制;③诱导细胞凋亡;④抑制肿瘤细胞迁移[3,4]。
HER2是跨膜受体,其胞外域信号分子结合部位与配体结合后被活化而引发相关信号分子级联激活,进而传递到胞内靶分子而激活靶基因。HER2的基因过表达见于25%-30%的乳癌患者,也是乳癌发展进程中最有用的分子预后指标[5]。已经证实HER2基因的致癌性是通过该基因的过表达。
HER2单克隆抗体能够特异识别和结合HER2,进而干扰由HER2介导的细胞信号转导途径,抑制有丝分裂、细胞周期、侵袭和转移、血管形成及DNA修复;另外HER2单克隆抗体具有增强乳癌细胞对化疗的敏感性的作用[6,7,8]。
通过MTT法体外肿瘤细胞增殖的抑制作用表明TAX-抗HER2MAb偶联物的作用高于单纯的TAX,半数抑制率时药物的浓度(IC50)TAX组为6.00 nmol/L,偶联物组为3.97 nmol/L,即在达到相同抗肿瘤作用时用药量可以减少20.3%。Western-blot检测HER2蛋白表达,偶联物可以明显抑制肿瘤细胞HER2蛋白的表达量,阐明偶联物可能阻断了由HER2介导的细胞信号转导途径,使HER2基因的表达下调。FCM法细胞凋亡检测及凋亡细胞基因组DNA检测研究表明,偶联物对肿瘤细胞的抑制、诱导凋亡等作用比紫杉醇及紫杉醇+HER2单克隆抗体效果好,具有统计学意义。本文通过体外抗肿瘤实验研究,初步证明TAX-抗HER2MAb偶联物的抗肿瘤作用强于单纯的 TAX、HER2单抗及 TAX+HER2单抗,为靶向药物的合成及临床应用奠定了实验基础。
[1]Wolff AC,Hammond ME,Schwartz JN,et al.AmericanSociety of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor Receptor 2 testing in breast cancer[J].Arch Pathol Lab Med,2007,131(1):18.
[2]李 娟,李延团,李晓明,等.分子靶向抗肿瘤药物研究进展[J].生物技术通讯,2009,20(3):411.
[3]Horowitz SB.Mechanism of action of taxol[J].Trends Pharmacol Sci,1992,13(4):134.
[4]Hu X Y,Meng G,BaoY Y,et al.Relationships between induction of apoptosis by Taxol in Hela cells and apoptosis-related proteins[J].Chin Pharmacol Bull,2004,20(9):1063.
[5]Robert N,Leyland-Jones B,Asmar L,et al.Randomized phaseⅢstudy of trastuzumab,paclitaxel,and carboplatin compared with trastuzumab and paclitaxel in women with HER-2-over expressing metastatic breast cancer[J].J Clin Oncol,2006,24(18):2786.
[6]刘 东,饶子超,陈兆聪.紫杉醇与抗HER2单抗Sc7301偶联物对肿瘤细胞株的体外杀伤效应[J].中国医药学杂志,2007,27(7):10.
[7]XIE Jiang-wei,WANG Chi-hwa.Self-assembled biodegradable nanoparticles developed by direct dialysis for the delivery of paclitaxel[J].Pharm Res,2005,22(12):2079.
