Syk基因转染对人结肠癌细胞系影响的实验研究
2010-06-13于庆功常慧丽李明强刘春英
于庆功,常慧丽,李明强,舒 敏,王 伟,刘春英
(大连大学附属中山医院消化科,辽宁大连116001)
Syk(Spleen tyrosine kinase)是一种B细胞激活信号转导中最重要的激酶[1]。近来对Syk与肿瘤相关性研究证实,Syk可以抑制多种恶性肿瘤的生长,从而引发了对非受体酪氨酸激酶在肿瘤发生发展和转移过程中作用的研究。肿瘤的发生发展转移是多阶段、多因素的复杂过程,其中逃避免疫监视则是最为重要的环节之一[2]。因此,分析与Syk基因有关的抗肿瘤免疫活性,探讨因Syk表达缺失而导致的肿瘤免疫逃逸作用及其机制具有十分重要的价值。本研究将Syk基因克隆到逆转录病毒载体中,在脂质体作用下将该载体转染人结肠腺癌细胞LoVo,检测该细胞的生长周期变化。
1 材料与方法
1.1 材料
人结肠腺癌细胞系LoVo购自中国科学院上海细胞库。DH5α,逆转录病毒载体 pLNCX为本室保存。PCR试剂盒、反转录PCR扩增试剂盒、DNA连接试剂盒和限制性内切酶购自宝生物大连有限公司 。TRIzolTM Reagent、Lipofectamin、Genecitin 购自GIBCO BRL公司。
1.2 方法
1.2.1目的基因的聚合酶链反应(PCR)按TR I-zol试剂盒说明书提取脾脏组织总RNA,根据反转录和PCR试剂盒操作说明扩增Syk cDNA。根据Gen-Bank中登录的Syk cDNA序列设计引物,上游引物序列为:5′2CACC ATG GCC AGC AGC GGC ATGGCT G23′,下游引物序列为 :5′2GTT CAC CAC GTC ATA GTAGTA ATT GCG23′。hGAPDH PCR 引物:5′-TCC TCT GAC TTC AAC AGC GAC ACC-3′和 5′-TCT CTC TTC CTC TTG TGC TCT TGG-3′。扩增产物用 5 g/L琼脂糖凝胶电泳分析。
1.2.2Syk基因逆转录病毒表达载体的构建 收集脾脏组织细胞,一步法提取细胞总RNA,经逆转录合成cDNA,以特异引物进行PCR扩增,其扩增长度为1909bp。循环参数为:预变性94℃1分钟,变性98℃10秒;退火55℃30秒;延伸72℃1分钟,循环30次,后延伸72℃5分钟。PCR产物经琼脂糖凝胶电泳,回收。回收的PCR产物和逆转录病毒载体分别用Cla I和Hind III双酶切,在T4DNA连接酶作用下进行目的基因cDNA片段克隆,构建成Syk基因的真核表达载体,命名为pLNCX-Syk。质粒pLNCXSyk转化到DH5?感受态菌,通过PCR、酶切鉴定重组,采用ABI PRISMTM 377(Perkin Elmer)型全自动测序仪进行测序。
1.2.3pLNCX-Syk转染LoVo细胞 pLNCX-Syk质粒经Lipofectamine介导转染结肠癌细胞。转染后36小时,加入 Genecitin(200 μ g/ml)筛选细胞。筛选7天,挑出耐受新霉素而能生长的阳性克隆命名为pLNCX-Syk+,此时空白对照细胞全部死亡。Genecitin终浓度改用100 μ g/ml扩增培养阳性克隆5周后,用于以下实验。空质粒载体pLNCX转染结肠癌细胞的阳性克隆命名为pLNCX-Syk-,作为阴性对照。
1.2.4Southern blot分析 为了检测外源基因是否整合于结肠癌细胞基因组之中,选择逆转录病毒载体上的抗性基因——新霉素(Neo)基因编码区片段作为探针进行杂交,探针大小为770 bp。选择Neo基因编码区两侧的EcoR I和BamH I酶切位点,对基因组DNA进行酶切。提取细胞基因组DNA转移至尼龙膜上,以Neo为探针进行杂交。
1.2.5转染细胞中Syk基因转录的检测 逆转录病毒载体引物经计算机网上检索确认与人类细胞基因组无同源性,所以细胞基因组中如果没有外源载体引物基因,RT-PCR结果将为阴性。如有载体引物基因mRNA转录,RT-PCR将为阳性结果。使用载体引物,RT-PCR鉴定Syk基因mRNA在细胞内的转录。逆转录反应体系中以DEPC水代替AMV作为阴性对照。PCR反应产物经1.5%琼脂糖凝胶电泳,回收片段并纯化,以载体引物为测序引物,对上述片段进行测序。
1.2.6细胞生长倍增时间的测定 接种细胞(1×104/孔)于24孔板中,每隔24h对每种细胞的3个孔进行消化计数,求平均值。细胞倍增时间计算方法:培养96小时后计数的细胞数=接种的细胞数×2n(n=细胞96小时的增殖倍数),细胞倍增时间(小时)=96/n
2 结果
2.1 重组质粒pLNCX-Syk的鉴定
重组质粒DNA用限制性内切酶Cla I和HindⅢ双酶切,1.5%琼脂糖凝胶电泳显示的条带与设计大小一致[图1]。应用pLNCX载体引物进行目的基因测序,测序结果与Gene Bank(AF015950)完全一致,没有发生碱基突变。
2.2 Southern杂交鉴定
用EcoRⅠ和BamH Ⅰ双酶切,可切下包含Neo基因编码区的DNA片段。因此,以Neo基因编码区片段作为探针进行杂交,可以检测到分子量在1 900 bp左右的杂交带[图2]。结果显示,转染逆转录病毒载体pLNCX和pLNCX-Syk质粒的LoVo细胞均有杂交带,而未转染的细胞没有杂交带。说明外源Syk基因已整合到LoVo细胞基因组。
2.3 转染细胞中Syk基因mRNA水平的检测
提取转染细胞的总 RNA,应用载体引物进行RT-PCR检测,结果表明Syk基因在mRNA水平有转录,而阴性对照则没有转录[图3]。同时将RT-PCR反应产物经1.5%琼脂糖凝胶电泳,回收片段并纯化,以pLNCX载体引物为测序引物进行测序,结果与设计序列完全一致,再次证明外源Syk基因在细胞内能够转录。
2.4 细胞生长分析
pLNCX-Syk+细胞较pLNCX-Syk-细胞生长明显缓慢,pLNCX-Syk-细胞的倍增时间为30-33小时,而pLNCX-Syk+细胞倍增时间延长至68-72 h,说明对结肠癌细胞的生长有明显的抑制作用。

图1 重组质粒酶切鉴定
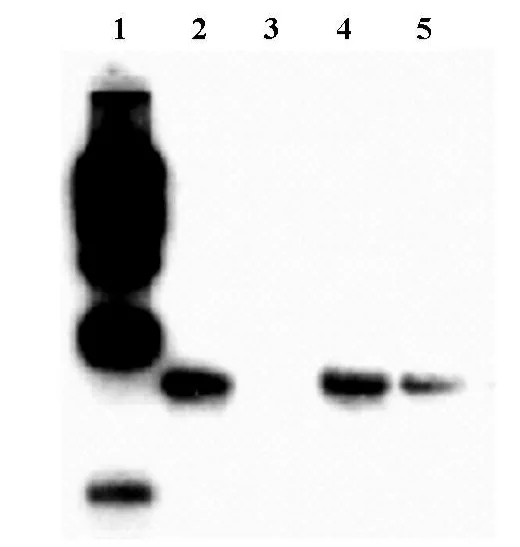
图2 Southern杂交鉴定
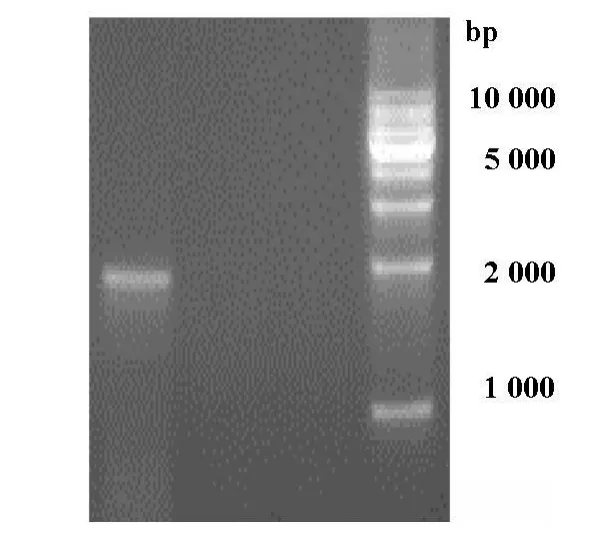
图3 转染细胞中Syk基因mRNA水平的检测
3 讨论
人类Syk编码基因为Syk基因,位于人类染色体9q22,蛋白质分子量为72 KD,由629个氨基酸组成,是一种非受体型的酪氨酸激酶,在B细胞的成熟和活化过程中起关键性作用[3]。Syk在自体磷酸化部位含有两个Src同源功能区SH2(N)和SH2(C),与T细胞激活中的ZAP-70属于同一个蛋白酪氨酸激酶(PTKs)家族,是磷酸化ITAM(依赖酪氨酸的免疫受体活化基序)招募的首选对象,与之结合后而激活,进而启动B细胞活化信号转导途径,激活各种转录因子转位进入细胞核,使相应基因产物表达,调整B细胞等细胞克隆的蛋白质表达、细胞分化或凋亡[4]。Syk基因的表达缺失会致T、B淋巴细胞活化障碍,失去了对异化细胞的监测作用,从而导致肿瘤的形成和转移[5,6]。研究发现,Syk不但是免疫调节因子,在肿瘤发生发展中也发挥着重要的作用。目前研究发现在多种恶性肿瘤的发病过程中存在着Syk表达缺失的现象。Coopman等发现Syk是促进乳腺上皮细胞生长的强力因子,他们通过正常乳腺组织和乳腺癌的原位杂交实验验证了Syk在正常乳腺上皮细胞和正常乳腺上皮细胞株MCF10A中表达,在原位癌中表达受抑制,而在有典型恶性表现(高转移性和侵袭性)的乳腺癌中表达缺失,进而提出Syk表达缺失与肿瘤的发生存在相关性[7]。Sada等认为Syk是一种候选抑癌基因,Syk的表达缺失会致免疫细胞发育、成熟障碍,重者会导致重症联合免疫缺陷病(SCID),由于机体免疫细胞的成熟障碍,机体的免疫监测力下降,对突变、异常增生的细胞失去免疫力,从而导致肿瘤易发[8,9]。
大肠癌恶性生物学特性的表达是依赖于多因素影响和多基因调控的,抑癌基因在大肠癌发生发展过程中的作用日益受到重视。杨祖立等采用巢式双重甲基化特异性聚合酶链反应(MSP)和RT-PCR方法检测120结直肠癌病例探讨Syk基因启动子甲基化与结直肠癌侵袭转移之间的关系发现120例结直肠癌患者中,48例未检测到Syk mRNA的表达,而癌旁正常组织均有表达;37例肿瘤组织发生Syk基因启动子甲基化,癌组织Syk基因启动子甲基化显著高于正常组织;有淋巴结转移的56例中,24例发生Syk基因启动子甲基化,而无淋巴结转移的64例中,13例发生甲基化,有淋巴结转移的Syk基因启动子甲基化发生率显著高于无淋巴结转移组,而发生甲基化的肿瘤组织中均无SykmRNA的表达,说明基因甲基化可以导致Sykm-RNA的表达缺失,进而引起结直肠癌的侵袭性增强,这可能是结直肠癌发生侵袭、转移的又一种机制[10]。本实验结果显示,转染Syk cDNA的LoVo细胞比转染空载体和未转染的细胞倍增时间显著延长,提示Syk基因逆转录病毒载体通过外源Syk基因mRNA水平的表达,从而抑制人结肠腺癌细胞的生长。
Syk在大肠癌中的作用机制、表达缺失的原因以及Syk如何抑制肿瘤细胞侵袭生长与转移的具体机制等尚不清楚。有研究认为HER 2的过度表达可以使内皮细胞收缩,内皮细胞间隙增宽,使肿瘤细胞易于从内皮细胞穿越,从而易于使肿瘤细胞发生转移。Syk与HER 2的作用相反,其抑制癌的转移可能是通过拮抗HER2的作用,扩张内皮细胞,减少内皮细胞间隙来实现。综合上述研究表明Syk对大肠癌的生长和转移可能有抑制作用,进一步研究Syk基因的作用机制,可为大肠癌的治疗提供新的思路。
[1]Stewart ZA,Pietenpol JA.Syk:a new player in the field of breast cancer[J].Breast Cancer Res,2001,3(1):5.
[2]TuenerM,Schweighoffer E,Colucei F,et al.Tyrosine kinase Syk,essential functions for immunorecep tor signaling[J].Imm unol Today,2000,21(3):148.
[3]Turner M,Mee PJ,Costello PS,et al.Perinatal lethality and blocked B-cell development in mice lacking the trrosine kinase Syk[J].Nature,1995,378(6554):298.
[4]Craxton A,Jiang A,Kurosaki T,et al.Syk and Bruton’styrosine kinase are required for B cell antigen receptor mediated activation of the kinase Akt[J].J Biol Chem,1999,274(43):30644.
[5]Goodman PA,Wood CM,Vassilev A,et al.Spleen tyrosine kinase(Syk)deficiency in childhood proB cell acute lymphoblastic leukemia[J].Oncogene,2001,20:3969.
[6]Zhu D,Tibbles H,Vassilev A,et al.SYK and LYN mediate Bcell receptorindependent calciuminduced apoptosis in DT40 lymphoma Bcells[J].Leuk Lymphoma,2002,43:2165.
[7]Coopman J,Do MT,Barth M,et al.The Syk tyrosine kinase suppresses malignant growth of human breast cancer cells[J].Nature,2000,406(6797):742.
[8]Sada K,Takano T,Yanagi S,et al.Structure and function of Sykproteintyrosine kinase[J].J Biochem(Tokyo),2001,130:177.
[9]Djeu J,Jiang K,Wei S.A view to a kill:signals triggering cytotoxicity[J].Clin CancerSykproteintyrosine kinase[J].J Biochem(Tokyo),2001,130:177186..Breast Cancer Res,2001,3(1):527.
[10]杨祖立,汪建平,元云飞,等.结直肠侵袭性与脾酪氨酸激酶基因Syk启动子甲基化的关系[J].中华实验外科杂志,2005,22(1):68.
