吲哚氰绿排泄试验与参与肝纤维化的细胞因子-TGF-β1mRNA的相关性研究
2010-06-13夏凤国范建华
夏凤国,范建华
(1.北华大学第一临床医院 普外科,吉林 吉林132011;2.北华大学第一临床医院 神经内科,吉林 吉林132011)
肝纤维化是慢性肝病最重要的病理特征,也是进一步向肝硬变发展的中间环节。目前研究表明:肝纤维化早期是可逆的。但到后期出现肝硬变时则不可逆,对于肝硬变,目前尚无行之有效的治疗措施。目前”肝穿刺”活检是诊断肝纤维化的金指标,但因其操作有创性,不易反复使用,使其应用受到限制。在”无创”诊断肝纤维化方面,人们已经找到许多与肝纤维化相关的血清标志物,目前临床上已经将血清TGF-β1的检测作为诊断早期肝纤维化的指标,但研究表明肝组织中TGF-β1mRNA表达与肝纤维化程度的相关性比血清TGF-β1更密切。故本实验旨在研究ICG15 min潴留率与细胞因子-β1 mRNA表达的相关性,从基因水平,证明ICG15 min潴留率可以作为诊断早期肝纤维化的一个敏感指标。前期实验已证明该实验与肝纤维化病理分期具有很好的相关性。
1 材料和方法
1.1实验动物清洁级Wistar大鼠52只,雌雄各半,体重180-250 g之间,由吉林大学实验动物中心提供,清洁级条件喂养,自由进食进水。
1.2试剂吲哚氰绿(ICG),购自沈阳济世制药有限公司,国药准字H20045514;四氯化碳,购自吉林市化学制剂厂;精制玉米油,购自营口渤海油脂工业有限公司。
1.3方法
1.3.1动物分组及模型制备 将52只大鼠随机分为正常组(10只)和模型组(42只),模型组分四笼喂养。模型组(肝纤维化组),以液体石蜡和精制玉米油2:3配制成40%油溶液,首次以5 ml/kg体重皮下注射,以后3 d一次,3 ml/kg皮下注射。正常组不行任何处置。实验期间所有大鼠标准饮食。每天观察大鼠的一般状况、饮食变化、行为(自主活动、精神状态)变化、毛发变化。在造模过程中,死亡6只。
1.3.2ICG15分钟潴留率测定方法ICG浓度按药物说明书绘制ICG标准曲线。取样品血浆1 ml加生理盐水2ml稀释混匀,752型紫外分光光度计805 nm处测定吸光度。查标准曲线计算出ICG浓度。ICGR15=ICG浓度/1.0×100%.
1.3.3半定量RT-PCR法检测大鼠肝组织TGF-β1mRNA表达。
TGF-β1上游引物为:5′-GTAGACGATGGGCAGTGGCT-3′;下游引物为:5′-CTGGAAAGGGCTCAACACC-3′;扩增片断长312bp。内参GAPDH上游引物为:5′-GGGTGATGCTGGTGCTGAGTATGT-3′;下 游 引 物 为:5′-AAGAATGGGAGTTGCTGTTGAAGTC-3′;扩增片断长616 bp。
1.4统计学处理应用SPSS12.0统计学软件进行数据分析处理,多组变量采用单因素方差分析,多个样本均数两两比较采用q检验,采用Pearson相关分析法计算两组变量相关性分析。
2 结果
2.1动物大体情况观察
正常组大鼠在实验进行期间活泼程度、自卫意识、饮食饮水、体毛皮表等无明显变化,无死亡。造模组大鼠1-4周间无明显变化,5周以后体毛明显不顺,饮食饮水稍减少,但体重无减轻。造模8周结束后,造模组大鼠死亡2只。以上各组动物经麻醉打开腹腔后,造模8周的大鼠腹腔有腹水,量不等。
2.2肝纤维化形成过程中不同时间ICG15 min潴留率与TGF-β1基因表达变化(见表1)
表1 肝纤维化形成过程中不同时间CG15分钟潴留率与TGF-β1基因表达变化(s)
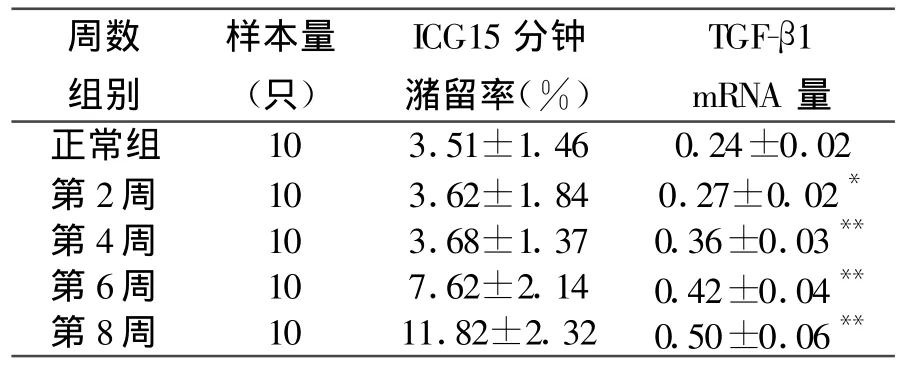
表1 肝纤维化形成过程中不同时间CG15分钟潴留率与TGF-β1基因表达变化(s)
*P<0.05,**P<0.01与正常组比较
周数组别样本量(只)ICG15分钟潴留率(%)TGF-β1 mRNA量正常组 10 3.51±1.46 0.24±0.02第2周 10 3.62±1.84 0.27±0.02*第4周 10 3.68±1.37 0.36±0.03**第6周 10 7.62±2.14 0.42±0.04**第8周 10 11.82±2.32 0.50±0.06**
2.3细胞因子-TGFβ1基因表达结果见附图
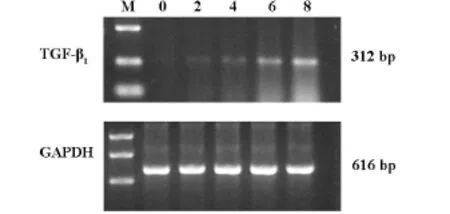
图1 实验性肝纤维化形成过程中 TGF-β1mRNA的表达(半定量 RT-PCR)
2.4ICG15分钟潴留率与细胞因子-TGFβ1基因表达相关性分析
ICG15分钟潴留率与细胞因子-TGFβ1基因表达呈正相关,相关系数为:0.909 9(P值均<0.05)。
3 讨论
吲哚氰绿(ICG)是一种暗绿色的无毒色素,副作用极少,其静脉注射后被肝细胞选择性摄取,并以原形排入胆汁,其不参与肝肠循环,亦不经肾脏排泄。影响其代谢的主要原因是肝血流量,有功能的肝细胞总数,胆汁的分泌和胆道通畅程度。除上述外,还与血浆蛋白含量、窦侧细胞膜通透性、肝细胞内载体蛋白、肝细胞向毛细胆管排泄及转运能力、毛细胆管以下胆道通畅情况有关。已被应用于肝储备功能的检测。根据其代谢特点能够反映肝纤维化程度成为可能。
细胞因子在肝纤维化发生、发展过程中的作用极为复杂。具有多样性、双向性,是当前肝纤维化研究的活跃领域。在众多的促肝纤维化形成的细胞因子中,转化生长因子-β1(TGF-β1)是具有多种生物学功能的细胞因子,能够调节几乎所有类型细胞的生长、分化和凋亡。它还是重要的免疫调节因子,也是目前发现的最强的致纤维化因子。
1978年De Larco等学者在小鼠肉瘤病毒转化的细胞株条件培养基中鉴定出具有促进细胞生长和转化特性的物质,称之为转化生长因子(TGF)。后来的研究发现这种 TGF包括两种成分:TGFα、TGFβ;TGFα具有促进细胞转化作用,TGFβ与器官纤维化有关。目前研究的转化生长因子-β,除非特指,一般均指TGF-β1。
3.1转化生长因子-β的分子结构、受体及作用途径
转化生长因子-β1(TGF-β)属生长因子超家族,哺乳动物组织中存在3种TGF-β亚型(TGF-β1-3)。TGF-β分子由390个氨基酸残基的前体分子(pre-pro-TGF-β)C端裂解而来。此前体为25kDTGF-β,75kD的潜伏状态相关肽(LAP)通过二硫键连接到潜在TGF-β结合蛋白(LTBP)上[1]。pre-pro-TGF-βN 端的信号肽在分泌前被裂解掉。体内多种因素可导致裂解而活化 TGF-β[2]。转化生长因子-β1(TGF-β1)是TGF-β家族中重要的一员,是由两个结构相同或相近的分子量为12.5KD亚单位借二硫键连接而成的双体结构。
转化生长因子-β1(TGF-β1)的生物学效应的发挥依赖于细胞表面的受体。几乎所有的细胞表面都有TGF-β 受体(TβR),TβR 主要有三型:TβRⅠ 、TβRⅡ和TβRⅢ。TGF-β1对细胞外基质的合成和沉积作用主要由Ⅰ型受体介导;TGF-β1通过与细胞表面I型、Ⅱ型受体的结合,形成Ⅱ型受体-TGF-β1-I型受体三聚体复合物,磷酸化后的I型受体将信号放大传递给细胞内重要的信号分子Smad,从而产生相应生物学效应[3]。
3.2转化生长因子-β1合成部位及来源
正常肝脏TGF-β1转录见于门静脉周围细胞、导管周围细胞、肝小叶中央静脉周围细胞及肝包膜间质细胞。肝纤维化时上述部位的TGF-β1mRNA转录增加。Sylke等[4]分离出HSC和肝实质细胞(PC),发现显示TGF-β1和 LAP弥散分布在PC的胞浆,LTBP的免疫染色主要显示在浆膜。而TGF-β1、LAP和LTBP在核周更明显,提示其合成和分泌通过内质网和高尔基复合体完成的。正常情况下,其表达量较少。
国内外的研究证实,TGF-β1与纤维化关系极为密切,但对肝纤维化的不同阶段其来源看法不同,大多数学者认为:在肝纤维化早期TGF-β1表达增加主要来源于肝间质细胞,如肝星状细胞、肌成纤维细胞等,肝实质细胞不表达TGF-β1,但随着肝纤维化的发展,肝实质细胞、非实质细胞如星状细胞(HSC)、Kupffer细胞、窦周细胞是肝内TGF-β1的主要产生细胞[5]。本实验采用RT-PCR方法测定TGF-β1mRNA量,从实验结果来看,在正常对照组,TGF-β1 mRNA量为(0.24±0.02)较少,表明维持肝脏的正常组织结构需要TGF-β1的参与,才能保持一种动态平衡,这种平衡一旦被打破(如各种损伤因子对肝脏的损伤),TGF-β1mRNA表达量将逐渐增加,并进入恶性循环。模型第2周TGF-β1mRNA表达量为(0.27±0.02)至模型第8周组TGF-β1mRNA量为(0.50±0.06),TGF-β1mRNA量逐渐增加,且各组间差异具有显著性(P<0.01);提示CCl4可在转录水平上促进TGF-β1的生成,且随着CCl4注射次数的增多致肝脏损害程度的加重,TGF-β1mRNA量增加更明显。提示TGF-β1mRNA表达量与肝脏病变发展阶段的一致性。与目前公认的结果相同。在此动态观察TGF-β1mRNA表达过程中,同时测定的ICG15分钟潴留率也随着肝脏损害程度的加重而增加,并与TGF-β1mRNA表达量作相关分析,结果两者呈正相关(相关系数分别为г=0.9099,p值<0.05),提示ICG15分钟潴留率与肝脏纤维化形成过程中转化生长因子-TGF-β1mRNA表达变化的一致性,能够反映肝纤维化早期肝脏的微观变化。从参与肝纤维化的细胞因子-TGF-β1mRNA表达的角度验证ICG15分钟潴留率能够诊断早期肝纤维化。
[1]Michael B,Sporn,Amita C,et al.Transforming growth factor-β:Recent progress and new challenges[J].J cell biol,2006,119(4)∶1017.
[2]Mayumi ABE,Nobuyuki ODA,Yasufumi STAO.Cell associated activation of latent transforming growth factor-β by calpain[J].Jcellphy.2009,8,174(2):186.
[3]De Caestecker M.The transforming growth factor-beta superfamily of receptors.Cytokine Growth Factor Rev,2004,15:1-11.
[4]Sylke,Roth-Eichhorn,Kuhl K,et al.Subcellular localization of(latent)transforming growth factor β and the latent TGF-β and the latent TGF-β binding protein in rat hepatocytes and hepatic stellate cells[J].Hepatology,2009,28(6):1588.
[5]Peter J,Lewindon,Tamara N,et al.The role of hepatic stellate cells and transforming growth factor-β1 in cystic fibrosis liver disease[J].AmJ Pathol,2002,160(5):1705.
