人参二醇组皂苷对心室重构大鼠的抗氧化作用及神经内分泌因子的影响
2010-06-13曲绍春于晓风石耀辉睢大
韩 冬,曲绍春,于晓风,石耀辉,睢大*
(1.吉林大学药学院药理教研室,吉林长春130021;2.长春中医药大学药学院中药药理教研室)
急性心肌梗死(Acute Myocardial Infarction,AMI)后心室重构是指AMI所产生的左心室形态、大小和功能状态的改变,是临床上常见的慢性进行性发展的病理生理过程。许多学者观察到心室重构不仅使心肌梗死患者左心室功能严重受损,并发症增多,而且死亡率亦明显增多[1]。因此,心室重构问题已成为当前心血管领域中重要的研究内容之一。
人参二醇组皂苷(Panaxadiol Saponins,PDS)系从五加科人参属植物人参茎叶中提取纯化所得,是以20(S)-Protoparaxadiol为甙元的人参皂苷,主要包含人参Rb1,Rb2,Rc,Rd等皂苷单体。有研究表明,人参二醇组皂苷具有抗休克、抗心肌梗死、抗缺血再灌注性损伤、降低血糖及改善血脂代谢紊乱等多种生物学功能[2-4],而其是否具有抗心室重构的作用尚未见报道。我们研究发现,人参二醇组皂苷能明显降低实验性心室重构大鼠心室脏器指数,改善心脏血流动力学,并明显减轻心室重构大鼠心肌组织病理损伤,提示其对大鼠实验性心室重构具有明显的防治作用(另文发表)。本实验进一步建立大鼠心肌梗死后心室重构模型,通过测定自由基、抗氧化酶及神经内分泌因子等来探讨PDS防治心室重构的作用机制,为其开发利用提供科学依据。
1 材料与方法
1.1 动物
Wistar大鼠,雌雄各半,体重220-250 g,合格证号SCXK-(吉)2007-0003,由吉林大学实验动物中心提供。
1.2 药品与试剂
人参二醇组皂苷粉末,吉林大学基础医学院天然药物化学研究室提供;卡托普利(Captopril)片(批号:20090506),中美上海施贵宝制药有限公司产品;血管紧张素Ⅱ(AngⅡ)放免分析药盒(批号:20091225)、内皮素(ET)放免分析药盒(批号:20091225),心钠素(ANP)放免分析药盒(批号:20091225)及醛固酮(ALD)放免分析药盒(批号:20091225),由北京普尔伟业生物科技有限公司提供;丙二醛(MDA)测试盒(批号:20091210),超氧化物歧化酶(SOD)测试盒(批号:20091210)及谷胱甘肽过氧化物酶(GSH-Px)测试盒(批号:20091210),由南京建成生物工程研究所提供。
1.3 心室重构模型建立与动物分组
心室重构模型采用大鼠冠脉结扎法[5],在乙醚麻醉下仰位固定于手术台,自左侧3-4肋间开胸,暴露心脏,于肺动脉圆锥及左心房间找出冠脉左前降支,距离根部2-3 mm处以0号丝线立即结扎,将心脏送回胸腔,并挤出胸腔内血液和气体,迅速关闭胸腔,开胸时间不超过30 s。术后24 h,存活大鼠行心电图检查,选择ST段抬高的大鼠用于实验,并按ST段抬高程度随机分组如下:①假手术组(Sham)仅置缝线不结扎冠脉,腹腔注射生理盐水2 ml/kg/d;②重构模型组(Model),腹腔注射生理盐水2 ml/kg/d;③重构模型+人参二醇组:腹腔注射人参二醇组总皂苷50 mg/kg/d;④重构模型+阳性药物组:灌胃卡托普利100 mg/kg/d。
1.4 实验方法与观察指标
各组动物(n=10只)均于术后24 h开始给药,每日1次,连续4周。为防止大鼠术后感染,每日肌肉注射青霉素40万单位/只,连续1周。杀鼠前一晚,动物禁食不禁水,杀鼠当日上午,每组大鼠以10%水合氯醛30 mg/kg腹腔注射麻醉,腹主动脉采血1 ml,用0.34M8-羟基喹啉、0.32M 二巯基丙醇及0.30M EDTA-Na2抗凝,3 500 r/min离心5 min分离血浆,放免法测定AngⅡ的含量;腹主动脉采血2 ml,用 4×104KIU/ml抑肽酶与 7.5%EDTA-Na2抗凝,3 500 r/min离心5 min分离血浆,放免法测定ET及ANP的含量;腹主动脉采血1 ml,用10 μ l肝素抗凝,3 500 r/min离心5 min分离血浆,放免法测定ALD的含量;腹主动脉插管取血3 ml,静置分离血清,比色法测血清MAD含量、SOD及GSH-Px活性;取200 mg左心室,用冰盐水制成10%的心肌组织匀浆,放免法测定AngⅡ的含量。
1.5 统计学分析
2 结果
2.1 PDS对实验性心室重构大鼠血浆AngⅡ、ET含量及心肌AngⅡ含量的影响
与假手术组比较,重构模型组大鼠血浆AngⅡ、ET含量及心肌AngⅡ含量均明显增加(P<0.01),表明心室重构时大鼠血浆AngⅡ、ET含量及心肌AngⅡ水平异常。PDS能显著降低大鼠血浆AngⅡ、ET含量及心肌AngⅡ含量(P<0.01),其作用与阳性药卡托普利相当,见表1。
表1 PDS对实验性心室重构大鼠大鼠血浆AngⅡ、ET含量及心肌AngⅡ含量的影响(s,n=10)

表1 PDS对实验性心室重构大鼠大鼠血浆AngⅡ、ET含量及心肌AngⅡ含量的影响(s,n=10)
与假手术组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01
组别剂量(p g/ml)Plasma ET(pg/ml)Plasma AngⅡ(U/ml)Myocardial AngⅡ(ng/g)假手术组 - 170.9±30.1 331.5±52.4 4.16±0.61模型组 - 280.9±36.0△△ 445.7±59.3△△ 10.34±1.65△△PDS 50 206.2±31.2** 340.9±42.5** 6.5±0.85**卡托普利 100 208.9±40.0** 379.4±40.2* 7.45±1.14**
2.2 PDS对实验性心室重构大鼠血浆ALD、ANP含量的影响
与假手术组比较,重构模型组大鼠血浆ALD及ANP含量均明显增加(P<0.01)。表明心室重构时大鼠血浆ALD及ANP水平异常。PDS能显著降低大鼠血浆ALD及ANP含量(P<0.01),其作用与阳性药卡托普利相当,见表2。
表2 PDS对实验性心室重构大鼠大鼠血浆浆ALD及ANP含量的影响(s,n=10)
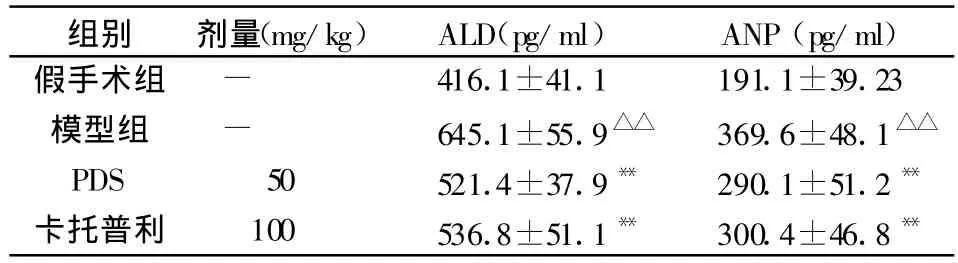
表2 PDS对实验性心室重构大鼠大鼠血浆浆ALD及ANP含量的影响(s,n=10)
与假手术组比较,△△P<0.01;与模型组比较,**P<0.01
组别 剂量(mg/kg)ALD(pg/ml)ANP(pg/ml)假手术组 - 416.1±41.1 191.1±39.23模型组 - 645.1±55.9△△ 369.6±48.1△△PDS 50 521.4±37.9** 290.1±51.2**卡托普利 100 536.8±51.1** 300.4±46.8**
2.3 PDS对实验性心室重构大鼠血清MDA含量及SOD、GSH-Px活性的影响
与假手术组相比,重构模型组血清MDA含量明显增加(P<0.01),而SOD、GSH-Px活性明显降低(P<0.01),表明心室重构时可产生氧自由基引起心肌损伤。PDS可明显降低血清MDA含量(P<0.01),提高血清SOD、GSH-Px活性(P <0.05),其作用与阳性药卡托普利相当,表明其对大鼠心室重构引发的自由基氧化损伤有明显对抗作用,见表3。
表3 PDS对实验性心室重构大鼠血清MDA含量、SOD及GSH-Px活性的影响(s,n=10)

表3 PDS对实验性心室重构大鼠血清MDA含量、SOD及GSH-Px活性的影响(s,n=10)
与假手术组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01
组别剂量(mg/kg)MDA(nmol/ml)SOD(U/ml)GSH-Px(U/0.1 ml)假手术组 - 4.40±0.76 234.2±14.3 2097.9±162.6模型组 - 6.33±0.95△△ 197.8±15.8△△1756.6±172.2△△PDS 50 4.58±0.81** 212.7±13.9* 1894.0±115.6*卡托普利 100 4.76±0.95** 217.0±15.9* 1922.0±164.1*
3 讨论
有文献报道,心室重构发生时神经体液的激活是加速其进展的一个重要因素[6,7]。早期神经内分泌的激活可增加心肌收缩力而使心排量增加,维持动脉血压和保证重要脏器的血流,对循环起短时的支持效应,且此激活早于症状的出现,但过度激活转而对心血管系统有害,不仅使外周血管阻力增加,水、钠潴留,加重心脏的前后负荷进一步加重心室重构,还可直接损害心肌,加剧心衰的恶化[8]。
本研究显示,心肌梗死后心室重构组大鼠血浆AngⅡ及ALD含量,心肌AngⅡ含量明显升高,表明肾素-血管紧张素-醛固酮系统活性增强。AngⅡ作为肾素-血管紧张素-醛固酮系统的效应分子,可直接促进心肌细胞RNA和蛋白质的合成,促进纤维细胞增殖,引起心室重构[9]。而过量的ALD激活相应受体后进入细胞核与特异性的DNA序列结合,调节一系列ALD反应基因的转录,调控某些蛋白质的合成,发挥基因组效应,刺激细胞生长及胶原重塑,也会导致心肌肥厚和心肌纤维化[10]。另外,本实验模型组大鼠血浆ET及ANP含量也明显升高,这与文献报道的结果相一致[11,12]。PDS可显著降低血浆ET、ANP、ALD 含量,血浆及心肌AngⅡ含量,提示PDS抑制肾素血管紧张素醛固酮系统从而降低缩血管物质水平,可能是其发挥抗心室重构作用的机制之一。
当心室重构时,由于心室壁张力增高,心肌相对缺血缺氧,大量的中间代谢产物堆积,使自由基(如MDA)产生增多,同时体内抗氧化酶系(SOD及GSHPx)活性受到抑制[13]。本研究显示,大鼠心肌梗死4周后,血清MDA含量增多,而 SOD、GSH-Px活性明显降低,提示机体氧化/抗氧化的酶系统平衡已经被打破,体内氧自由清除能力不足,导致心肌细胞损伤,成纤维细胞增生,心肌纤维化,心室重构形成。PDS连续4周腹腔给药后,大鼠体内氧化与抗氧化的平衡状态得到显著改善,提示PDS延缓心室重构发展的作用可能与其增强心肌的抗氧化能力有关。
[1]Pfeffer MA,Braunwald E.Ventricular remodeling after myocardial infarction.Experimental observations and clinical implications[J].Circulation,1990,81(4):1161.
[2]刘 洁,刘 芬,王秋静,等.人参二醇组皂苷对心肌梗死犬血清一氧化氮、一氧化氮合酶水平的影响[J].中国实验方剂学杂志,2008,14(4):64.
[3]陈立波,崔东哲,刘玉梅,等.人参二醇组皂苷对家兔缺血再灌注损伤心肌线粒体的影响[J].中国中医药科技,2003,10(3):152.
[4]胡翠华,徐华丽,于晓风,等.人参二醇组皂苷对实验性2型糖尿病大鼠血糖及血脂代谢的影响[J].吉林大学学报:医学版,2006,32(6):1004.
[5]睢大员,于晓风,曲绍春,等.西洋参叶20s-原人参二醇组皂苷对大鼠实验性心 室重构的影响[J].中国药学杂志,2007,42(2):108.
[6]Jneid H,Moukarbel GV,Dawson B,et al.Combining neuroendocrine inhibitors in heart failure:reflections on safety and efficacy[J].Am JMed,2007,120(14):1090.
[7]Struthers AD.Angiotensin blockade or aldosterone blockade as the third neuroendocrine-blocking drug in mild but symptomatic heart failure patients[J].Heart,2006,92(12):1728.
[8]Unger T,Li J.The role of the renin-angiotensin-aldosterone system in heart failure[J].J Renin Angiotensin Aldosterone Syst,2004,5 Suppl 1:S7.
[9]Morgan HE,Baker KM.Cardiac hypertrophy.Mechanical,neural,and endocrine dependence[J].Circulation,1991,83(1):13.
[10]刘先哲.醛固酮致心肌胶原重构的信息传导机制[J].中华老年心脑血管病杂志,2002,4(1):56.
[11]Yanagisawa M,Kurihara H,Kimura S,et al.A novel potent vasoconstrictor peptide produced by vascular endothelial cells[J].Nature,1988,332(6163):411.
[12]蔡 新,吴美玲,李 菁,等.机械牵张对大鼠心室肌蛋白激酶B磷酸化及心钠素分泌的影响[J].微循环学杂志,2007,17(4):17.
[13]Shen XC,Qiau ZY.Effects of crocetin of antioxidant enzymatic activities in cardiac hypertrophy induced by norepinephrine in rats[J].Pharmazie,2006,61(4):348.
