没食子酸对大鼠缺血再灌注损伤后细胞凋亡的保护作用及机制研究
2010-06-13卜丽梅关凤英于艳华赵丽红
卜丽梅,关凤英,乔 萍,于艳华,赵丽红,石 卓*
(1.吉林大学第一医院干部病房,吉林长春130021;2.吉林大学白求恩医学院药理学系,吉林长春130021)
心肌缺血-再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)是指心肌经受较长时间缺血后得到血液灌注,此时并不能减轻缺血损伤,而是加重了损伤,甚至将可逆性损伤转为不可逆性损伤,MIRI过程中,细胞凋亡有着重要的病理意义[1-2]。一旦心肌细胞受损启动细胞凋亡程序,可导致心肌细胞数目减少和心功能的降低,加重MIRI。药物预处理对缺血再灌注损伤心肌的保护成为目前的研究热点之一[3]。我国具有悠久的中医中药历史,中草药资源丰富,开发前景广阔。没食子酸(gallic acid,GA),化学名3,4,5-三羟基苯甲酸,是可水解鞣质的组成部分,广泛存在于葡萄,茶叶等植物中,是自然界存在的一种多酚类化合物来源于蓼科植物掌叶大黄根茎、桃金娘科植物大叶桉干燥叶、山茱萸科植物山茱萸的果实、千屈菜科植物千屈菜的花、马桑科植物马桑叶、石榴科植物石榴果皮等。已有文献证实GA具有抗炎、抗突变、抗氧化等多种生物学活性,本实验旨在以抗细胞凋亡为切入点,探讨GA预处理对MIRI造成的细胞凋亡的影响及其可能存在的机制。
1 材料与方法
1.1动物、主要试剂及仪器Wistar大鼠,清洁级,体重200-250 g,由吉林大学基础医学院实验动物中心提供。没食子酸(gallic acid,GA)由预防医学院化学实验室提供,纯度大于95%。丹参注射液。LDH、CPK、AST测定试剂盒由南京建成生物工程研究所提供;GF-200半自动生化测定仪(山东高密彩虹仪器有限公司);
1.2动物模型制备大鼠冠脉结扎及再灌模型按文献方法稍加改进[4],在20%乌拉坦麻醉下,将大鼠仰位固定于手术台上,颈部正中分离气管行气管插管,开胸后接呼吸机。小动物呼吸机设定潮气量为09、呼吸频率为66-76次/min,吸呼比为1∶2,根据呼吸频率及深度调整呼吸参数。自左侧3-4肋间开胸,暴露心脏,于肺动脉圆锥及左心耳间找出冠脉左前降支,除假手术组仅穿线不结扎外,其余各组均以0号线立即结扎冠脉,打活结,将心脏送回胸腔。心电图显示S-T段抬高,并且T波与QRS波融合为结扎成功,各组动物在结扎40 min后,迅速打开结扎线进行再灌注,再灌注120 min。
1.3实验分组和给药实验分组:wistar大鼠32只,随机分为四组,每组8只。假手术组,只开胸穿线,不结扎LAD;缺血再灌注组(模型组),结扎LAD 40 min,再灌注120 min,于结扎前10 min舌下静脉注射0.9%氯化钠溶液;丹参组(DS),舌下静脉注射丹参注射液100 mg·kg-1,余同模型组;没食子酸组(GA),灌胃给没食子酸 20 mg·kg-1,余同模型组。
1.4大鼠血清心肌三酶活性测定肌酸磷酸激酶(CK)、乳酸脱氢酶(LDH)、谷草转氨酶(AST)含量的测定:实验结束后,腹主动脉取血,3 000 r/min离心10 min取血清。按试剂盒说明书比色法测定CK、LDH、AST含量。
1.5记录大鼠不同时间点心电图的变化心电图ST段的测量大鼠固定后,于四肢皮下插入针形电极连接上海光电医用电子仪器有限公司的ECG-6511型心电图机。连续心电监测,并依次描记结扎前、缺血5、40 min和再灌注 10 min、120 min 时 Ⅱ导联心电图(纸速50 mm/s,增益1 mV=10 mm)。标准Ⅱ导联心电图的变化。
1.6心肌梗死范围(MIS)的测定每组动物剖取心脏,用预冷的生理盐水漂洗,除去血液及脂肪组织,用滤纸拭干,称全心及心室湿重。将心室心肌横切6片,然后浸入N-BT磷酸缓冲液中,置37℃恒温水浴,待染色完全后取出,正常组织染色,缺血组织不染色。切下梗死心肌称重,用梗死心肌与全心湿重的百分比计算MIS。
1.7心肌细胞凋亡检测TUNEL染色按试剂盒提供的脱氧核苷酸末端转移酶介导的缺口末端标记法(terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling,TUNEL)原位检测凋亡细胞的DNA碎片。各组实验结束后,取心尖部位心肌常规脱水固定,石蜡包埋,切片,从各组取5张石蜡切片,二甲苯脱蜡,梯度乙醇脱水,PBS(pH7.2)冲洗(每次5 min,共 3 次,下同);蛋白酶K(20 μ g/ml)37℃消化 30 min,PBS冲洗;3%H2O2室温下处理5 min以阻断内源性过氧化物酶活性,PBS冲洗,含0.1%TritonX-100的0.1%枸橼酸溶液以去除细胞膜表面污物,(冰上4 min),PBS冲洗;加 50 μ l TUNEL反应混合液,包括脱氧核苷酸转移酶液,37℃孵育60 min,PBS冲洗,加POD液37℃孵育30 min,PBS冲洗,DAB显色。在400×显微镜下,于缺血区边缘随机采集5个非重叠视野,检测100个心肌细胞中TUNEL阳性细胞数,取其平均值。凋亡阳性率以单位面积内凋亡细胞数占细胞总数百分比表示。
1.8免疫组化法测定大鼠心肌Bax、Bcl-2的表达取心尖缺血梗死区横切2 mm厚心肌,以PBS配成10%甲醛溶液固定,以免疫组化SP法观察心肌细胞iNOS表达。操作步骤如下:(1)石蜡切片常规脱蜡至水;(2)3%H2O2常温下孵育10 min以灭活内源性过氧化物酶活性,蒸馏水冲洗,PBS浸洗5 min;(3)加山羊血清封闭液,室温15 min清除背景非特异性染色;(4)滴加兔抗鼠Bax、Bcl-2抗体37℃孵育1h;(5)滴加生物素标记羊抗兔IgG,37℃孵育30 min;(6)加辣根酶标记链霉素卵白素,37℃孵育30 min;(7)上述(3)(4)(5)后均以 PBS洗3 min×3次;(8)DAB显色,自来水充分冲洗,苏木素复染,封片。阴性对照以PBS代替一抗进行孵育,其他步骤同上。阳性反应:细胞浆呈棕褐色为Bax、Bcl-2蛋白阳性表达。Image-pro软件分析计算各组阳性表达细胞的光密度值。
2 结果
2.1GA对大鼠血清CK、LDH及AST的影响大鼠缺血40 min,再灌120 min后,取血测定血清CPK、LDH及AST活性。结果与假手术比较,再灌注模型组血清CPK、LDH及AST活性明显升高(P<0.01),与再灌注模型组相比,GA能降低血清CK、LDH及AST三酶的活性(P<0.05或P<0.01),见表1。
2.2GA对缺血-再灌注大鼠心电图的影响缺血-再灌注使实验各组部分大鼠心脏出现室性心律失常,所有大鼠均有ST段抬高,其中假手术组变化不明显,模型组及DS组、GA组与假手术组比较差异有统计学意义(P<0.01),表明结扎及再灌均引起心肌缺血损伤;模型组与DS组、GA组比较差异有统计学意义(P<0.05),表明DS、GA对心肌缺血有一定的缓解作用,见表2。
表1 GA对大鼠血清CK、LDH及AST的影响(n=8,s)
与假手术组比较,#P<0.01;与模型组比较,*P<0.05
分组 CK(U/L)LDH(U/L)AST(U/L)假手术组 328.12±159.4 330.3±64.2 104.4±40.6模型组 1230.4±213.5# 1193.0±223.1# 436.0±106.4#DS 886.3±97.8#* 894.25±280.3#*294.7±67.5#*GA 880.9±161.0#* 797.7±320.9#*304.8±72.4#*
表2 GA对心肌缺血再灌注大鼠心电图 ST段的影响(n=8,s)

表2 GA对心肌缺血再灌注大鼠心电图 ST段的影响(n=8,s)
与假手术组比较aP<0.01;与模型组比较bP<0.05
分组 结扎前 结扎后5 min 结扎后40 min 再灌后10 min 再灌后120 min假手术组 1.0±0.1 1.2±0.2 1.0±0.3 1.1±0.3 1.0±0.2模型组 1.1±0.2 6.3±1.1a 7.5±0.7a 7.9±1.0a 8.2±0.4a DS 1.1±0.1 5.3±0.9a 6.7±0.3ab 7.3±0.8a 7.4±0.6ab QKL 1.0±0.15 5.2±0.7ab 6.6±0.4ab 6.8±0.5ab 6.6±0.3ab
2.3GA对心肌损伤范围及凋亡率的影响大鼠缺血40 min再灌120 min,取心肌染色,以损伤心肌占全心湿重的百分比来计算MIS。与假手术组比较,再灌注模型组MIS明显的大面积损伤(P<0.01),表明大鼠心肌缺血再灌注模型建立成功。与再灌注模型组相比,DS组及GA组均能明显缩小MIS(P<0.05或 P<0.01),见表3。
TUNEL染色结果表明凋亡阳性细胞呈深棕色,细胞核萎缩,染色质聚边,胞浆不着色。SH组存在少量凋亡细胞,I/R组可见大量凋亡细胞,与SH组比较差异具有显著性(P<0.001);GA组和DS组凋亡细胞百分率低于模型组,差异具有显著性(P<0.05)。见图1和表3。

Fig.1 GA对实验性缺血再灌注损伤大鼠心肌TUNEL染色阳性细胞数的影响(400×)
表3 GA对心肌损伤面积(%)和细胞凋亡率的影响(s,n=6)

表3 GA对心肌损伤面积(%)和细胞凋亡率的影响(s,n=6)
###P<0.001,compared with SH group;*P<0.05,compared with I/R group;⊿P<0.05 compared with AS(5 g·kg-1)group
分组 动物数(只)损伤面积(%)凋亡率(%)假手术组 8 0 2.0±0.2模型组 8 42.30±2.5# 17.3±1.8###DS 8 32.16±3.8#* 11.9±2.2*GA 8 33.05±5.2#* 16.7±2.5⊿
2.4GA对Bax、Bcl-2的影响Bax、Bcl-2在胞浆中成片表达,呈棕黄色。在假手术组Bax、Bcl-2均有表达,但量较小,Bax与Bcl-2相近。与假手术组比较,缺血再灌模型组Bax、Bcl-2表达均明显增高。与模型组比较,GA组Bax蛋白含量显著减少,Bcl-2蛋白含量显著增多。GA具有抗大鼠心肌缺血再灌注损伤作用,其机制可能通过调节Bcl-2/Bax比值介导心肌缺血再灌注细胞凋亡而实现。(图2、3)
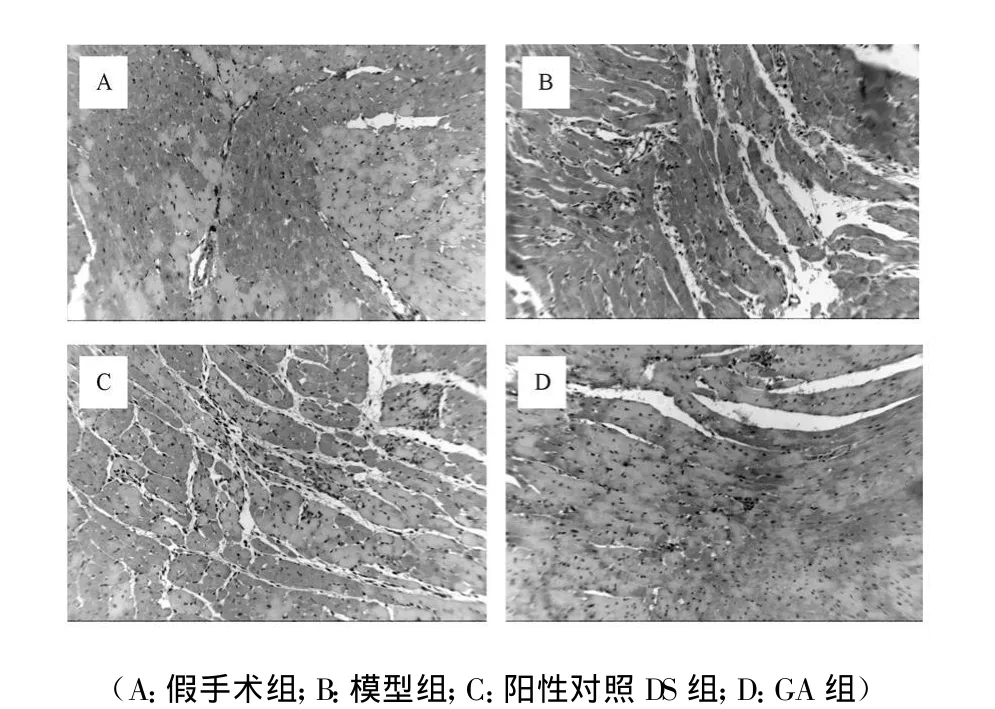
图2 GA对促凋亡蛋白Bax表达的影响
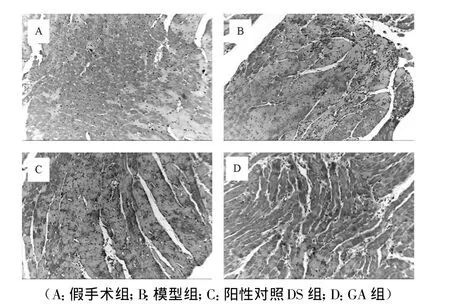
图3 GA对抑凋亡蛋白Bcl-2表达的影响
3 讨论
MIRI过程中细胞凋亡有着重要的病理意义,病理学认为,细胞凋亡机制与心肌短暂缺血后再灌注损伤密切相关[5]。姚震等[6]研究表明,不同时间的心肌缺血再灌注损伤均可导致心肌细胞凋亡,以缺血30-60 min后再灌注时明显,说明心肌细胞凋亡的发生率与此前心肌缺血时间长短有关。再灌注损伤引起的细胞凋亡多分布于短暂缺血后血管再通的相关部位和梗死灶的收缩带区域。
本研究观察到,与假手术组比较,模型组心肌三酶的漏出量增加,心肌梗死面积和细胞凋亡率提高。预先给予GA可明显减轻心肌三酶的漏出量、心肌梗死面积明显缩小,细胞凋亡率显著降低,说明GA对实验大鼠心肌缺血-灌注损伤后细胞凋亡具有明显的保护作用。
表4 GA对Bax、Bcl-2蛋白表达的影响(n=8,s)

表4 GA对Bax、Bcl-2蛋白表达的影响(n=8,s)
而与假手术组比较#P<0.01,与模型组比较*P<0.01
分组 剂量 Bcl-2 Bax bcl-2/bax假手术组 —— 38.24±4.38 38.24±4.38 1.03±0.2模型组 —— 96.23±12.10#* 96.23±12.10#* 0.36±0.041 DS 100mg·kg-1 75.38±10.28#* 75.38±10.28#* 1.26±0.342 GA 20mg·kg-1 74.41±9.56#* 74.41±9.56#* 3.51±0.372
细胞凋亡与某些凋亡相关基因表达及调控有关,其中,细胞凋亡由细胞内凋亡相关基因直接控制,bax基因与bcl-2基因具有高度的同源序列,bcl-2和bax是两个重要的相关基因,前者抑制细胞凋亡,而后者促进细胞凋亡[7]。Bax蛋白与Bcl-2蛋白可相互结合形成结合体,过度表达Bax蛋白可促进细胞凋亡并抑制 Bcl-2的抗凋亡作用。因此,Bax和Bcl-2表达的比例决定细胞是生存还是凋亡[8-9]。GA组大鼠心肌细胞Bcl-2表达显著增高,而Bax蛋白显著降低,Bax/Bcl-2显著下降,细胞阳性染色面积百分率显著降低,提示GA可能通过调控Bax/Bcl-2的比值抑制I/R心肌细胞发生凋亡,减轻I/R损伤。
Bax促进细胞凋亡的可能机制除bax本身具有促进细胞凋亡作用外,还可通过①bax与bcl-2形成异源二聚体,抑制bcl-2的作用,并可抑制bcl-2家族中bcl-xL等基因的抑制凋亡作用;②bax/bax形成同源二聚体,抑制线粒体细胞色素C的释放,促进细胞凋亡[10]。本实验结果显示,缺血再灌注使bcl-2和bax的表达明显增多,但以bax的增多更为显著,使bcl-2/bax值显著降低,细胞凋亡明显。而给予GA治疗组bcl-2表达增加,bax表达下降,bcl-2/bax值升高,心肌细胞凋亡数量明显减少。由此推测,GA抑制心肌细胞凋亡可能是其缩小梗死面积、保护心肌的机制之一,而抑制心肌缺血再灌注引起细胞凋亡的机制可能与下调bax和上调bcl-2的蛋白表达,提高bcl-2/bax比值有一定关系,直接证据有待进一步验证。
[1]ElsasserA,VogtAM,Nef H,et al.Humanhibernatingmyocardium is jeopardized by apoptotic and autophagic cell death[J].J Am Coll Cardiol,2004,43(12):2191.
[2]Katori M,Buelow R,Key B,et al.Heine oxygenase-1 overexpression protects rat hearts from cold ischemia/reperfusion injury via an anti apoptotion pathway[J].Transplantation,2002,72(2):287.
[3]N.P.Riksen,P.Smits,G.A.Rongen.Ischaemic preconditioning:from molecular characterisation to clinical application-part II.Neth J Med.2004;62(11):409.
[4]汤 东,王 英,朱永泽.心肌损伤动物模型的建立及应用.解剖与临床.2004;9(2):126-127.
[5]马桂兰.细胞凋亡与冠心病[J].医学综述,2000,6(11):491.
[6]姚震,焦解歌,冯建章.心肌缺血再灌注损伤与细胞凋亡关系的实验研究[J].海南医学院学报,2000,6(3):129.
[7]Melo G,Agranal R,Zhang L,et al.Gene therapy strategy for longterm myocardialprotection using adeno-associated virus-mediated delivery ofhemeoxygenase gene[J].Circulation,2002,105(2):602.
[8]Xie Z,Koyama T,Suzuki J,et al.Coronary reperfusion following ischemia:different expression of bcl-2 and bax proteins,and cardiomyocyte apoptosis[J].JpnHeart J,2001,42(6):759.
[9]McClintock DS,SantoreMT,LeeVY,et al.Bcl-2 familymembers and functional electron transport chain regulate oxygen deprivation-induced cell death[J].MolCellBio,l 2002,22(1):94.
[10]BorutaiteV,BudriunaiteA,MorkunieneR,et al.Release of mitochondrial cytochrome C and activation of cytosolic caspases induced bymyocardial ischemia[J].Biochimica Biophysica Acta,2001,1537(11):101.
