多菌灵/戊唑醇复配对小麦赤霉病菌抗药性菌株的活性增效作用
2010-06-12毕秋艳马志强张小风王文桥韩秀英
毕秋艳, 马志强, 张小风, 王文桥, 韩秀英, 陈 丹
(1.河北省农林科学院植物保护研究所,省农业有害生物综合防治工程技术研究中心,保定 071000;2.河北农业大学植物保护学院农药系,保定 071001)
由禾谷镰孢菌(Fusarium graminearum Schwabe)引起的小麦赤霉病,一直是我国江淮流域、西南冬麦区及东北春麦区最重要的小麦病害之一。抽穗扬花期喷施多菌灵等苯并咪唑类杀菌剂是我国自20世纪70年代中期以来防治小麦赤霉病的关键措施之一。自1992年周明国等[1]在浙江海宁市小麦病穗上检测到世界首例禾谷镰孢菌抗药性菌株以来,在浙、苏、沪、鄂等地进行了连年抗药性监测,发现抗药性病原菌群体比例迅速上升,在浙江等地已成为致病优势小种;同时,抗药性病原菌分布范围不断扩大,已从最初的浙江蔓延到上海和江苏大部分地区。如何延缓和解决抗药性问题,成为人们关注的焦点。
随着农业的全面发展,植物病害的危害性与日俱增。由于一些化学药剂复配后能产生增效作用,因此杀菌剂的复配效益日益得到重视。它不但可以减少病害造成的产量损失,增加农业收入,更重要的是能使病害得到有效控制,同时还能减少成本投入及节省劳力。因此,科学复配杀菌剂具有现实意义,一可以减少病原菌产生抗药性的风险[2],二可以达到比杀菌剂单剂更好的防治效果,三可以大大降低开发新型杀菌剂的难度。刘学敏[3]等提出增效作用机制可能是各个特殊效果的综合,其中降低病原菌的侵入、在目标位点增加药剂组分的浓度可能是主要原因,但杀菌剂复配增效机理至今尚未解释清楚。复配杀菌剂作用机理应着眼于内在本质的研究[4-5]。本课题对多菌灵、戊唑醇复配增效作用从不同方面进行初探,为解决镰刀菌对多菌灵抗药性问题以及更加合理地复配杀菌剂提供依据。
1 材料与方法
1.1 试验时间、地点
室内试验于2009年在河北省农林科学院植物保护研究所中心试验室进行。
1.2 试验材料
采用禾谷镰孢菌(F.graminearum)多菌灵抗药菌株分离得到的单孢进行试验。本实验室采自南京的抗药性菌株Nj-1-1在3.2 μ g/mL的多菌灵处理下仍可以生长,采自河北的敏感菌株 Hb-5-2在0.052 μ g/mL的多菌灵处理下停止生长。
1.3 试验方法
1.3.1 试验设计
分别采用菌丝生长速率法、孢子萌发速率法、测定细胞膜透性、测定菌体内麦角甾醇含量的方法进行试验。
1.3.2 药品规格
98%多菌灵(carbendazim)原药(沈阳化工研究院提供)用0.1 mol/mL盐酸溶解后,用重蒸水配成6.4 μ g/mL母液;95.34%戊唑醇(tebuconazole)原药(香港九龙农药厂提供)用适量丙酮溶解后,用重蒸水配成6.4 μ g/mL母液。
1.3.3 增效作用测定
采用菌丝生长速率法[6]。分别将多菌灵和戊唑醇母液用无菌水稀释成浓度为0、0.10、0.20、0.40、0.80 、1.60、3.20、6.40 μ g/mL 的药液,按多菌灵与戊唑醇体积比 1∶1、1∶2、1∶3、1∶4 、3∶4、4∶3、4∶1 、3∶1、2∶1的比例取相同浓度的两种药液混合均匀。将配好的药液与培养基按体积比1:9的比例进行混合,制成PDA平板,接菌,用于测定药剂对抗性菌株菌丝生长的抑制作用。每次处理重复4次,试验重复2次。置于25℃培养箱中培养3 d(均设置空白、等浓度盐酸及丙酮对照)。根据各浓度处理下药剂对菌丝生长的抑制率,求出多菌灵、戊唑醇以及多菌灵/戊唑醇复配组合在PDA培养基上抑制菌丝生长的有效中浓度EC50,计算复配组合的增效强度SR,筛选出最佳组合用于以下试验。
1.3.4 多菌灵/戊唑醇对小麦赤霉病菌孢子萌发速率的影响
将供试小麦赤霉病菌不同菌株分别接于PDA平板上,25℃下黑暗培养7 d,制成d=5 mm菌饼,分别接入羧甲基纤维素钾培养液中,于25℃恒温培养箱中振荡(230 r/min)培养10 d后,过滤将孢子与菌丝分开[7]。然后将PDA及人工合成培养基稀释10倍加1%琼脂固定,在此基础上分生孢子萌发率可达90%以上。利用WHO推荐的区分剂量法[8],将多菌灵、戊唑醇单剂配置成浓度均为1.6 μ g/mL,并按此浓度配置成1.3.3得到的多菌灵/戊唑醇最佳复配组合的溶液。培养基融化时将药液与培养基1∶9混合,用玻璃棒涂于载玻片上制成毒膜,然后用接种器分别接种上面培养的不同抗性菌株的分生孢子,并检查孢子密度,至100倍镜下每视野约20个孢子时止。将此载玻片平架于塑料盒中,盒底部注水 ,盖上盖后于 25 ℃左右培养 ,2、4、6、8、10 、12 h 后分别观察敏感菌株与抗性菌株的孢子萌发情况。试验重复4次。
1.3.5 多菌灵/戊唑醇对抗性菌株细胞膜透性影响
利用WHO推荐的区分剂量法[8],用重蒸水分别将多菌灵和戊唑醇母液稀释成1.6 μ g/mL,再将两者以相同浓度配置成最佳复配组合溶液60 mL,分别于100 mL三角瓶中测定各溶液的电导率,重复4次。
将1.3.4分离得到的新鲜菌丝用重蒸水冲洗,真空抽滤后称取 1.0 g(未经烘干的菌丝)放入100 mL三角瓶中。分别用PS将多菌灵和戊唑醇母液稀释成终浓度为1.6 μ g/mL的浓液,以及两者以相同浓度配置成4∶3的复配溶液,加入三角瓶中,使得100 mL三角瓶中溶液体积分别为60 mL。于25℃的恒温条件下保持振荡(230 r/min),分别测定0(即 刚放 入菌丝)、5 、10 、15 、30 、60 、90 、120、180、240、300、360、420、480、540 min 及死处理(煮沸30 min)时的电导率[9]。每浓度重复4次,以重蒸水为对照。按(1)式计算相对渗率,再根据相对渗率比较细胞膜的透性。
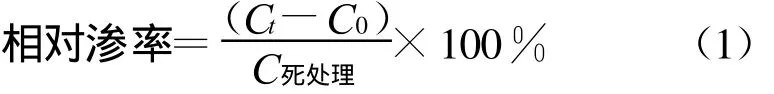
Ct:某一时刻的电导率;C0:最初(0 min)时的电导率;C死处理:死处理后的电导率。
1.3.6 多菌灵/戊唑醇对抗药菌株菌丝体麦角甾醇合成的影响[10]
将装有50 mL羧甲基纤维素培养液的三角瓶在高温下湿热灭菌(121℃,30 min),在无菌条件下配置0.0~1.6 μ g/mL多菌灵、戊唑醇及 V(多菌灵)∶V(戊唑醇)=4∶3复配组合的羧甲基纤维素培养液,接种定量的小麦赤霉病菌菌丝块(菌丝块已在25℃下黑暗培养7 d),振荡培养(230 r/min,25℃,7 d)。取出培养的菌丝体,脱水后保存备用。
取经多菌灵、戊唑醇及两者4∶3复配组合不同处理后的菌丝体0.5 g,加甲醇和氯仿混合液(2∶1)匀浆,定容至10 mL,25℃静置0.5 h,分别加水、氯仿和含有0.5 mol/L的磷酸缓冲液(pH7.4)各10 mL,分层,使氯仿相在水浴上蒸干。加入含有1.4 mol/L KOH的甲醇和乙醇(4∶1)混合液20 mL,60℃皂化1 h,然后再加水、石油醚(沸程60~90 ℃)各 10 mL,分层后取石油醚蒸干,用乙醇洗下并定容至10 mL,在紫外分光光度计上测得各处理的A280nm值,据此求得菌丝麦角甾醇含量的相对变化。
1.3.7 数据处理
试验数据均用DPS软件进行统计分析,计算回归方程、EC50及相关系数。根据Wadelly公式[8-9]推算增效系数SR。
2 结果与分析
2.1 多菌灵、戊唑醇以及两者复配组合毒力增效结果
多菌灵与戊唑醇4∶3复配组合对多菌灵抗性菌株增效系数SR>1.5,具有明显增效作用,对抗性菌株的增效比为1.833 0。(盐酸对照、丙酮对照与空白对照生长基本一致,下面试验结果不受溶剂影响,不再重复说明对照)。

表1 多菌灵、戊唑醇及两者复配组合对小麦赤霉病菌抗性菌株菌丝生长的抑制作用
2.2 多菌灵/戊唑醇对小麦赤霉病菌孢子萌发速率的影响
药剂处理后,抗性菌株Nj-1-1的孢子在12 h后均可萌发,且与对照的萌发率无明显差异。V(多菌灵)∶V(戊唑醇)=4∶3处理后孢子萌发速率较对照、多菌灵、戊唑醇有所减慢,但萌发开始时间早于敏感菌株Hb-5-2,几乎与对照和多菌灵、戊唑醇相同,8 h后萌发速率与戊唑醇几乎相同。说明4∶3复配组合可以减慢孢子的萌发速率,但不能完全抑制孢子萌发,其对孢子萌发的抑制率明显高于单剂。

图1 多菌灵、戊唑醇单用及混用对小麦赤霉病菌抗性菌株孢子萌发的影响
2.3 多菌灵/戊唑醇对抗性菌株细胞膜透性的影响
测定结果(表 2)显示,0.0、1.6 μ g/mL 等不同浓度的不同药剂溶液的电导率没有显著差异。后面试验中,加入不同抗性的菌丝体后,不同药剂的不同浓度溶液之间的电导率差异及其相对渗率的变化,可归因于不同菌株之间细胞膜透性的差异及其菌株与药剂相互作用所引起的细胞膜透性的改变。

表2 不同药剂不同浓度的电导率比较(n=4)1)
单剂、混剂和对照变化规律相同说明药剂进入细胞内后均能使细胞膜透性发生改变,但药剂作用特点不同,对细胞膜透性的影响程度不同。
30 min内渗透率上升表明在药剂的作用下真菌细胞内含物外渗,将影响细胞的正常生长;200 min渗透率下降,可能是由于溶液离子与内含物发生一定反应后使内含物停止外渗,外界反应产物对细胞膜产生一定压力破坏造成。
多菌灵/戊唑醇(4∶3)处理抗性菌株后,在240 min处相对渗率上升,说明该复配组合使细胞内含物在此时间过后一直外渗,加速了细胞萎缩死亡速率,可能与其增效作用有关。

图2 多菌灵、戊唑醇单用及混用在1.6 μ g/mL下对抗性菌株相对渗率的影响
2.4 多菌灵/戊唑醇对小麦赤霉病菌抗药性菌株麦角甾醇合成的影响
多菌灵为脱氢酶抑制剂,戊唑醇为甾醇抑制剂。多菌灵与戊唑醇(4∶3)复配组合在同等浓度下对麦角甾醇的抑制显著高于单剂,比多菌灵、戊唑醇高6~10倍。多菌灵与戊唑醇的复配增效作用对小麦赤霉病菌抗性菌株与敏感菌株的麦角甾醇合成均有严重影响。但是,脱氢酶与甾醇合成是如何互相影响的有待于进一步研究。

表3 多菌灵、戊唑醇以及混用(4∶3)对小麦赤霉病菌抗药菌株麦角甾醇生物合成的影响
3 讨论
在目前抗病品种缺乏的情况下[11],选择适当药剂并采用合适的施药方法是防治小麦赤霉病的重要措施。多菌灵用于小麦赤霉病的防治已有20多年,监测已发现存在抗药性病原菌群体。本研究表明,多菌灵与戊唑醇4∶3的复配组合离体条件下对小麦赤霉病菌抗性菌株与敏感菌株的增效系数(SR)均大于1.5,表现为增效作用。具体表现在减慢抗性菌株的孢子萌发速率、影响菌株细胞膜的渗透性、使菌株细胞内含物麦角甾醇的含量降低等。田间药效尚需进一步明确。
不同作用机制药剂的复配研究具有重要意义。苯并咪唑类杀菌剂多菌灵具有广谱高效、内吸传导的作用特点,被广泛应用于防治多种病害,但由于其作用位点单一,病原菌极易产生抗药性。三唑类杀菌剂的主要作用机制是抑制细胞的麦角甾醇的生物合成,具有广谱、保护、治疗及内吸作用,由于其作用位点多,病原菌抗药性的产生较缓慢。两者混配使之增加了作用位点和作用途径,一段时期内病原菌的简单变异不足于适应全部作用位点。
随着新药剂的不断问世和用药技术的发展,复配杀菌剂有了充分发展的空间。应用复配杀菌剂防治植物病害在生产中早已大量出现。但植物病害防治是一个复杂的系统。药剂在植物体内传导后,在不同的时间段会产生不同的结果[12],无论对植物体、菌体,还是药剂本身,甚至周围环境都会产生不同的影响。杀菌剂复配机理,特别是增效药剂组合及其不同作用位点的互作,有待于深入研究,以便为克服抗药性以及合理复配杀菌剂奠定坚实基础。
[1]王建新,周明国,陆悦健,等.小麦赤霉病菌抗药性群体动态及其治理药剂[J].南京农业大学学报,2002,25(1):43-47.
[2]张小风,王文桥.研究杀菌剂混用及混剂中若干问题的商讨[C].中国植物病害化学防治研究,1998:17-21.
[3]刘学敏,李立军.杀菌剂混剂的增效作用[J].农药科学与管理,2002,23(5):12-15.
[4]韩丽娟,顾中言,黄祥麟,等.农药复配与复配农药[M].南京:江苏科学技术出版社,1994:5-58.
[5]朱卫刚,陈定花,邢家华.国内杀菌剂混剂概况及展望[J].浙江化工,2001,32(2):52-54.
[6]周明国,王建新.禾谷镰孢菌对多菌灵的敏感性基线及抗药性菌株生物学性质研究[J].植物病理学报,2001,31(4):365-370.
[7]武爱波.禾谷镰刀菌(Fusarium graminearum)致病力鉴定、毒素检测及其分子生物学研究[D].武汉:华中农业大学,2005.
[8]张传清,周明国,邵振润,等.稻瘟病菌对异稻瘟净、多菌灵和三环唑的敏感性检测及抗药性变异研究[J].中国水稻科学,2004,18(5):455-460.
[9]张永杰,高俊明,韩巨才,等.抗速克灵灰霉病菌菌株电导率变化及对渗透压的敏感性[J].山西农业大学学报,2004(1):34-36.
[10]陆长婴,季明东,李沛元,等.多菌灵和三唑酮混配对小麦病害的协同杀菌作用[J].上海农业学报,2000,16(1):62-66.
[11]张勇,程顺和,张伯桥.影响小麦抗赤霉病育种成效的限制因素[J].安徽农业科学,2005,33(3):375-395.
[12]刘飞,黄青春,徐玉芳.杀菌剂作用机制的最新研究进展[J].世界农药,2006,18(1):10-15.
