Cry1Ba3、Cry1Ia8蛋白对Cry1Ac抗性小菜蛾的杀虫活性研究
2010-06-12王少丽宋福平束长龙高继国
刘 楠, 王少丽, 宋福平, 束长龙, 高继国, 张 杰*
(1.东北农业大学生命科学学院,哈尔滨 150030; 2.中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193; 3.中国农业科学院蔬菜花卉研究所,北京 100081)
小菜蛾[Plutella xylostella(Linnaeus)]是世界上对十字花科植物最具破坏性的害虫,主要依赖化学农药进行防治。但化学农药的滥用,已经对人类健康和环境造成了巨大危害,同时引起了害虫抗药性产生的严重后果,使得田间用药量进一步增加,防治成本不断加大,污染进一步加重。生物防治是解决这些问题的有效途径之一[1]。在过去的60年中,因对环境和人畜安全、无残留,苏云金芽胞杆菌(Bacillus thuringiensis,简称Bt)在小菜蛾等重要农业害虫防治中扮演了重要的角色,已经发展成为全球产量最大、应用面积最广的微生物杀虫剂[2]。
Bt是一种革兰氏阳性细菌,在芽胞形成的同时,产生伴胞晶体,晶体中含有一种或多种δ-内毒素蛋白(Cry杀虫蛋白)。Bt杀虫晶体蛋白对多种有害昆虫,包括鳞翅目、双翅目、鞘翅目、膜翅目、同翅目,以及线虫等原生动物具有毒杀作用[3]。国内外所应用的Bt制剂绝大多数为B.thuringiensis subsp.kustaki亚种,其主要杀虫成分为Cry1A类蛋白。然而随着Bt制剂在田间广泛使用,小菜蛾已经对Bt制剂产生了不同程度的抗性[4-6],因此如何合理有效地进行这种抗性治理,已经成为农业生产实践中亟待解决的问题,关系到Bt这个重要生物防治资源能否可持续利用,更是实现蔬菜生产绿色、安全的重要保障。2006年,Zhao等报道了小菜蛾对转单一Bt cry基因的花椰菜易产生抗性,而对转双价Bt cry基因植物很难产生抗药性[7]。因此筛选和寻找与Cry1A类蛋白无交互抗性的新的Bt菌株和蛋白组合是克服和延缓害虫抗药性产生的有效途径。
cry1Ba基因表达产物对鳞翅目和鞘翅目害虫都具有杀虫活性,已经成功地用于工程菌构建[8]和抗虫转基因水稻研究[9]。cry1Ia类基因在Bt内是一类沉默基因,其表达产物对多种农业害虫均有高毒力[10-11]。中国农科院植物保护研究所先后克隆了cry1Ba3[8,12]和cry1Ia8基因[10],并发现两者表达产物均对小菜蛾具有高毒力[10,13]。但是,迄今为止尚未见到Cry1B和Cry1I类蛋白对Bt抗性小菜蛾杀虫活性的正式报道。
本文分别以Cry1Ba3、Cry1Ia8两种单一的蛋白及其组合,分别对Cry1Ac抗性、敏感的小菜蛾种群进行了生测,结果表明这2种毒素,以及混合蛋白对Cry1Ac蛋白抗性小菜蛾具有高活性;这些结果为Cry1Ba3和Cry1Ia8对小菜蛾杀虫作用机理的研究提供理论支持,为抗性治理和新一代转基因抗虫植物的研制提供了新的基因来源。
1 材料与方法
1.1 菌株及来源
所用菌株均为本组保藏,野生菌株UV17表达Cry1Ba3蛋白,标准菌株HD-73表达Cry1Ac蛋白;BL21-pB081Ia为本实验室构建含有cry1Ia8基因大肠杆菌表达型菌株[10],详见表1。

表1 本研究所用的菌株及其表达的Cry类蛋白
1.2 供试小菜蛾
敏感种群、抗性种群为中国农科院蔬菜与花卉所提供,其中抗性种群对Bt毒素Cry1Ac有显著抗性,室内持续用Cry1Ac蛋白汰选5年。
1.3 杀虫晶体蛋白的制备
1.3.1 Bt菌株的培养与蛋白提取
采用等电点沉淀法提取[14]。30℃过夜活化HD-73(含有 cry1Ac基因)、UV-17菌株(含有cry1Ba3基因),以1%接种量转接于1 L牛肉膏蛋白胨液体培养基中,30℃、230 r/min培养至芽胞形成。4℃、6 000 r/min离心,获得胞晶混合物沉淀后,将沉淀重悬于 50 mL裂解液(50 mmol/L Na2CO3,50 mmol/L EDTA和5%的巯基乙醇,0℃预冷),在冰浴、100 r/min条件下溶解4 h;4℃、12 000 g离心收集上清,用 4.0 mol/L pH 4.5 NaAc-HAc缓冲液将 pH调至 4.5,以沉淀蛋白。4℃静置4 h,4℃、12 000 g离心收集沉淀,用预冷的无菌水洗2遍,溶解于10 mL pH 9.6 50 mmol/L Na2CO3,备用。
1.3.2 大肠杆菌菌株的培养与蛋白提取
37℃过夜活化 BL21-pB081Ia菌株(含有cry1Ia8基因),以1%接种量转接于200 mL LB液体培养基中,37℃,230 r/min培养2 h,加入诱导物IPTG,终浓度为0.5 mmol/L,150 r/min,20℃诱导10 h,离心、收集沉淀。将收集的沉淀加入1 mL的20 mmol/L T ris缓冲液(pH 8.0)悬浮,超声破碎振幅37%,超声1 min,裂解后,再离心收集上清,沉淀悬浮于1 mL 20 mmol/L Tris缓冲液[15]。
1.3.3 杀虫晶体蛋白SDS-PAGE分析
将上述获得的蛋白溶液 20 μ L,加入 20 μ L dd H2O,加入 20 μ L 3 倍 SDS-PAGE 上样缓冲液 ,混匀,100℃5 min,12 000 g离心5 min,取上清为电泳样品。SDS-PAGE分析条件:4%浓缩胶,8%分离胶,10 μ L上样量,80 V 10 min,120 V 电泳,直到溴酚蓝达到胶底部边缘。上样缓冲液与凝胶配制、染色脱色等参照文献[16]进行。电泳图片用软件Quantity One进行定量分析。
1.4 生物活性测定
参照Tabashnik等的叶片浸渍法[17]。取新鲜、洁净的甘蓝叶片,用 0.1%Triton-100水溶液(50 mg/mL)稀释 Bt毒素,以 0.1%Triton-100溶液处理作对照。将叶片在不同浓度的Bt毒素中浸10 s,放在平板上自然晾干,然后将叶片转入培养皿中,在培养皿底放一层浸过蒸馏水的滤纸保湿。每皿接入15头2龄幼虫,每个浓度重复4次,共处理60头幼虫。
Cry1Ba3和Cry1Ia8两种蛋白按质量比1∶1混配成组合蛋白溶液进行生测;Bt蛋白溶液以50 mmol/L Na2CO3为对照,大肠杆菌破碎沉淀以空载菌体破碎沉淀为对照,72 h调查结果。
1.5 数据分析
用软件Quantity One分析,选取已知浓度标准BSA为蛋白定量标准,选取空白胶区域为 Background,选取目的条带,并输出分析报告。以分析结果的蛋白量进行换算,计算出目的蛋白浓度进行生物活性测定。杀虫测定结果用POLO软件处理,协同毒力指数采用 Tabashnik[18]公式法计算,公式如下:
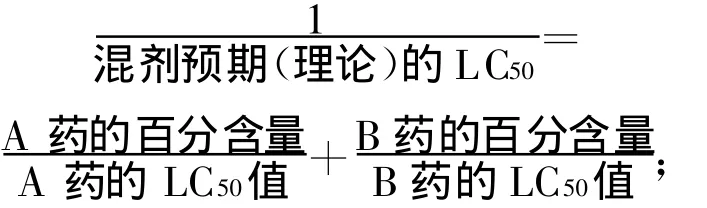
协同毒力指数=试验所得LC50/预期LC50×100。
由于试验误差和供试生物等未被觉察到的不一致性,一般认为,预期LC50与实测LC50的毒力比值在50%~260%之间属相加作用,大于260%属增效作用,小于 50%时属拮抗作用(Finney法)[19];用SAS软件进行显著性分析。
2 结果与分析
2.1 杀虫蛋白SDS-PAGE分析
Cry1Ac、Cry1Ia8、Cry1Ba3 3 种蛋白分 别进行SDS-PAGE定量分析,电泳结果参见图1。Cry1Ia8、Cry1Ac、Cry1Ba3蛋白的分子量分别为 81、133、140 ku,浓度分别为 1.5、2.5、2.0 μ g/mL 。
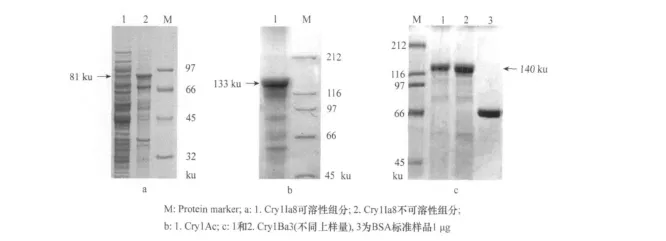
图1 3种Cry蛋白 SDS-PAGE定量分析
2.2 小菜蛾生物活性测定
2.2.1 小菜蛾抗性水平测定
首先对连续5年用Cry1Ac蛋白汰选的小菜蛾抗性种群进行测定,以明确抗性倍数。测定结果:Cry1Ac蛋白对敏感小菜蛾 2龄幼虫LC50为0.0466 μ g/mL(95%置信限 0.036 0~ 0.060 3 μ g/mL);而 Cry1Ac蛋白对抗性小菜蛾幼虫 LC50=12.261 1 μ g/mL(95%置信限8.567 6~17.546 9 μ g/mL),抗性倍数约263倍。说明经过Cry1Ac蛋白汰选,显著降低了小菜蛾种群对Cry1Ac蛋白的敏感性。
2.2.2 供试样品测定
Cry1Ia8、Cry1Ba3蛋白对敏感种群试虫生测结果表明(详见表 2):Cry1Ba3 的 LC50=0.435 1 μ g/mL,Cry1Ia8 的 LC50=2.710 μ g/mL,Cry1Ba3 的毒力比Cry1Ia8高6.2倍。而Cry1Ia8+Cry1Ba3组合蛋白的LC50=0.526 6 μ g/mL,介于上述两种蛋白之间。通过计算协同毒力指数(预期LC50=0.596 6 μ g/mL)(公式见 1.5)为88.267%,说明Cry1Ia8+Cry1Ba3组合蛋白对敏感种群没有拮抗作用,也没有明显增效。
对抗性小菜蛾种群试虫测定结果表明:Cry1Ba3 的 LC50=0.217 5 μ g/mL,Cry1Ia8 的LC50=0.670 6 μ g/mL,前者较后者毒力高约3倍;Cry1Ia8+Cry1Ba3 组合蛋白的 LC50=0.437 5 μ g/mL,介于Cry1Ia8、Cry1Ba3单一蛋白之间。通过计算协同毒力指数(LC50为 0.335 7 μ g/mL)(公式同前)为76.73%,说明Cry1Ia8+Cry1Ba3组合蛋白没有拮抗作用,也没有明显增效。
用u测验分析同种样品之间对抗性和敏感种群毒力差异的显著性,用SAS软件进行计算(结果见表2),Cry1Ba3对于两种群间的LC50差异不显著(u=0.893,P=0.371 8),RI值为0.5;Cry1Ia8 LC50差异显著(u=3.077,P=0.002 6),RI值为 0.2;而Cry1Ia8+Cry1Ba3组合蛋白 LC50差异不显著(u=0.591,P=0.554 7),RI值为0.8。说明抗性品系对Cry1Ba3,Cry1Ia8+Cry1Ba3的敏感性没有下降,而抗性品系对Cry1Ia8的敏感性反而有所上升。这些结果同时证明Cry1Ba、Cry1Ia8及其组合与Cry1Ac毒素不存在交互抗性。

表2 Bt毒素对小菜蛾不同种群的生物活性测定结果(72 h)
3 讨论
本文通过对敏感和Cry1Ac抗性小菜蛾杀虫活性研究,发现了Cry1Ba3、Cry1Ia8蛋白及其组合对这两个种群均有高毒力,Cry1Ba3蛋白的毒力略高于Cry1Ia8蛋白。说明 Cry1Ba3、Cry1Ia8蛋白与Cry1Ac蛋白无交互抗性。Cry1Ba3、Cry1Ia8+Cry1Ba3组合对抗性和敏感种群的LC50数值差异不显著;而Cry1Ia8对2个种群的LC50数值差异显著,特别是对抗性害虫的毒力高于敏感种群。这种原因值得进一步深入研究。Cry1Ba对小菜蛾等鳞翅目害虫[8]、叶甲科鞘翅目害虫[12]具有活性,而Cry1Ia则对小菜蛾、玉米螟[Ostrinia f urnacalis(Guenée)]、棉 铃 虫 [Helicoverpaarmigera(Hübner)]等害虫具有高毒力[10-11],作者研究发现两者的组合虽然没有显著的协同增效作用,但是不存在拮抗,这种组合将有望扩大杀虫谱,并有效地克服或延缓害虫抗性的产生[7]。
Cry1Ba3原毒素与Cry1Ac原毒素的相似性为57%,而与决定毒素的专一性和与受体的特异性结合的Domain II[20-21],相似性仅为28%。Cry1Ia8原毒素与Cry1Ac原毒素的相似性为45%,而与决定毒素的专一性和与受体的特异性结合的Domain II,相似性低于30%(序列数据来源http:∥www.lifesci.sussex.ac.uk/home/Neil-Crickmore/Bt/toxins2.html,比对数据来自http:∥blast.ncbi.nlm.nih.gov/Blast.cgi),这说明可能是由于Cry1Ba3和Cry1Ia8与Cry1Ac的同源性比较低,在小菜蛾的中肠上的结合位点不同,因此与Cry1Ac蛋白没有交互抗性。
Cry1Ba3和Cry1Ia8蛋白组合对小菜蛾没有协同增效作用,经比对,两者的Domain II相似性为62%,远远高于两者与Cry1Ac的相似性,推测这两种蛋白在小菜蛾有可能存在相同或相似的杀虫机制。关于两者相互作用,还有待进一步的试验结果来验证。
小菜蛾防治中的主要问题之一就是害虫抗药性,特别是对Bt制剂等微生物农药的抗性产生。作者从本实验室中克隆的cry类基因中筛选获得了对抗性小菜蛾幼虫有高毒力的Cry1Ba3和Cry1Ia8蛋白组合,为两种蛋白杀虫机理的研究提供理论支持,为延缓和克服害虫抗性产生的转基因产品的研制提供了基因资源。目前,cry1Ba3和cry1Ia8基因组合正在用于转基因抗虫甘蓝的研究,随着转cry1Ba3和cry1Ia8双价基因甘蓝的获得,将为小菜蛾的抗性预防和治理提供强有力的支持。
[1]赵建周,吴世昌,顾言真,等.小菜蛾抗药性治理对策研究[J].中国农业科学,1996,29(1):8-14.
[2]中国植物保护学会.植物保护学学科发展报告,2007-2008[R].中国科学技术出版社,2008:138-142.
[3]Schnepf E,Crickmore N,Van Rie J,et al.Bacillus thuringiensis and its pesticidal crystal proteins[J].Microbiology and M olecular Biology Reviews,1998,62(3):775-806.
[4]Tabashnik B E.Evolution of resistance to Bacillusthuringiensis[J].Annual Review of Entomology,1994,39:47-79.
[5]Wright D J,Iqbal M,Granero F,et al.A change in a single midgut receptor in the diamondback moth(Plutella xy lostella)is only in part responsible for field resistance to Bacillus thuringiensis subsp.kurstaki and B.thuringiensis subsp.aizawai[J].Applied and Environmental Microbiology,1997,63(5):1814-1819.
[6]Liu Y B,Tabashnik B E,M asson L,et al.Binding and toxicity of Bacillus thuringiensis protein Cry1C to susceptible and resistant diamondback moth(Lepidoptera:Plutellidae)[J].Journal of Economic Entomology,2000,93(1):1-6.
[7]Zhao J,Cao J,Collins H L,et al.Concurrent use of transgenic plants expressing a single and two Bacillus thuringiensis genes speeds insect adaptation to pyramided plants[J].P roceedings of the National Academy of Sciences of the USA,2006,102(24):8426-8430.
[8]Wang G,Zhang J,Song F,et al.Recombinant Bacillus thuringiensis strain shows high insecticidal activity against Plutella xylostella and Leptinotarsa decemlineata without affecting nontarget species in the field[J].Journal of Applied Microbiology,2008,105(5):1536-1543.
[9]Victòria M,Enric M,Jean M V,et al.Inv itro insect-feeding bioassay to determine the resistance of transgenic rice plants transformed with insect resistance genes against striped stem borer(Chilo suppressalis)[J].In Vitro Cellular&Developmental Biology-Plant,2002,38(4):310-315.
[10]窦黎明,韩岚岚,张杰,等.苏云金芽胞杆菌cry1Ia基因的克隆、表达与活性研究[J].农业生物技术学报,2007,15(6):1053-105.
[11]Slim T,Ammar E A,Mark B,et al.Evidence of oral toxicity of Photorhabdus temperata strain K122 against Pray s oleae and its improvement by heterologous expression of Bacillus thuringiensis cry 1Aa and cry1Ia genes[J].Journal of Invertebrate Pathology,2006,91(2):131-135.
[12]张杰.对鞘翅目害虫高毒力的Bt cry基因分离克隆和工程菌的构建[D].北京:中国农业科学院,2000.
[13]王广君,张杰,孙东辉,等.苏云金芽胞杆菌杀虫晶体蛋白Cry1Ba结构域Ⅱ中 Loops结构与功能关系研究[J].生物工程学报,2008,24(9):1631-1636.
[14]Luo K,Banks D,Adang M J.T oxicity,binding,and permeability analy ses of four Bacillus thuringiensis Cry1 delta-endotoxins using brush border membrane vesicles of Spodoptera ex igua and S podoptera frugiperda[J].Applied and Environmental Microbiology,1999,65(2):457-464.
[15]Song F,Zhang J,Gu A,et al.Identification of cry 1I-type genes from Bacillus thuringiensis strains and characterization of a novel cry1I-type gene[J].Applied and Environmental Microbiology,2003,69(9):5207-5211.
[16]Maniatis T,Fritsch E F,Sambrook J.Molecular cloning:A laboratory manual[M].2nd ed New York:Cold Spring Harbor Laborato ry Press,1989:880-887.
[17]T abashnik B E,Cushing N L,Johnson M W.Diamondback moth resistance to insecticides in Hawaii:intra-island variation and cross-resistance[J].Journal of Economic Entomo1ogy,1987,80(6):1091-1099.
[18]Tabashnik B E,Evaluation of synergism among Bacillus thuringiensis toxins[J].Applied and Environmental Microbiology,1992,58(10):3343-3346.
[19]曹坳程,张向才.关于农药混用评价标准的讨论[J].农药科学与管理,1999,20(4):31-33.
[20]Li J,Carrol J,Ellar D J.Crystal structure of insecticidal δendotoxin from Bacillus thuringiensis at 2.5Å resolution[J].Nature,1991,353(6347):815-821.
[21]Boonserm P,Davis P,Ellar D J,et al.Crystal structure of the mosquito-larvicidal toxin Cry4Ba and its biological implications[J].Journal of Molecular Biology,2005,348(2):363-382.
