西藏八角莲叶斑病鉴定及其生物学特性研究
2010-06-12张格杰何建清岳海梅
张格杰, 何建清, 岳海梅
(西藏大学农牧学院,林芝 860000)
西藏八角莲Dysosma sayuensis Ying)属小檗科八角莲属,是我国特有多年生草本植物。近年的研究表明其活性成分对治疗食道癌、子宫癌有特效,而且花和叶较美丽,可供观赏,第一批国家珍稀濒危保护植物名录将其列为三级保护植物[1]。
西藏八角莲叶斑病是藏东南近年发生的一种新病害,病情发展迅速,危害逐年加重,已扩展蔓延到周边县区药材种植基地。国内外学者对八角莲属及其近缘属植物的系统学、解剖学、植物化学和药理学等方面,已有一系列的研究报道[2-7],但尚未见关于八角莲叶斑病的系统报道,对其发生、流行规律、病原种类及生物学特性尚不清楚,防治较为困难。为了尽快明确上述问题,制订出一套符合当地情况的病害防治措施,作者于2007-2008年对该病害进行了系统研究。
1 材料与方法
1.1 病害调查
在八角莲叶斑病的发生期(4-10月),随机调查八角莲叶片100片,统计病叶率,并记载叶片病斑数。
1.2 症状观察
2007年4-10月和2008年4-10月在西藏农牧学院八角莲种植基地定点、定株、定时对八角莲叶斑病进行系统观察,详细记载和描述从显症到病害停止发生各个时期的症状特点,并采集标本于室内进行病原分离,观察其形态特征。
1.3 病原菌鉴定
1.3.1 自然发病组织上病菌观察
从八角莲自然发病叶片、果实和茎上取病菌镜检,或取病组织保湿培养镜检,观察描述病菌形态,并测量其大小。
1.3.2 分离培养
从八角莲病叶上取病健交界处的组织,剪成约0.5cm2大小,在70%乙醇中浸5s,0.1%升汞中浸1min,灭菌水洗3次,置PDA培养基上,25℃培养,待长出菌丝后,取菌落边缘菌丝置PDA培养基中心培养。
1.4 致病性测定
在自然条件下,用直径为4mm菌碟对健康八角莲叶片进行有伤与无伤定位接种,以清水琼脂为对照,重复3次,每重复接种 20片叶,保湿 48h,每2d观察一次症状。发病后取叶部病斑再分离。
1.5 病原菌生物学特性研究
1.5.1 不同碳源对菌丝生长速率的影响
基础培养基为查氏(Czapek)培养基,其中碳源蔗糖分别用等质量碳的葡萄糖、麦芽糖、甘露醇、乳糖、果糖、淀粉、山梨醇、半乳糖、木糖等替换,以无碳培养基为对照。
1.5.2 不同氮源对菌丝生长速率的影响
基础培养基为查氏培养基,其中硝酸钠分别用等质量氮的硝酸钾、硝酸钠、酪氨酸、天门冬酰胺、硝酸铵、牛肉膏、精氨酸、蛋白胨、硫酸铵等氮源替代,以无氮源培养基为对照。
1.5.3 温度对菌丝生长的影响
将病原菌接种在PDA培养基上,于 5、10、15、20、25、30、35 ℃和40 ℃恒温培养箱中培养,5d后测量菌落直径,每个处理重复3次。
1.5.4 pH对菌丝生长的影响
培养基灭菌后,分别调节pH 为2 、3、4、5、6、7、8、9、10、11、12,接菌后于 25 ℃恒温培养箱中培养,5d后测量菌落直径,每个处理重复3次。
1.5.5 光照条件对菌丝生长的影响
将菌丝块接种于PDA培养基平板中央,置于完全黑暗、黑暗和光照各12h、完全光照下,放置在28℃恒温培养箱中培养,5d后测量菌落直径。
2 结果与分析
2.1 病害调查
八角莲叶斑病始发于4月下旬,7月进入盛发期。2007年,在林芝发生危害严重,病叶率90%左右,叶片病斑最多达187个,造成八角莲叶片大量枯黄。在7-8月份连续阴雨时,20d内引起该病流行,造成大量八角莲死亡。
2.2 症状
八角莲叶斑病主要危害八角莲叶片,也危害叶柄和果实(图1a、b)。叶片染病初期出现针尖大小的褪绿斑点,然后向四周扩散,后期形成边缘红褐色、中央黄褐色或褐色的病斑。病斑近圆形或不规则形,轮廓不清(图1a)。病斑大小2~6mm。遇高温低湿天气,病斑易穿孔。发病后期枯死叶面生有黑色小点(即分生孢子器图1c)。
2.3 致病性测定
致病性测定结果显示,八角莲叶片有伤和无伤均产生典型病斑。接种菌碟后2d,菌碟周围出现褪色,接种后4d,病斑范围继续扩大,同时病斑呈现红褐色,接种后6d,病斑上产生小黑点,即病菌的分生孢子器。
2.4 病原菌鉴定
菌落圆形,边缘不整齐,初期边缘白色,后变墨绿色,最后变深灰色至黑色。菌丝发达,在培养基上,形成一层似棉絮状的白色至灰色菌丝(图1d)。分生孢子器叶面生,散生,初埋生,后突破表皮,孔口外露,居中,近球形或扁球形,胞壁加厚 ,暗褐色,直径 45~ 65 μm,高 40~ 55 μm;器壁膜质,褐色,由数层细胞组成,壁厚 2.8~4.5μm,内壁无色,形成产孢细胞,上生分生孢子(图 1e);分生孢子针形,无色,基部钝圆,顶端尖,直或弯曲,无隔膜,分生孢子大小为(19~35)μm×(1~1.5)μm(图 1f)。根据对病原菌形态特征观察、致病性测定及病原菌生物学特性初步研究,按文献[8]将病原菌鉴定为半知菌亚门,腔孢纲,球壳孢目,球壳孢科,壳针孢属(Septoria sp.)真菌。
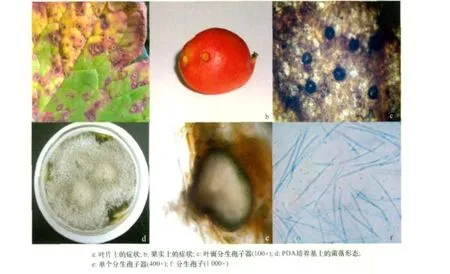
图1 西藏八角莲叶斑病症状及显微特征
2.5 病原菌生物学特性
2.5.1 不同碳源、氮源对病菌菌丝生长速率的影响
碳源对八角莲壳针孢菌丝生长速率的影响见表1。试验结果表明,八角莲壳针孢菌对不同碳源的利用程度有显著差异,八角莲壳针孢菌在含碳源与不含碳源的培养基上均可生长,在以山梨醇为碳源的培养基上菌丝生长最快,病菌生长速率为9.3mm/d,以木糖为碳源时,病菌的菌丝生长速率较慢,病菌生长速率为6.8mm/d。八角莲壳针孢菌在以山梨醇、甘露醇2种供试碳源培养基上的菌丝生长速率均与无碳源对照无差异,但在菌丝量上存在显著差异,无碳源对照菌落稀薄。
氮源测定结果显示,以蛋白胨为氮源时,八角莲壳针孢菌菌丝生长良好,生长速率快,病菌生长速率为10mm/d;以硝酸铵、硫酸铵为氮源时,菌丝生长较慢,病菌生长速率在 6mm/d以下。试验中观察到,无氮对照的菌丝生长速率也较快,但菌丝稀疏。
2.5.2 温度对病原菌菌丝生长的影响
温度对病原菌的生长具有显著的影响,菌丝在10~35℃范围内均能扩展,20~30℃是菌丝生长的最适宜温度。低于10℃或高于35℃均不利于病原菌菌丝的生长(表2)。2.5.3 pH对菌丝生长的影响
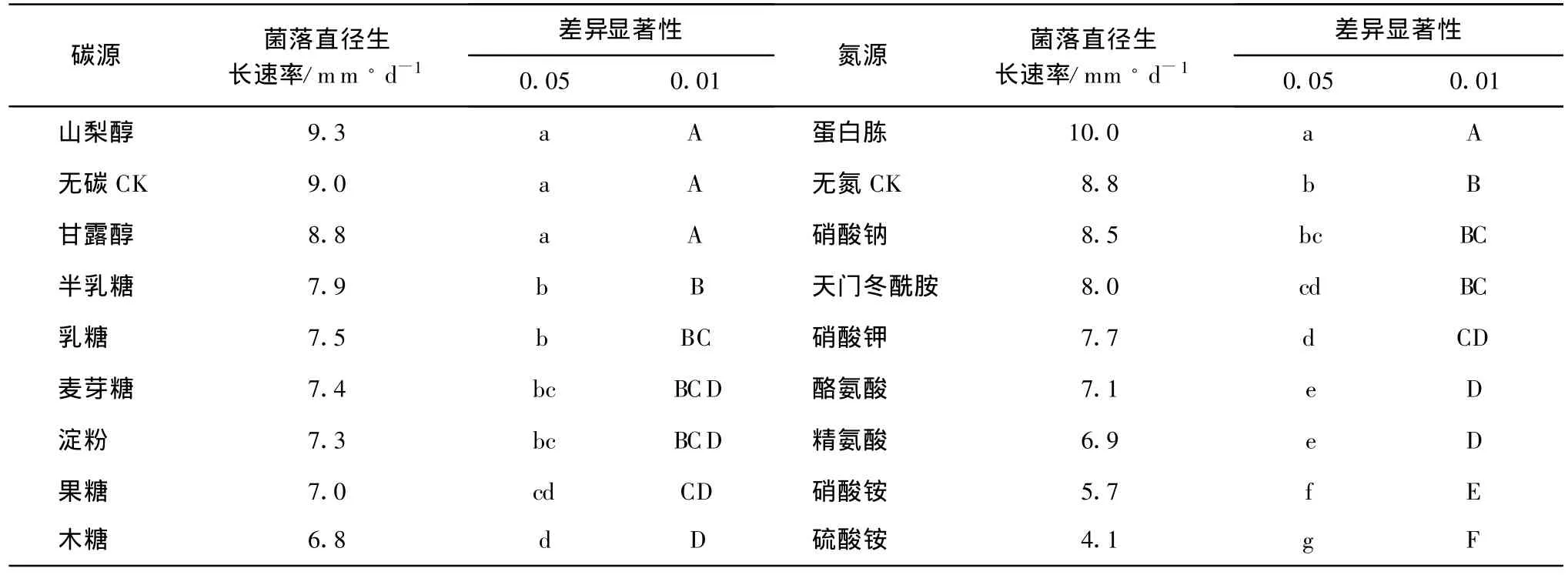
表1 不同碳源、氮源对八角莲叶斑病病菌菌丝生长速率的影响
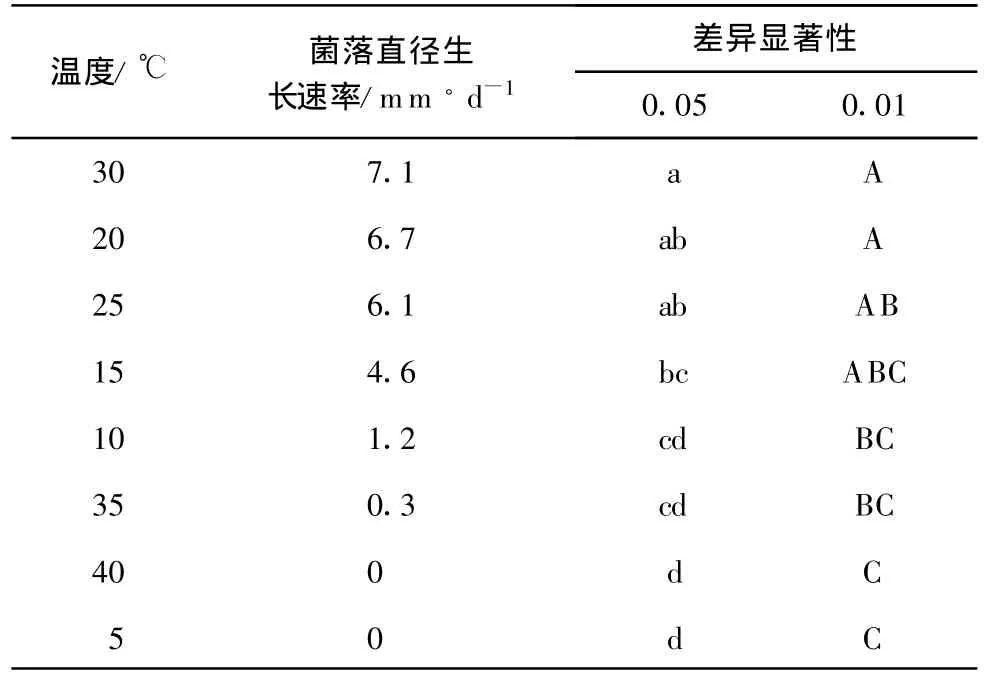
表2 温度对八角莲叶斑病病菌菌丝生长的影响
菌落生长的pH范围为2~12,pH小于2或大于12菌落均不能生长。pH为7~9时,菌落生长速度最快,为该菌最适宜生长的pH范围。
2.5.4 光照条件对菌丝生长的影响
3种处理中黑暗条件下最有利于菌丝生长,光照对菌丝生长有一定的抑制作用,但差异不明显。
3 结论与讨论
目前,国内外还没有八角莲叶斑病病原的报道。经病原菌的形态特征观察、致病性测定、培养性状研究,作者将其病原菌鉴定为半知菌亚门壳针孢属(Septoriasp.)真菌,为八角莲新病害。
病原菌生物学特性测定表明,在碳源利用方面,以山梨醇最好,木糖最差;在氮源利用方面,以蛋白胨最佳,硫酸铵最差,虽然菌丝在不加碳或氮源的对照培养基上长得较快,但菌丝长势稀薄,总生物量较少;菌丝生长的适宜温度范围为20~30℃,在10~35℃范围内菌丝均能生长;病菌适宜的pH范围为7~9;光照对菌丝生长影响不明显。
八角莲叶斑病属新病害,目前尚未见有关发病、流行规律及防治技术的系统研究报道,病害侵染过程及侵染循环不详,应尽快开展相关研究。
[1]宋朝枢,保荣章,张清华.中国珍稀濒危保护植物[M].北京:中国林业出版社,1989:153.
[2]马绍宾.川八角莲繁殖生态学初步研究[J].植物生态学报,2000,24(6):748-753.
[3]苏应娟,刘启宏.湖北产八角莲属植物花粉形态研究[J].武汉植物研究,1994,12(3):217-219.
[4]苏应娟,程莲良.湖北产八角莲属3种植物的解剖学研究[J].武汉植物学研究,1994,12(2):111-115.
[5]苏应娟,刘启宏.湖北八角莲属植物过氧化物酶同工酶分析[J].武汉植物学研究,1994,12(1):44-48.
[6]苏应娟,刘启宏.湖北八角莲属植物叶表皮研究[J].武汉植物学研究,1992,10(4):385-386.
[7]黄衡宇,马绍宾.八角莲小孢子发生和雄配子形成[J].植物研究,2001,21(4):561-566.
[8]白金铠.中国真菌志[M].北京:科学出版社,2004:289-291.
