头孢克洛片微生物限度检查方法的探讨
2010-06-08黄新兰李雪兰季红兰
黄新兰 李雪兰 季红兰
江苏省扬子江药业集团有限公司(225321)
头孢克洛片临床主要用于治疗呼吸道、泌尿道和皮肤组织感染以及中耳炎[1]等,该药物对革兰阴性菌和阳性菌都具有抗菌作用。本文采用了多种方法消除该药物的抗菌活性,按要求将5株试验菌:金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、白色念珠菌和黑曲霉加入头孢克洛片中。细菌采用离心沉淀加薄膜过滤法,霉菌、酵母菌采用常规法,控制菌宜采用离心沉淀、培养基稀释加薄膜过滤法,对各试验菌的回收率进行逐一验证,从而建立了头孢克洛片的微生物限度的检查方法。
1 仪器与试药
HTY-2000A型智能集菌仪(泵速设为160r/min)、HTY-K型培养器专用振荡仪、HTY型反复使用全封闭集菌培养器 (杭州高得泰林生物技术设备有限公司)、LRH-250生化培养箱(上海索普仪器有限公司)、KA-1000型离心机(上海安亭科学仪器厂)。
试验菌种:金黄色葡萄球菌[CMCC(B)26003]、枯草芽孢杆菌[CMCC(B)63501]、大肠埃希菌[CMCC(B)44102]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003](均来源于中国药品生物制品检定所,传种代数为第3代)。
胆盐乳糖培养基、玫瑰红钠琼脂培养基、营养琼脂培养基、营养肉汤培养基、改良马丁琼脂培养基、改良马丁液体培养基、4-甲基伞形酮葡萄糖苷酸培养基(均来源于北京三药科技开发公司)、pH=7.0无菌氯化钠-蛋白胨缓冲液(扬子江药业集团有限公司输液制剂车间配制);头孢克洛片(扬子江药业集团有限公司,批号08052501、08053001、08053002规格:0.25g)。
2 方法[2-4]与结果
2.1 菌液的制备
将上述菌种按2005年版《中国药典》二部 附录Ⅺ J菌液制备方法制成所需浓度的菌悬液和孢子悬液。
2.2 供试液制备
取供试品5g,加入约45℃的pH=7.0无菌氯化钠-蛋白胨缓冲液至100mL,保温振摇使混匀,作为1∶20的供试液。
取1∶20的供试液10mL至离心管中,以500转/min离心5min,取上清液至另一离心管中,加pH=7.0无菌氯化钠-蛋白胨缓冲液补至10mL,混匀,作为离心后1∶20的供试液。
2.3 细菌、霉菌和酵母菌检查方法的验证
2.3.1 细菌检查方法的验证
试验组:取离心后1∶20的供试液,注入反复使用全封闭集菌培养器(含有100mL的pH=7.0无菌氯化钠-蛋白胨缓冲液)中,振摇过滤,用pH=7.0无菌氯化钠-蛋白胨缓冲液冲洗300mL(50mL/次),在最后一次冲洗液中分别加入50~100cfu的菌悬液,取出滤膜,菌面朝上置相应的培养基贴膜培养,置规定的温度培养至规定的时间,逐日观察结果,测定供试品本底菌数。
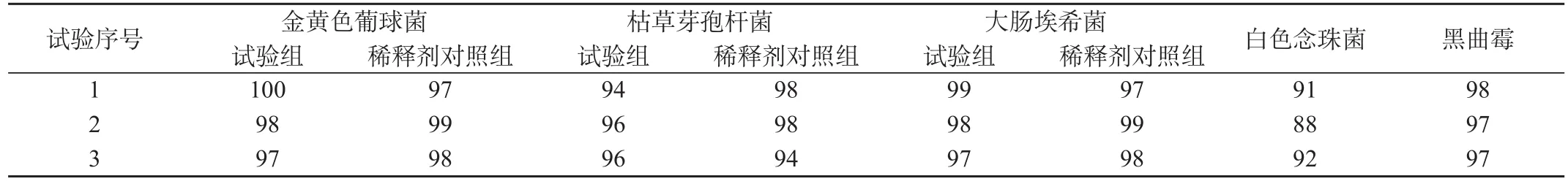
表1 微生物验证方法试验结果(回收率%)

表2 大肠埃希菌控制菌验证方法试验结果
菌液组:测定每一菌株所加的试验菌数。
供试品对照组:照试验组制备项下操作,不加菌悬液,作为供试品本底菌数。
稀释剂对照组:取45℃的pH=7.0无菌氯化钠-蛋白胨缓冲液至100mL,混匀,取10mL至离心管中,以500转/min离心5min,取上清液至另一离心管中用pH=7.0无菌氯化钠-蛋白胨缓冲液补至10mL,混匀,用pH=7.0无菌氯化钠-蛋白胨缓冲液冲洗300mL(50mL/次),在最后一次冲洗液中分别加入50~100cfu的菌悬液,取出滤膜,菌面朝上置相应的培养基贴膜培养,置规定的温度培养至规定的时间,逐日观察结果。
2.3.2 霉菌和酵母菌检查方法的验证
试验组:取1∶20的供试液各1mL,注入平皿中,在每个平皿中分别加入1mL菌悬液,立即倾注玫瑰红钠琼脂培养基15~20mL,混匀,凝固,于23~28℃倒置培养,以72h点计菌落数。
菌液组:测定每一菌株所加的试验菌数。
供试品对照组:照试验组制备项下操作,不加菌悬液,作为供试品对照组。
将上述细菌培养皿置于30~35℃倒置培养48h;霉菌及酵母菌培养皿置于23~28℃倒置培养72h,分别点计菌落数并记录。
2.4 控制菌检查方法的验证
供试液的制备:同“2.2”离心后1∶20的供试液。
试验组:取离心后1∶20的供试液20mL,至250mL pH=7.0无菌氯化钠-蛋白胨缓冲液中,振摇过滤,然后用300mL 45℃pH=7.0无菌氯化钠-蛋白胨缓冲液振荡冲洗,每次50mL,在最后一次过滤液中加入10~100cfu的大肠埃希菌菌悬液,过滤后取出滤膜,置250mL锥形瓶中,加入约200mL的胆盐乳糖增菌培养基,于35~37℃培养18~24h,必要时可延长至48h。
阴性菌对照组:取上述1∶20的离心供试液20mL,至100mL pH=7.0无菌氯化钠-蛋白胨缓冲液中,振摇过滤,然后用300mL 45℃pH=7.0无菌氯化钠-蛋白胨缓冲液振荡冲洗,每次50mL,在最后一次过滤液中加入10~100cfu的金黄色葡萄球菌菌悬液,过滤后取出滤膜,置250mL锥形瓶中,加入约200mL的胆盐乳糖增菌培养基,于35~37℃培养18~24h,必要时可延长至48h。
阳性对照试验:取大肠埃希菌菌悬液1mL,置250mL锥形瓶中,加入约200mL的胆盐乳糖增菌培养基,于35~37℃培养18~24h,必要时可延长至48h。
阴性对照试验:取pH=7.0无菌氯化钠-蛋白胨缓冲液20mL,置250mL锥形瓶中,加入约200mL的胆盐乳糖增菌培养基,于35~37℃培养18~24h,必要时可延长至48h。
检查:取上述试验液的培养物各0.2mL,接种至含5mL MUG培养基的试管内,培养,于5、24h在366nm紫外线下观察,同时用未接种的MUG培养基作本底对照。
2.5 验证结果
见表1和表2。
3 讨 论
方法验证所用菌株选择的原则:选择代表性、 普遍性、低或非致病性的标准菌株(或该药品中常见的污染菌)。菌种的要求:传代不得超过 5代,采用适宜的方法保存,应防止变异。菌液浓度也是影响方法验证的一个重要因素,浓度应适中,控制在50~100cfu,实际工作中,发现试验用的50~100cfu菌液对温度比较敏感,过高的温度影响菌液的活性,造成菌回收率的不准确性,进而影响方法的确定。所以在操作中应采用当日新鲜制备的菌液,并注意周围环境温度的控制。
本品是具有强抗菌作用的抗生素,经多次试验,细菌宜采用离心沉淀加薄膜过滤法;霉菌、酵母菌采用常规法;控制菌宜采用离心沉淀、培养基稀释加薄膜过滤法,以消除抑菌活性。薄膜过滤所用的冲洗量以200、300、400mL进行研究验证,最后确定 300mL冲洗量可达完全消除抑菌活性的作用,菌回收率均可达标。
[1]中华人民共和国药典临床用药须知[S].2005年版.化学药和生物制品卷.
[2]李惠娥,张丹,由亚宁,等.14种化学药品微生物限度检查方法验证结果及分析[J].西北药学杂志,2007,22(6):325-327.
[3]李惠娥,由亚宁,衷红梅,等.复方头孢克洛颗粒微生物限度检查方法的探讨[J].药物分析杂志,2007,27(7):1086-1088.
[4]中国药典[S].2005年版.二部.附录93-98.
