乳腺癌内分泌治疗耐药机制探讨
2010-06-07程少萍
程少萍 韦 伟
北京大学深圳医院乳腺外科, 广东 深圳 518036
乳腺癌内分泌治疗耐药机制探讨
程少萍 韦 伟
北京大学深圳医院乳腺外科, 广东 深圳 518036
乳腺肿瘤;药物疗法;雌激素拮抗剂;芳香酶/拮抗剂和抑制剂;耐药性
*通讯作者:韦伟
乳腺癌内分泌治疗(ednocrine therapy,ET)在临床面临的主要问题是原、继发性耐药。即使雌激素受体(estrogen recep tor,ER)和孕激素受体(progestogen receptor,PR)均为阳性,也只有70%左右的患者治疗有效。即约有30%的受体阳性患者存在内分泌治疗原发耐药,并且几乎所有初治有效的患者在应用ET药物一段时间后会出现治疗无效,即继发耐药。有关ET治疗耐药机制及逆转的研究已成为临床亟待解决的主要问题。
根据对ER的依赖性,乳腺癌内分泌耐药机制分为ER依赖的内分泌耐药机制及ER非依赖的内分泌耐药机制,下面将从此两方面对乳腺癌内分泌治疗耐药机制进行综述。
1 ER依赖机制
ER与生长因子GF(Growth Factor)通路串话调节机制。
ER通路乳腺癌细胞生长机制为:雌激素通过与ER作用促进乳腺癌细胞生长。ER分为核受体和膜受体两种,其中核受体是起主要作用的转录因子。核受体的经典作用模式为配体E与核受体ER的配体结合区(1igand binding domain,LBD)结合,促使其与另一分子的ER形成二聚体,ER的DNA结合区(DNA binding domain,DBD)与靶基因上的E反应元件(estrogen response element,ERE)结合,启动转录。ER受体特异性的协同活化因子和协同抑制因子传达一系列的正/负信号调节其转录活性。核受体的非经典作用模式为ER与转录因子Fos和Jun结合,激活靶基因启动子区的AP-1(activating protein-I,AP-1)位点,启动转录。ER膜受体还可以与膜表面周围的多种信号转导相关的生长因子及激酶相作用,快速诱导细胞内激酶(如p42/44MAPK和3-磷酸肌醇激酶)产生,促进肿瘤生长。
选择性雌激素受体调节剂(selective estrogen receptor modulators,SERM s)类ET药物是重要的乳腺癌内分泌治疗药物,其和雌激素竞争性与ER的LBD区结合,形成药物受体复合物,引起ER构象改变,使DBD区不能暴露,无法与靶基因的ERE结合,抑制肿瘤增殖。代表药物为他莫昔芬(TAM),这种通过竞争受体达到抗雌激素作用过程中出现耐药的机制如下:
1.1 ER与表皮生长因子(EGF)及其受体(EGFR)、人表皮生长因子受体2(HER-2)串话调节与内分泌治疗耐药。
表皮生长因子激活的受体酪氨酸激酶传导通路可以配体非依赖方式直接将雌激素受体第ll8位的Ser残基激活。将乳腺癌细胞长期置于缺乏雌激素的环境中,雌激素受体表达明显降低,同时生长因子下游激酶表达活性增强。体外实验发现,TAM可以刺激HER-2在ER阳性乳腺癌细胞株中的表达上调,认为TAM在阻断ER通路的同时可以促进HER-2通路的信号传递,证实了ER同生长因子信号转导途径的交叉作用与内分泌治疗耐药有关[1]。
表皮生长因子受体信号传导主要通过M APK、AKT通路与ER相互作用,在乳腺癌的抗激素耐药中起重要作用并致使抗激素治疗失败。
1.2 核受体共调节蛋白因子,包括共激活因子(nuclear receptor coactivators,NCoAs)和共抑制因子(nuclearreceptor corepressors,NCoRs),与内分泌治疗耐药。
ER依据配体本身差异,可与共调节蛋白相互作用,从而使转录活性增强(共激活因子)或抑制(共抑制因子)。AIB1(amplified in breast cancer 1)是共激活因子家族成员之一,因在半数以上的乳腺癌患者中过表达而得名。体外研究发现,HER-2阳性TAM 抵抗的乳腺癌细胞系MCF-7富集AIBI等共激活因子复合物到靶基因的启动子区,而激素敏感的MCF-7细胞富集的是共抑制因子复合物。在TAM 治疗敏感后继发耐药的乳腺癌患者也观察到这一现象,A IBI可以大大降低TAM 在HER-2过表达的肿瘤中的拮抗作用。具有相对丰富的共激活因子(如A IB 1)肿瘤,特别是同时具有较强HER-2信号转导、可以使A IB 1活化的肿瘤,由于提高TAM 结合的ER拟E样促进转录作用,所以TAM治疗抵抗[2]。
1.3 配对框2基因产物 PAX 2(the paired box 2 gene product)与内分泌治疗耐药。
英国癌症研究学会的研究者Antoni Hurtado等[3]报道了 PAX 2(the paired box 2 gene product)为使ErbB2关闭的开关。当ErbB2处于开启状态时就产生了(TAM)耐药性,而TAM通过蛋白PAX2关闭了乳腺癌基因E rb B-2。临床上观察到,当PAX 2高表达、Her-2低表达,则预后好。
1.4乳腺癌抗雌激素药物耐药性基因1/p130Crk相关底物蛋白(BCAR l/p130Cas )与内分泌治疗耐药
BCAR l/p130Cas 属于参与很多细胞过程的衔接蛋白中的一个小家族。2000年Brinkman等[4]确定了BCAR l 基因是抗雌激素药物耐药细胞表型相关的第一个基因。在最近的研究中,Soni等[5]证实了在TAM耐药的M CF-7细胞存在乳腺癌抗雌激素耐药基因(b reast cancer anti-estrogen resistance-1,BCAR-1))产物过表达。Soni等证实阻断TAM耐药乳腺癌细胞中BCAR-1的活性,可降低EGFR的水平以及减弱EGFR与ERK/AKT之间的信号传导,从而抑制癌细胞的增值和促进凋亡,并且可恢复TAM的活性。显然,在TAM耐药癌细胞模型中,BCAR-1是调节生长因子信号传导的重要因子。van derFlier等检测了937个原发乳腺癌患者提取物中BcARl/pl30cas蛋白的表达水平,比较了该蛋白的表达水平和临床参数之间的关系,发现BCAR1/p l30Cas蛋白高表达的原发乳腺癌患者疾病复发更迅速,总存活时间更短,且对抗雌激素药物耐药的风险更大。
1.5 其他生长因子与内分泌治疗耐药
在乳腺癌细胞中,下面一些生长因子的过表达也是促进TAM治疗耐药的原因。这些生长因子包括PC细胞来源生长因子,也称颗粒蛋白前体抗原(progranulin);血管内皮生长因子,在体内能促进血管生成,在体外有诱导乳腺癌细胞生长活性;角化细胞生长因子(keratinocyte)[6],在TAM治疗敏感的M CF-7细胞中加入角化细胞生长因子能导致耐药,但是使受体沉默后,TAM治疗耐药获得逆转。由此可见,在抗雌激素治疗中,可以通过阻断以上多种生长因子通路途径实现抑制乳腺癌细胞生长。
芳香化酶抑制剂(aromatase inhibitors,AIs)抑制E合成过程中的关键酶芳香化酶,减少E的产生,抑制肿瘤增殖。由于乳腺癌细胞的强大适应性,内分泌治疗会引起异常信号通路激活来导致AI或者抗雌激素的耐药。其中一个重要的猜想是,对雌激素撤退环境的适应与AIs的耐药有关一耐药源于肿瘤细胞ER的雌激素超敏感或非依赖性。为了验证这个假设,不少学者建立了长期雌激素剥夺(1ong-term estrogen deprivation,LTED)乳腺癌细胞并进行研究。这种通过抑制雌激素合成抑制肿瘤细胞增值过程中出现耐药的机制如下:
1.6 ER超敏与内分泌治疗耐药
Santen等报告中,LTED细胞胰岛素样生长因子受体(IGF-1R)和ER的串话调节诱导快速非经典通路ER信号途径激活,导致丝裂原活化蛋白激酶(M APK)和磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)活化,最终使乳腺癌在雌激素高敏感的情况下增殖,即LTED细胞的ER水平是野生型的4倍一7倍,且其增殖所需雌激素量仅为野生型MCF一7细胞的的lg4倍[7]。
Brodies[8]的实验室通过研究LTED乳腺癌细胞发现,其细胞内ER和erbB2含量比野生型高4倍-5倍。Dowsett[9]的实验室中传代的LTED细胞,在雌激素缺乏条件下8周传代后,ER不需雌激素就可发生作用。
而Staka等实验中不利用LTED细胞,而是在雌激素与生长因子共同缺失的培养基环境中培养一种MCF-7X乳腺癌细胞,对这种细胞研究显示,(1)跟目前的MCF-7细胞相比,ER的Ser118磷酸化以及雌激素受体转录活性没有明显的提高,MCF-7X肿瘤细胞ER没有过表达现象,也没有对雌激素超敏。(2)在E和生长因子缺失环境中,MCF-7X乳腺癌细胞没有通过ER与EGFR/HER2或者IGF-IR之间的串话调节通路继续生长,而是主要通过ER与AKT的串话调节实现肿瘤细胞的继续增值[10]。
1.7 抗雌激素药物诱导相关生长因子表达改变引起内分泌治疗耐药
Gee等[11]研究指出在抗雌激素治疗的最初阶段,抗雌激素药物就开始诱导相关基因表达以减弱药物对乳腺癌细胞的生长抑制,最终导致抗雌激素药物耐药。这些基因表达产物有:EGFR/HER2,NFkB,Bag1,14-3-3和络氨酸激酶。另外这些额外表达的基因似乎授予乳腺癌细胞更多恶性潜能,例如表达CD 59的乳腺癌细胞能逃避免疫监视;RhoE、a连环蛋白(a catenin)和 c-Src使乳腺癌细胞更具有侵袭性。这在一定程度上能得出乳腺癌细胞获得性内分泌治疗耐药原理及内分泌治疗耐药后复发乳腺癌恶性程度更高的原因。
2 ER非依赖性内分泌治疗耐药机制(原发性内分泌治疗耐药机制)
2.1 抗雌激素耐药基因(BCAR)的表达与内分泌治疗耐药
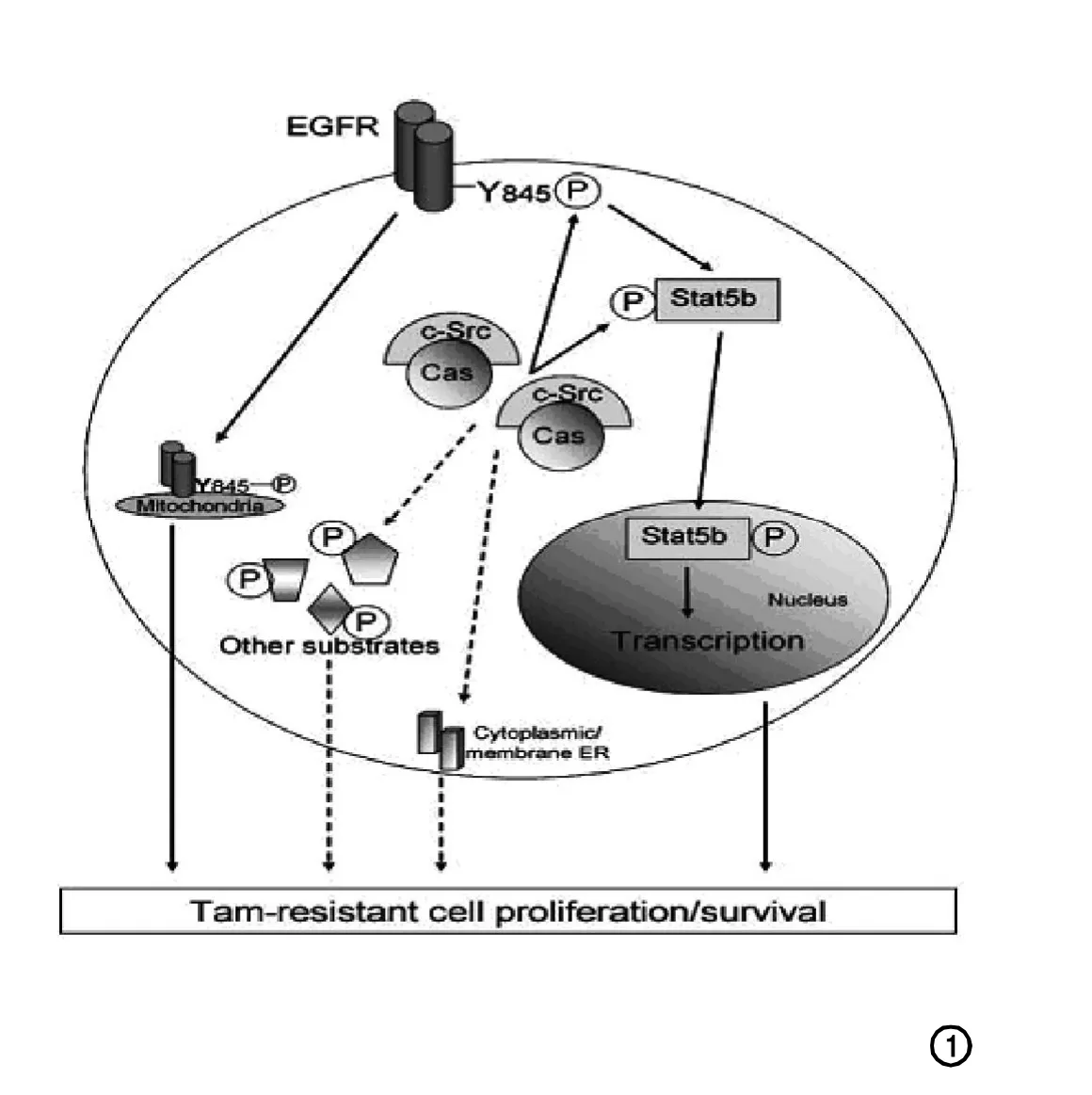
抗雌激素耐药基因的表达使乳腺癌细胞能通过生长因子通路生长繁殖。Dorssers研究组[12]和van Agthoven研究组[13]分别在1993年和1998年指出乳腺癌抗雌激素药物耐药性基因BCAR-1和BCAR-3的表达能使乳腺癌细胞在ER非依赖的环境下生长,大概是通过使生长因子信号通路的效能最大化。2006年Riggins等研究指出BCARl/pl30CAS蛋白在抗雌激素药物耐药机制方面起衔接蛋白作用(如图1)[14]。CAS蛋白通过与c-Src结合,诱导EGFR活化进而导致内分泌治疗耐药细胞生长繁殖。
2.2 其他ER非依赖性内分泌治疗耐药原理
乳腺癌细胞周围内环境通过旁分泌或内分泌方式释放大量生长因子,作用于乳腺癌细胞,并且占据了肿瘤细胞生长的主要通路,这跟临床上观察到的ER的表达与EGFR/HER-2的表达呈负相关的现象相一致[15]。
3 可能影响乳腺癌细胞生长发育引起内分泌治疗耐药的其它机制
3.1锌(Zinc)和锌载体7(Z IP7(HKE 4/SLC 39A 7))与内分泌治疗耐药
Taylor KM等[16]研究表明乳腺癌细胞周围锌(Zinc)浓度高和锌载体7(ZIP7(HKE4/SLC39A7))高表达是导致乳腺癌内分泌治疗耐药的重要机制,通过ZIP7基因沉默或降低Zinc浓度能抑制TAM耐药的M CF-7的继续生长。
3.2 DNA甲基化与内分泌治疗耐药
DNA甲基化情况对基因的表达影响深远,DAN低甲基化可引起DNA表达增加,高甲基化可引起DNA表达沉默。Fan等[17]指出在TAM耐药MCF-7细胞中,DNA的低甲基化可引起EGFR/HER-2及相关蛋白等的基因激活和表达扩增;而DNA的高甲基化与肿瘤抑制基因和肿瘤凋亡基因的失活有一定的相关性。
4 结 语
综上所述,乳腺癌内分泌治疗耐药的机制尚未完全阐明,但ER功能相关的分子信号传导途径及其辅助因子的相互作用、ER基因的突变及相关基因的多态性等都是导致耐药发生的重要因素。针对信号传导途径关键因子的新药的开发可能成为ET耐药的乳腺癌患者最有前景的疗法。随着对耐药的分子机制认识的逐渐深入和药物基因组学的发展,针对受体后调节及基因改变的靶向和基因治疗新药的将为耐药肿瘤的治疗带来新的希望。[18]
1.Massarweh S, Schiff R.Unraveling the mechanisms of endocrine resistance in breast cancer: new therapeutic opportunities.Clin Cancer Res.2007 Apr 1;13(7):1950-4.
2.Osborne CK, Bardou V, Hopp TA, Chamness GC, Hilsenbeck SG,Fuqua SA, Wong J, Al lred DC,Clark GM, Schif f R.Role of the estrogen receptor coactivator AIB1 (SRC-3) and HER-2/neu in tamoxifen resistance in breast cancer.J Nat l Cancer Inst.2003 Mar 5;95(5):353-61.
3.Antoni Hurtado, Kelly A.Holmes, Timothy R.Geistlinger,Iain R.Hutcheson, Robert I.Nicholson, Myles Brown, Jie Jiang, Wil liam J.Howat, Simak Ali, Jason S.Carrol l,Regulation of by oestrogen receptor–PAX2 determines response to tamoxifen,Nature 456, 663-666 (12 November 2008) doi:10.1038/nature07483 Letter.
4.Brinkman A,Van der Flier S,Kok EM,et a1.BCAR l,a human homologue of the adapter protein p130Cas,and antiestrogen resistance in breast cancer cel ls [J]. J Nat l Cancer Inst,2000,92 (2 ):112 -120.
5.Soni S, Lin B-T, August A, Nicholson RI, Kirsch KH.Suppression of tamoxi fen resistance by inhibition of p130Cas/BCAR1 signaling.2008;In Press.
6.Chang HL, Sugimoto Y, Liu S, Ye W, Wang LS, Huang YW, Lin YC.Keratinocyte growth factor(KGF) induces tamoxifen(tam) resistance in human breast cancer MCF-7 cel ls.Anticancer Res.2006 May-Jun;26(3A):1773-84.
7.RJ Santen,RX Song,Z Zhang,et a1.Adaptive hypersensitiy to estrogen:mechanisms and clinical relevance to aromatase inhibitor therapy in breast cancer treatment[J].J Steroid Biochem Mol Bi-0l,2oo5,95:155 -165.
8.A Brodie,D Jelovac,G Sabnis,et a1.Model systems :mechanisms involved in the loss of sensitivity to letrosole[J].J Steroid Biochem Mol Biol,2oo5,95:41-48.
9.LAMartin,I Farmer,SR Johnston,eta1.Enhanced estrogen receptor(ER)alpha,ERBB2,and MAPK signal transducfion pathways operate during the adaptation of MCF一7 cel ls to long term estrogen deprivation[J].J Biol Chem,2003,278:30458-30468.
10.Staka CM, Nicholson RI, Gee JM.Acquired resistance to oestrogen deprivation: role for growth factor signal ling kinases/oestrogen receptor cross-talk revealed in newMCF-7× model.Endocr Relat Cancer.2005 Jul;12(Suppl 1):S85-97.
11.Gee JM, Shaw VE, Hiscox SE, McClel land RA, Rushmere NK,Nicholson RI.Deciphering antihormone-induced compensatory mechanisms in breast cancer and their therapeutic implications.Endocr Relat Cancer.2006 Dec;13(Suppl 1):S77-88.
12.Dorssers LC, van Agthoven T, Dekker A, van Agthoven TL,Kok EM.Induction of antiestrogen resistance in human breast cancer cel ls by random insertional mutagenesis using defective retroviruses: identification of bcar-1,a common integration site.Mol Endocrinol.1993 Jul;7(7):870-8.
13.van Agthoven T, van Agthoven TL, Dekker A, van der Spek PJ, Vreede L, Dorssers LC.Identification of BCAR3 by a random search for genes involved in antiestrogen resistance of human breast cancer cel ls.Embo J.1998 May 15;17(10):2799-808.
14.Riggins RB, Thomas KS, Ta HQ,Wen J, Davis RJ, Schuh NR,Donelan SS, Owen KA, Gibson MA,ShupnikMA, Silva CM,Parsons SJ, Clarke R, Bouton AH.Physical and functional interactions between cas and c-src induce tamoxi fen resistance of breast cancer cells through pathways involving epidermal growth factor receptor and signal transducer and activator of transcription 5b.Cancer Res.2006 Jul 15;66(14):7007-15.
15.Hutcheson IR, Knowlden JM, Hiscox SE, Barrow D, Gee JM,Robertson JF, El lis IO, Nicholson RI.Heregulin beta1 drives gefitinib-resistant growth and invasion in tamoxifenresistantMCF-7 breast cancer cel ls.Breast Cancer Res.2007;9(4):R50.
16.Taylor KM, Vichova P, Jordan N, Hiscox S, Hendley R,Nicholson RI.ZIP7-mediated intracel lular zinc transport cont ributes to aber rant growth factor signal ing in antihormone-resistant breast cancer Cel ls.Endocrinology.2008 Oct;149(10):4912-20.Epub 2008 Jun 26.
17.Fan M, Yan PS, Hartman-Frey C, Chen L, Paik H, Oyer SL,Salisbury JD, Cheng AS, Li L, Abbosh PH, Huang TH, Nephew KP.Diverse gene expression and DNA methylation profiles correlate with dif ferential adaptation of breast cancer cel ls to the antiestrogens tamoxifen and fulvestrant.Cancer Res.2006 Dec 15;66(24):11954-66.
18.韦伟 叶静 刘巧刿等 乳腺正常、癌周和癌组织中ER mRNA表达一致性及其临床意义的探讨 罕少疾病杂志[J]2008 15(6)
R737.9
D
book=46,ebook=57
2009-10-20
