胃癌组织中p16基因甲基化水平以及mRNA表达的关系
2010-06-07朱新江
朱新江* 张 凯 秦 伟 冯 禄
胃癌是全世界最常见的恶性肿瘤之一,在我国胃癌病死率为25.2/10万(男性32.8/10万,女性17.0/10万),占全部恶性肿瘤死亡的23.2%(男性是女性的1.9倍),严重威胁人民群众的生命健康。近几年,表遗传学改变的研究取得了突飞猛进的进展,成为胃癌临床基础研究的一个前沿阵地。p16基因是已经确认的最重要的抑癌基因之一,在胃癌细胞凋亡过程中起着重要作用[1-3]。
1 材料与方法
1.1 一般资料

表1 p16基因和GAPDH的RT- PCR引物序列及PCR条件

表2 p16基因甲基化和非甲基化引物序列及PCR条件
选择2005年1月至2008年1月抚顺市中心医院普外科切除的胃癌患者50例,男44例,女6例,年龄40~74 岁,平均(58±9.76)岁。手术取下的新鲜标本立即浸入液氮中后置于-70℃冰箱保存。 Wizard DNA cleap up 纯化试剂盒(美国Promega公司),亚硫酸氢钠(美国Sigma公司),SYBR GreenI 实时定量PCR逆转录试剂盒(日本TaKaRa公司),TRIzol(美国Invitrogen公司),Taq酶和dNTP(日本TaKaRa公司)引物(北京三博远志生物技术有限公司)。
1.2 实验方法
1.2.1 RT-PCR分析胃腺癌标本中p16基因MRNA的表达
用TRIzol 试剂一步法分别提取胃癌组织总RNA(按说明书进行)。按照反转录试剂盒说明将其反转录成cDNA第一链。PCR反应条件:首先进行预变性,时间为4min,预变性温度为93℃。预变性之后进行35个循环:温度和时间分别为 92℃ 30s、51℃ 30s,71℃ 45s,最后延伸10min温度为72℃。用琼脂糖凝胶上电泳分离PCR产物,GB染色,利用凝胶成像分析系统检测PCR产物吸光度值,将各基因与GAPDH吸光度比值作为其mRNA水平的相对值,mRNA表达水平取其平均值进行统计分析。
1.2.2 甲基化特异性PCR检测p16基因启动子区DNA甲基化
首先用酚-氯仿分别提取胃癌组织中基因组DNA,并用紫外分光光度仪进行定性、定量。亚硫酸氢钠修饰DNA后,纯化,洗涤并离心基因组DNA。利用基因组DNA进行PCR反应,条件如下:95℃12 min后,95℃变性30s,各种基因不同退火温度退火45s,71℃延伸30s,34个循环,74℃再延伸7min,琼脂糖凝胶电泳,EB染色。结果经Alpha Image 2000自动成像仪成像采集数据,分析电泳结果。
1.3 结果判定
基因组DNA经过MSP扩增后进行琼脂糖凝胶电泳,如果没有出现甲基化条带而出现非甲基化条带,则该标本p16基因启动子区CpG岛发生非甲基化;如果没有出现非甲基化条带而出现甲基化条带,则该标本p16基因启动子区CpG岛发生甲基化;甲基化条带和非甲基化条带同时出现,则该标本p16基因启动子区CpG岛发生半甲基化(属于甲基化)。
1.4 统计学分析
用SPSS13.0软件分析,mRNA表达水平定量测定计量资料以(±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 MSP结果
见图1。
MS-PCR检测胃癌中p16基因甲基化状态,M=206bp,U=206bp。M:甲基化:U:未甲基化:Pos:阳性对照。Neg:阴性对照。DW:蒸馏水对照;Blank:标本1,2为甲基化;标本3,4为非甲基化。
2.2 RT-PCR结果
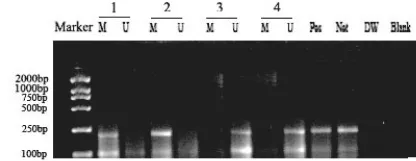
图1 胃癌组织p16基因甲基化PCR扩增产物电泳分析图
50例胃腺癌中甲基化组p16基因mRNA表达量为(0.12±0.05),非甲基化组mRNA表达量为(0.77±0.13),甲基化组p16基因mRNA表达量明显低于非甲基化组,两组比较差异有统计学意义,见表1、表2。
3 讨 论
生物基因组储存着遗传学和表遗传学两种信息,遗传学的信息决定着生物体细胞基因型;而表遗传学是指不涉及DNA序列改变的,可以通过细胞分裂进行传递的信息,它参与基因表达调控,这种表观遗传修饰对于肿瘤的发生具有重大意义。DNA甲基化和组蛋白修饰、染色质重塑等是表观遗传修饰的主要方式。其中DNA 甲基化是导致肿瘤最常见的表遗传学事件,因而研究甲基化与肿瘤的关系成为目前肿瘤分子生物学研究的热点之一[4]。
p16基因又称多肿瘤抑制基因(multiple tumorsuppressor,MTS)被认为是最经典的肿瘤抑制基因。国内外多项科研[5,6]证实,p16基因甲基化与多种消化系统肿瘤特别是胃癌的发生发展有着密切的关系,他们的研究分为两类:一类应用甲基化敏感性限制性内切酶方法或MSP等方法研究胃癌细胞株或胃癌组织p16基因启动子区CpG岛发现其甲基化率为30%~40%,且发生胃癌组织p16基因启动子区CpG岛甲基化的样本多不表达p16mRNA及p16 蛋白;另外一类研究体外应用去甲基化剂5-deoxy-azacytidine对胃癌细胞处理后,可使胃癌细胞p16基因启动子区CpG岛异常甲基化而封闭的基因重新表达。上述的各项研究结果均有力的证明了p16基因CpG岛甲基化可以导致p16mRNA及p16 蛋白表达缺失,去甲基化剂可恢复p16mRNA及p16 蛋白的表达证实该基因的甲基化是其失活的重要原因。
本实验通过测定胃腺癌组织中甲基化水平及mRNA表达的关系再次证实导致p16基因沉默的主要原因为DNA甲基化,于国内外的主流研究达成共识。p16基因启动子区CpG岛异常甲基化导致p16基因沉默还可能在大肠癌,食管癌中有类似结果。胃癌在我国恶性肿瘤的病死率居于首位,主要原因在于50%的胃癌患者确诊时已属晚期,表遗传学研究对胃癌的早期筛查及判断癌细胞的转移有着重要的意义,同时对于晚期胃癌目前的手术+化疗的模式已无法从根本上提高晚期胃癌的五年生存率。而表遗传学治疗包括去甲基化及乙酰化治疗刚刚起步,给肿瘤的治疗带来新的希望,但表遗传学治疗药物在实体瘤应用的某些机制尚未明确,仍需进一步研究。目前没有一种基因药物能有效抑制肿瘤,随着对表遗传学改变的认识,对表遗传学药物的研究将为肿瘤的治疗开辟新的领域。
[1] Hong SH,Kim HG,Chung WB,et al.DNA Hypermethylation of Tumor-Related Genes in Gastric Carcinoma[J] Korean Med Sci,2005,20(2):236-241.
[2] Jones PA,Laird PW. Cancer epigenetics comes of age[J] .Net Genet,1999,21(4):163-167.
[3] Robertson KD,Jones PA,Balin SB,et al. DNA methylation: pastpresent and future directions[J] . Carcinogenesis,2000,21(3):461-467.
[4] Kondo Y,Shen LL.Critical Role of Histone Methylation in Tumor SuppressorGene Silencing in Colorectal Cancer[J] .Mol Cell Biol,2003,23(1):206-215.
[5] Murai M,Toyota M,Suzuki H,et al.Aberrant Methylation and Silencing of the BNIP3 Gene in Colorectal and Gastric Cancer[J] . Clin Cancer Res,2005,11(3):1021-1027.
[6] Louie MC,Revenko AS,Zou JX,et al. Direct control of cell cycle gene expression by proto-oncogene product ACTR, and its autoregulation underlies its transforming activity[J] . Mol Cell Biol,2006,26(10):3810-3823.
