HLA-G在子痫前期患者与正常妊娠胎盘中的差异表达
2010-06-06王小红王军青王志君潘小红
王小红,王军青,王志君,潘小红
子痫前期严重危害着孕产妇及围产儿的健康,发病机理至今仍不明。其发病机制一直是产科研究的重要课题,母胎免疫耐受是近年来研究的热点之一,直接暴露于母体血窦的胎盘滋养细胞表面的人类白细胞抗原(human leukocyte antigen,HLA)G分子在母胎局部免疫调控机制中起着极为重要的作用。为了进一步阐明 HLA-G在母胎免疫耐受中的作用机制,本文研究了正常与子痫前期患者胎盘组织中 HLA-G的表达,旨在揭示 HLA-G表达与子痫前期的发病关系,并为临床筛查、预防及治疗子痫前期提供实验依据。
1 资料与方法
1.1 研究对象 选取 2008年 1月至 2009年 1月我院分娩的 24例子痫前期患者胎盘组织为观察组,轻度子痫前期 12例,重度子痫前期 12例,孕妇平均年龄(29.5±2.8)岁,平均孕周(37.6±1.8)周,同期分娩的正常妊娠妇女 24例胎盘组织为对照组,平均年龄(27.3±3.2)岁,平均孕周(39.3±1.1)周。两组行均衡性检验,差异无统计学意义(P>0.05),子痫前期诊断标准参照《妇产科学》[1]。
1.2 标本采集 胎盘娩出后 5min内采集近脐根部母体面胎盘组织(避开钙化区及出血点)大小约1.0 cm×1.0 cm×0.3 cm的组织,约 100 mg,用生理盐水漂洗去除血液,干纱布吸除水分,装入冷冻管后迅速入液氮保存,次日置 -80℃冰箱备用。
1.3 方法
1.3.1 RT-PCR(逆转录-聚合酶链技术) 按 Trizol(美国 Invitrogen公司)说明书提取胎盘组织中总的RNA,采用 SuperScriptTMOne-Step RT-PCRwith Platinum·Taq试剂盒(Invitrogen公司),紫外分光光度计测定 RNA浓度后,加入 5μg模版 mRNA进行绒毛外细胞滋养细胞 mRNA的逆转录和第一轮扩增。其中,上游引物设计在外显子 1,下游引物设计在外显子 5和 6的连接处,扩增 HLA-G mRNA。采用Platinum·Taq DNA Polymerase High Fidelity试剂盒(Invitrogen公司)进行第二轮 PCR。
1.3.2 Western blot(免疫印迹技术) 应用常规蛋白提纯方法提取细胞总蛋白,分离蛋白质,经电转印将蛋白质转移到 polyvinylidene difluoride(PVDF)膜上,用 5%脱脂奶粉封闭。加入稀释度为 1∶500羊抗小鼠和羊抗兔 IgG过夜,室温孵育 1 h。洗涤后,PVDF膜用应用 SuperSignal化学发光试剂盒(美国Pierce公司)进行化学增强发光,曝光于 Kodak X胶片 15 s,显、定影,多次洗涤后,扫描结果,用 Leica图象分析仪测定免疫印记条带密度 A值。
1.4 统计学处理 全部数据统计工作用 SPSS11.0统计软件完成,进行单因素方差分析,实验结果用±s表示,P<0.05认为差异有统计学意义。
2 结 果
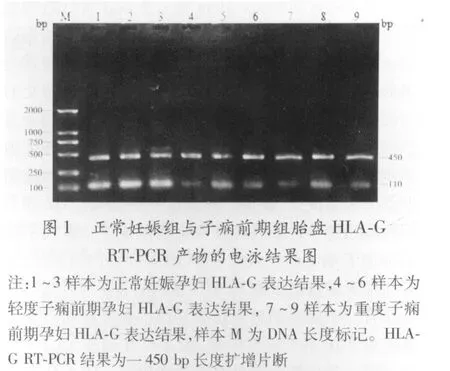
2.1 HLA-G在胎盘组织中的基因表达结果 半定量分析采用数字图像分析系统,RT-PCR显示采用本实验中所设计的引物,在子痫前期孕妇与正常妊娠胎盘组织中均可扩增到一片段长度为 450 bp长度的扩增片段,结果显示 HLA-G在子痫前期孕妇胎盘与正常妊娠孕妇胎盘组织中均有表达,轻度子痫前期:0.492±0.091,重度子痫前期:0.454±0.136,均明显低于正常妊娠组:0.711±0.129(P<0.01),轻、重度子痫前期之间比较差异无显著性(P>0.05)。见图 1。
2.2 HLA-G在胎盘组织中的蛋白表达结果 Western blot显示HLA-G在子痫前期胎盘与正常妊娠胎盘组织中均有蛋白表达,子痫前期患者胎盘组织中HLA-G蛋白印迹条带灰度值,轻度子痫前期:0.487±0.086,重度子痫前期:0.431±0.056,均明显低于正常妊娠组:0.612±0.103(P<0.01),轻、重度子痫前期之间比较差异无显著性(P>0.05),见图 2。

3 讨 论
3.1 HLA-G与子痫前期的关系 胚胎是一种半同种异体移植物,妊娠成功有赖于胎儿-母体间的免疫平衡,而这种平衡一旦失调,即可能引发排斥反应,导致病理妊娠,子痫前期一直被认为是由于子宫胎盘灌注低下引起,可能与母体对半异体基因的胎儿发生异常的免疫应答有关[2]。同时,子痫前期患者在胎儿分娩后即自然好转的规律也提示疾病的根源可能在于母胎间免疫应答变化。有学者认为人类白细胞抗原 G、E和 F很可能在妊娠母体接受半同种移植的胎儿中具有功能协同作用,甚至相互置换,三者中尤以 HLAG与妊娠密切相关[3]。另有学者认为 HLA-G在调节母胎免疫耐受方面具有关键性作用[4-5]。子痫前期生理性血管重铸存在显著的障碍,滋养细胞侵蚀仅达子宫螺旋动脉蜕膜段,其可能的原因是 HLA-G表达缺陷的滋养细胞易受母体免疫系统攻击不能有效侵入母体螺旋动脉完成血管重铸过程。HLA-G分子属于非经典的主要组织相容性复合体(MHC)I类分子,其编码基因位于人类 6号染色体紧邻编码经典人类白细胞抗原 A附近,具有有限的分子多态性、选择性组织分布和调控母体免疫细胞的功能等特点。由于HLA-G分子的特性及功能,人们推测它可能与子痫前期的发病密切相关。Hara等[6]发现正常妊娠绒毛外细胞滋养细胞(extravillous trophoblast,EVT)均表达HLA-G蛋白,而子痫前期滋养细胞 HLA-G的表达呈孤岛状减少或缺失。Goldman等[7]应用原位杂交的方法检测 HLA-GmRNA在正常妊娠和子痫前期胎盘的表达,发现正常妊娠 HLA-G mRNA在绒毛外细胞滋养细胞的表达沿侵入途径逐渐升高,而在子痫前期胎盘的表达极少,缺少上述表达升高模式。Yie等[8]研究应用特异性酶联免疫吸附法测定了正常和子痫前期患者胎盘组织及血液中 HLA-G蛋白的表达,发现血液及胎盘组织中 HLA-G蛋白的表达与发病具有相关性。子痫前期患者蜕膜局部的免疫微循环环境存在着 Th1/Th2比率失衡,HLA-G在调节 Th1/Th2细胞因子的平衡方面具有重要作用[9]。HLA-G介导的细胞因子失衡可能是子痫前期发病的重要因素[10]。以上研究表明 HLA-G可能与子痫前期的发病过程有着密切关系。但是还有研究对此提出了不同观点,他们应用免疫组织化学方法分析了正常胎盘组织与重度子痫前期患者胎盘组织中 HLA-G的表达,发现 HLA-G的减少不仅存在于子痫前期胎盘组织,正常胎盘细胞滋养层也存在 HLA-G减少的区域,从而提出 HLA-G生成降低并不是子痫前期发病的原因,而是由于滋养层细胞坏死减少所致[11-12]。对这些文献分析发现两种分歧的观点主要是由于实验中标本的采集方法及实验中的检测方法造成的,因此,为了进一步阐明 HLA-G分子与子痫前期的关系,本实验我们采用 RT-PCR法结合 Western blot技术较系统研究了HLA-G在子痫前期孕妇与正常妊娠孕妇胎盘组织中在基因与蛋白表达水平,更为精确地研究了HLA-G的表达量。
3.2 HLA-G在子痫前期患者胎盘中的表达 Western blot免疫印迹方法是一种对蛋白表达进行较精确定量的方法,本研究结果显示 HLA-G在基因与蛋白水平上均有明显降低,尤其在蛋白表达水平 HLA-G降低更为明显,表明子痫前期胎盘组织 HLA-G表达水平降低确实与子痫前期发生有关,轻重度子痫前期的表达水平无差异,故 HLA-G尚不能作为子痫前期病情严重程度的筛选指标。HLA-G蛋白在子痫前期胎盘组织内表达水平的降低达一定程度后可能不足以让母体子宫内的免疫细胞产生免疫耐受,致使母体子宫对胎盘滋养细胞产生了免疫攻击,一方面致使胎盘滋养细胞不能向子宫脱膜深层浸润,产生浅着床,导致胎盘供血不足,影响胎儿的生长发育,同时母-胎界面不断的免疫炎症反应产生大量持续不断的炎症因子,导致母体全身广泛的动脉收缩与痉挛,造成母体动脉血压急剧升高,导致子痫前期的发生。文献中产生的不同观点可能与胎盘组织 HLA-G表达降低的程度有关,因为只有降低到一定程度后,才能让母体子宫不产生免疫耐受。至于 HLA-G对滋养细胞功能尤其是调控滋养细胞对子宫蜕膜组织的黏附、浸润影响方面尚待深入、系统研究,HLA-G表达水平可能作为临床筛查子痫前期的指标。
[1]乐 杰.妇产科学[M].6版.北京:人民卫生出版社,2004:105.
[2]Clements CS,Kjer-Nielsen L,Kostenko L,et al.Crystal structure of HLA-G:a nonclassical MHC class Imolecule expressed at the fetal-matemal interface[J].Proc Natl Acad Sci,2005,102(9):3360-3365.
[3]HviidTV.Non-c lassical human leukocyte antigen(HLA)tissue types-from implantation to trasplantation[J].Ugeskr Laeger,2006,168(5):461-466.
[4]Zhang L,Wang Y,Liao AH.Quantitative abnormalities of fetal trophoblast cells inmaternalcirculation in preec lampsia[J].Prenat Diagn,2008,28(12):1160-1166.
[5]Iversen AC,Nyugen OT,Tommerdal LF,et al.The HLA-G 14 bp gene polymorphism and decidual HLA-G 14bp gene expression in pre-eclamptic and normal pregnancies[J].JReprod Immunol,2008,78(2):158-165.
[6]Hara N,Fujii T,Yamashita T.A ltered expression of human leukocyte antigen G(HLA-G)on extravillous trophoblasts in preeclampsia:immunohistological demonstrationwith anti-HLA-G specific antibody“87G” and anti-cytokeratin antibody“CAM 5.2”[J].Am JReprod Immunol,1996,36(6):349-358.
[7]Goldman-Wohl DS,Ariel I,Greenfield C,et al.Lack of human leukocyte antigen-G expression in extravillous trophoblasts is associated with pre-eclampsia[J].Mol Hum Reprod,2000,6(1):88-95.
[8]Yie SM,Li LH,Li YM,et al.HLA-G protein concentrations in maternal serum and placental tissue are decreased in preec lampsia[J].Am JObstet Gynecol,2004,91(2):525-529.
[9]Kanai T,Fujii T,Unno N,etal.Human leukocyte antigen-G-expressing cells differently modulate the release of cytokines from mononuc lear cells present in the decidua versus peripheral blood[J].Am JReprod Immunol,2001,45(2):94-99.
[10]Tan CY,Ho JF,Chong YS,etal.Paternalcontribution ofHLA-G 0106 significantly increases risk for pre-ec lampsia in multigravid pregnancies[J].Mol Hum Reprod,2008,14(5):317-324
[11]Sageshima N,IshitaniA,Omura M,et al.Necrotic feature of the trophoblasts lacking HLA-G expression in normal and pre-eclamptic placentas[J].Am JReprod Immunol,2003,49(3):174-182.
[12]Datema G,Van Meir CA,Kanhai HH,et al.Pre-term birth and severe pre-eclampsia are not associated with altered expression of HLA on human trophoblasts[J].Am JReprod Immunol,2003,49(4):193-201.
