DBD等离子体中OH自由基数值模拟研究
2010-06-05徐勇,王丽娜,刘忠伟,朱爱民,赵国利
徐 勇, 王 丽 娜, 刘 忠 伟, 朱 爱 民, 赵 国 利
(大连理工大学 等离子体物理化学实验室,辽宁 大连 116024)
0 引 言
介质阻挡放电(DBD)是一种有绝缘介质插入放电空间的气体放电形式.DBD是产生常压低温等离子体的主要途径之一,能够在大气压下产生大体积、高能量密度的低温等离子体[1~4].DBD已经被广泛地用在处理聚合物和污染物的脱除上,OH自由基的氧化性很强,在上述过程中起到了重要的作用[5].综合文献来看,OH自由基主要采用含水体系产生[6].Sun等[7]在水溶液中通过针-板式脉冲火花放电,利用发射光谱技术研究了OH自由基在空间和时间上的分布情况.Ershov等[8]通过激光诱导荧光监测脉冲放电时OH自由基的浓度,并且建立了初步的数学模型,定性地模拟了OH自由基产生的动力学过程.Sankaranarayanan等[9]通过激光诱导荧光测量了介质阻挡放电产生的OH自由基,并解释了其产生的机理.但是,目前对于DBD等离子体中OH自由基的研究主要通过实验手段,缺少对于OH自由基的动力学产生过程的模拟研究.
因此,本文建立数学模型模拟介质阻挡放电时,H2O/He体系中OH自由基的产生和动力学的发生过程,并且进行系统的定量模拟.讨论H2O/He体系中OH(X2Π)、OH(A2∑+)和电子的浓度随水含量的变化,以及添加氧气后OH(X2Π)、OH(A2∑+)的浓度随氧气含量的变化.通过与实验结果进行对比,力图揭示影响OH自由基生成和损耗的主要物理化学反应过程的机理.
1 理论模型和数值模拟
选取一个零维模型,在这个模型中包括电离、附着、复合、脱附、激发等反应,忽略了扩散和漂移等空间过程[10、11].计算各种成分粒子数密度的变化,特别是所关心的 OH(X2Π)、OH(A2∑+)以及电子的浓度随时间的演变.
1.1 等离子体化学反应
为了说明OH等活性物种产生的动力学过程,表1给出了H2O/He体系中所包含的主要反应.表中含有f(E/N)的速率常数为针对本模型所模拟的具体条件计算得到的,具体计算过程见下文,其他反应速率系数由文献查得[6,12~18].单体反应的速率常数单位为s-1,两体碰撞反应的速率常数单位为cm3/(molecules·s),三体碰撞反应的速率常数单位为cm6/(molecules2·s2).

表1 模型中所考虑的主要反应Tab.1 The main reactions in the model
1.2 模拟模型
本模型中速率方程形式如下:

式中:ni和n j为物种i消耗反应中i和j物种的浓度;np和n q为物种i生成反应中p和q物种的浓度;kij和k pq分别为物种i消耗和生成反应的速率常数.
对所考虑反应体系中基元反应涉及到的每一物种均列一个相应的速率方程式,归结为相关物种浓度关联耦合的一阶常微分方程组初值问题,研究各物种浓度在时间上的演化规律,由此可以建立化学反应动力学微分方程组,采用特雷纳法对其求解[19].
1.3 计算流程图
理论模型的计算流程如图1所示.
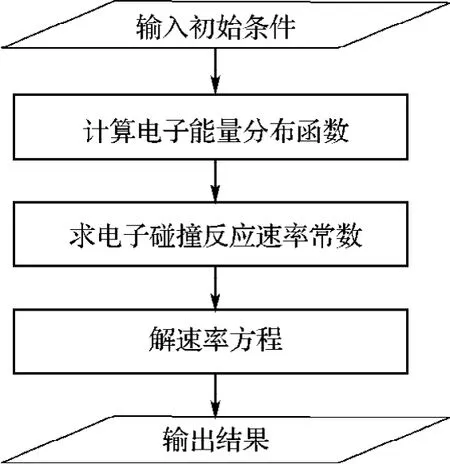
图1 计算流程图Fig.1 Flow chart for calculation
2 模拟结果分析讨论
2.1 初始条件和参数选取
所模拟的初始气体条件如下:H2O/He体系中,气压1.013×105Pa(0.48%H2O+其余He).放电峰-峰电压9.2 k V,放电频率70 k Hz,放电间隙8 mm,E/N=2.3×10-16V·cm2(由放电电压和放电间隙计算得到).为了简化计算,在介质阻挡放电中,每半个周期中的微放电过程近似为一个较宽的脉冲.
2.1.1 电子能量分布函数 在稳定电场作用下,由于电子的碰撞伙伴是分子,其质量比me/M<10-4,忽略了电子与分子的弹性碰撞,超弹性碰撞也不做考虑,电子的Boltzmann方程可表示为[20、21]

归一化条件

式中:E是电场强度;u是电子能量;f是电子能量分布函数;N是粒子数总密度;Msj是物种s的数密度百分比;Qsj是物种s与电子碰撞被激发到激发态j的非弹性碰撞截面;usj是非弹性碰撞的能量损失.方程第1项表示电场对电子的作用项,第2项表示电子与其他粒子的非弹性碰撞.
将Boltzmann方程离散变量构成一差分方程组写成含未知数的线性代数方程组,得到的是一个三对角形方程组,用追赶法[22]对其进行求解.用FORTRAN语言编写程序,得到电子能量分布函数.H2O/He体系的电子能量分布函数如图2所示.OH(X2Π)的浓度才开始减小.虽然由反应

得到由于电子浓度减小,电子直接碰撞解离得到的OH(X2Π)的浓度会下降,但因为有如下反应:OH(A2∑+)→OH(X2Π)+hν,OH(A2∑+)+M→OH(X2Π)+M(M=He、H2O、O2等)
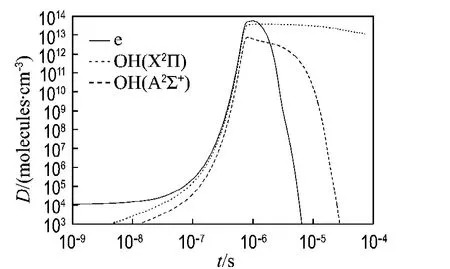
图3 单脉冲OH(X2Π)、OH(A 2∑+)自由基和电子的浓度随时间的变化Fig.3 Density evolution of OH(X2Π),OH(A2∑+)and electron with time in a pulse
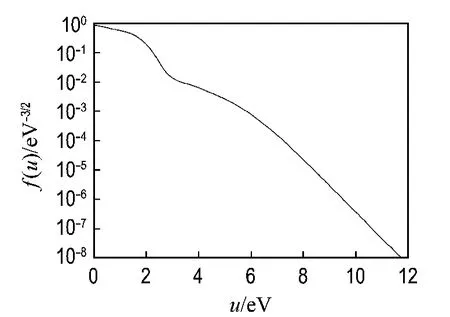
图2 H 2 O/He体系的电子能量分布函数Fig.2 Electron energy distribution function of H 2 O/He
2.1.2 速率常数的计算 把得到的电子能量分布函数代入下式:
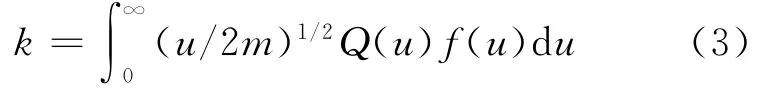
可以得到所需要的电子碰撞反应速率常数.式中k为反应的速率常数,Q为反应的碰撞截面,f(u)为电子能量分布函数.计算中的截面数据来自文献[23~25].
2.2 结果与讨论
2.2.1 H2O/He体系中OH自由基浓度随时间的变化 图3描述了在H2O/He体系中OH(X2Π)、OH(A2∑+)和电子的浓度D随时间的变化,三者的浓度都随时间先增大后减小,OH(X2Π)的最大浓度为3.36×1013molecules·cm-3,OH(A2∑+)的最大浓度为7.59×1012molecules·cm-3,电子的最大浓度为6.02×1013molecules·cm-3.从图中可以看出,放电脉冲结束,电子浓度减小之后,随之OH(A2∑+)浓度开始减小,因为OH(A2∑+)主要由反应

而产生.电子浓度减小,必然引起OH(A2∑+)浓度减小.但此时OH(X2Π)的浓度仍在增加,直到OH(A2∑+)的 浓 度 下 降 到 一 定 值,这 时
所以,OH(X2Π)的浓度仍在增大,直到OH(A2∑+)的 浓 度 下 降 到 一 定 值,这 时OH(X2Π)的浓度才开始减小.
图 4 模 拟 了 几 个 脉 冲 下,OH(X2Π)、OH(A2∑+)和电子的浓度随时间的变化.可见在前几个放电脉冲,活性物种随时间的变化是不稳定的,各个物种的浓度是在增大的.因为在前一个脉冲产生的活性物种,在下一个脉冲开始时仍然存在,并且会影响下一个脉冲时物种的浓度变化,所以在前几个脉冲活性物种不稳定,浓度增大.但在随后的几个脉冲中,活性物种达到一个平衡,随时间的变化基本稳定.由图4可以得到,在模拟条件下,OH(X2Π)的浓度达到稳定后的时间平均 值 为 8.32 × 1013molecules · cm-3,OH(A2∑+)的浓度达到稳定后的时间平均值为9.40×1011molecules·cm-3,e的浓度达到稳定后的时间平均值为2.56×1012molecules·cm-3.在考察OH(X2Π)、OH(A2∑+)自由基的浓度随O2和 H2O含量的变化时,均取在不同组分时OH(X2Π)、OH(A2∑+)浓度的时间平均值.
2.2.2 H2O/He体系中OH自由基浓度随水含量的变化 从 图 5 可以 看 出,OH(X2Π)和OH(A2∑+)的浓度分别随水含量的增加先增大后减小.引起上述变化的主要原因分析如下:

图4 多个脉冲OH(X2Π)、OH(A2∑+)自由基和电子的浓度随时间的变化Fig.4 Density evolution of OH(X2Π),OH(A2∑+)and electron with time in pluses
一方面高能电子与H2O的直接碰撞生成OH(X2Π) 和 OH(A2∑+),e + H2O →OH(A2∑+)+H +e,e+H2O→OH(X2Π)+H+e,OH(A2∑+)→OH(X2Π)+hν
水 含 量 的 增 多 则 必 然 引 起 OH(X2Π)、OH(A2∑+)的增多,并且生成的OH(A2∑+)在很 短 的 时 间 回 到 OH(X2Π),从 而 也 使 得OH(X2Π)增多.
另一方面,高能电子与H2O的直接碰撞导致O(1D)增多,如图5所示,
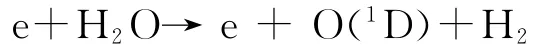
在水蒸气含量较多的条件下,O(1D)与H2O继续反应生成大量的OH(X2Π).

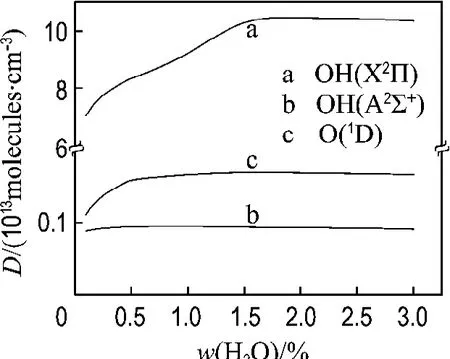
图5 OH(X2Π)、OH(A 2∑+)等活性物种浓度随水含量的变化曲线Fig.5 Density evolution of OH(X2Π),OH(A2∑+)and other radicals as a function of water concentration
但是介质阻挡放电是由无数的随意分布的丝状微放电组成的,通过对放电电场的测定得到,H2O含量的增加,使微放电的数目减少,所以在H2O 含 量 为 2% 左 右 时,OH(X2Π)、OH(A2∑+)、O(1D)的浓度都略有下降.
2.2.3 H2O/He体系中OH浓度随加入O2含量的变化 在H2O/He体系中,加入氧气,使氧气含量在0~2%变化,从图6中可看到OH(X2Π)、OH(A2∑+)的浓度随氧气含量的增大先增大后减小.
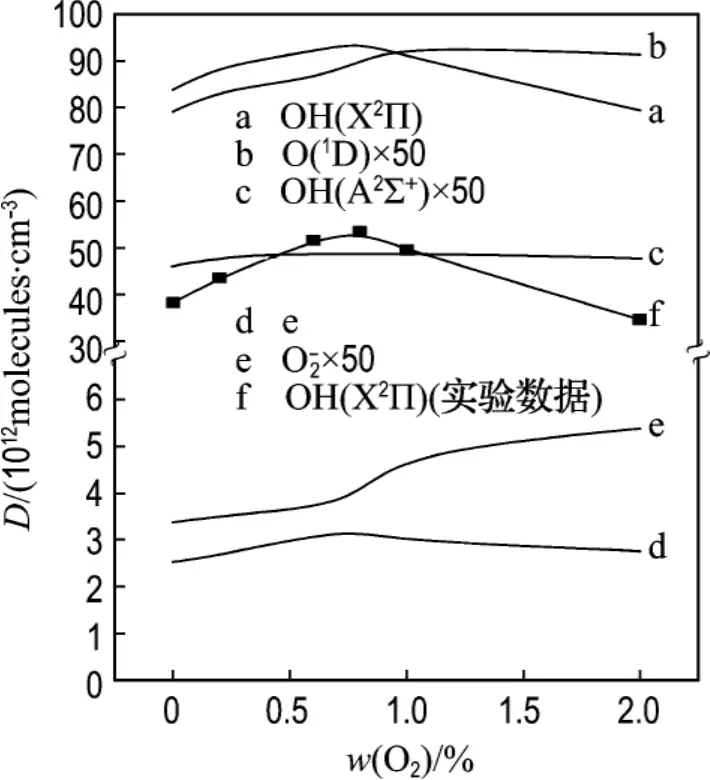
图6 OH(X2Π)、OH(A 2∑+)等活性物种浓度随氧气含量的变化曲线Fig.6 Density evolution of OH(X2Π),OH(A2∑+)and other radicals as a function of oxygen concentration
浓度变化的主要原因分析如下:
加入氧气后,电子与O2分子发生碰撞,虽然与水碰撞的电子变少,由反应

得到的OH(X2Π)减少了.但在加入氧气时,电子与氧气碰撞,发生以下反应生成基态O原子和亚稳态的O(1D),

氧气增加时,电子直接碰撞会产生大量的O原子和O(1D)(如图5所示),放电产生的O原子还会进一步和O2反应生成O3分子,同时O(1D)和H2O会进一步发生反应,具体如下:
O+O2→O3,O(1D)+H2O→2 OH(X2Π)所以OH(X2Π)的浓度有所增加.
然而由于氧气是电负性气体,具有较大的电子附着截面,大量的自由电子被O2分子吸附而形成O-2,随着氧气含量的增加自由电子密度减小,使得电子与水直接碰撞产生的OH(X2Π)的浓度减小,同时添加氧气后放电产生的大量O原子和O3分子与OH(X2Π)发生反应,从而消耗了大量的OH(X2Π),因此继续添加氧气后OH(X2Π)的浓度又会减小.因为反应

所以,随着氧气含量的增加,OH(A2∑+)的浓度也出现了先增大后减小的趋势.
将OH(X2Π)随氧气含量变化的模拟计算值与实验值进行了对比,发现二者的趋势基本吻合,可见计算的正确性.由此也可以证明对于OH(X2Π)的产生机理和对OH(X2Π)随氧气含量的变化趋势的解释是正确的.
3 结 论
通过数值模拟得到了介质阻挡放电时,H2O/He体系中电子、OH(X2Π)和OH(A2∑+)的浓度随时间的演变情况,发现OH(X2Π)、OH(A2∑+)的浓度随H2O含量的增加先增大后减小.而当在体系中加入氧气时,OH(X2Π)、OH(A2∑+)的浓度随氧气含量的增加同样呈现先增大后减小的趋势.
[1]ELLASSON B,KOGELSCHATZ U .Modeling and applications of silent discharge plasma [J].IEEE Transactions on Plasma Science,1991,19(1):309-323
[2]MLLER I,PUNSET C,AMMELT E,etal.Self-organized filaments in dielectric barrier glow discharges[J].IEEE Transactions on Plasma Science,1999,27(1):20-21
[3]RAIZER Y P. Gas Discharge Physics [M].Heidelberg:Springer,1991
[4]KOGELSCHATZ U. Silent discharges for the generation of ultraviolet and vacuum ultraviolet excimer radiation[J].Pure and Applied Chemistry,1990,62(9):1667-1674
[5]孙 明,吴 彦,李 杰,等.低温等离子体烟气脱硫中OH自由基发生装置研究 [J].大连理工大学学报,2004,44(1):26-30(SUN Ming,WU Yan,LI Jie,etal.Study of apparatus producing OH radicals for desulfuration from flue gas by non-thermal plasma[J].Journal of Dalian University of Technology,2004,44(1):26-30)
[6]GERBER T, ITHY W. The formation of OH(A2Σ+)from H2O in a longitudinal discharge[J].Journal of Chemical Physics,1983,79(11):5445-5447
[7]SUN B,SATO M,CLEMENTS J S.Optical study of active species produced by a pulsed streamer[J].Journal of Electrostatics,1997,39(3):189-202
[8]ERSHOV A,BORYSOW J.Dynamics of OH (X2Π,v=0)in high-energy atmospheric pressure electrical pulsed discharge [J].Journal of Physics D:Applied Physics,1995,28(1):68-74
[9]SANKARANARAYANAN R, PASHAIE B,DHALI S K. Laser-induced fluorescence of OH radicals in a dielectric barrier discharge[J].Applied Physics Letters,2002,77(19):2970-2972
[10]OUYANG J M,GUO W, WANG L,etal.Numerical simulation of chemical processes in atmospheric plasmas [J].Chinese Physics,2004,13(12):2174-2181
[11]OUYANG J M,GUO W, WANG L,etal.Numerical simulation of chemical processes in helium plasmas in atmospheric environment [J].Chinese Physics,2005,14(1):154-158
[12]EICHWALD O,YOUSFI M,HENNAD A,etal.Coupling of chemical kinetics,gas dynamics,and charged particle kinetics models for the analysis of NO reduction from flue gases [J].Journal of Applied Physics,1997,82(10):4781-4794
[13]STALDER K R,VIDMAR R J,NERSISYAN G,etal.Modeling the chemical kinetics of high pressure glow discharges in mixtures of helium with real air [J].Journal of Applied Physics,2006,99(9):093301-093301-8
[14]刘忠伟,徐 勇,杨学锋,等.介质阻挡放电等离子体中HO2自由基的红外光腔衰荡光谱原位诊断[J].真空科学与技术学报,2007,27(6):535-539
[15]张 静.介质阻挡放电脱出甲醛的化学动力学研究[D].大连:大连理工大学,2007
[16]ATKINSON R,BAULCH D L,COX R A,etal.Evaluated kinetic and photochemical data for atmospheric chemistry,organic species:supplement VII[J].Journal of Physical and Chemical Reference Data,1999,28(2):191-393
[17]STEFANOVI I,BIBINO N K,DERYUGI A A,etal.Kinetic of ozone and nitric oxides in dielectric barrier discharge in O2/NOxand N2/O2/NOxmixture[J].Plasma Source Science and Technology,2001,10(1):406-416
[18]DAHIYA R P,MISHRA S K,VEEFKIND A.Plasma chemical investigations for NOxand SO2removal from flue gases[J].IEEE Transactions on Plasma Science,1993,21(3):346-348
[19]徐士良.FORTRAN常用算法集 [M].北京:清华大学出版社,1992
[20]DYATKO N A, KOCHETOV I V,NAPARTOCICH A P.Electron energy distribution function in decaying nitrogen plasma[J].Journal of Physics D:Applied Physics,1993,26(3):418-423
[21]GUERRA V,FRANCISCO M D,JORGE L,etal.Time-dependence of the electron energy distribution function in the nitrogen afterglow [J].IEEE Transactions on Plasma Science,2003,31(4):542-551
[22]武汉大学,山东大学计算数学教研室.计算方法[M].北京:人民教育出版社,1979
[23]ITIKAWAA Y,MASON N.Cross sections for electron collisions with water molecules[J].Journal of Physical and Chemical Reference Data,2005,34(1):1-24
[24]ITIKAWA Y,ICHIMURA A,ONDA K,etal.Cross sections for collisions of electrons and photons with oxygen molecules[J].Journal of Physical and Chemical Reference Data,1989,18(1):23-42
[25]MELTON C E.Cross sections and interpretation of dissociative attachment reactions producing OH-,O-,and H-in H2O*[J].Journal of Chemical Physics,1972,57(10):4218-4225
