无免疫功能缺陷者侵袭性肺曲霉病3例并文献复习
2010-06-05李胜岐
曲 丹,李 钰,李 彤,李胜岐
( 1.中国医科大学附属盛京医院 呼吸科,辽宁 沈阳 110004;2.沈阳市胸科医院 内科,辽宁 沈阳 110044)
侵袭性肺曲霉病 (invasive pulmonary as-pergillosis,IPA)主要发生在免疫抑制的患者,而免疫功能正常人群发生曲霉感染较少见,现将我院收治的无免疫功能缺陷的侵袭性肺曲霉病3例报道如下。
1 临床资料
病例1:男,46岁,司机。因咳嗽咯痰伴呼吸困难1周,发热5 d入院。痰为灰黄色,粘稠不易咯出,伴呼吸困难,不能平卧,体温最高38.4℃,于外院应用克林霉素及阿奇霉素治疗5 d无好转。既往健康,吸烟60包/年。查体:体温37.2℃,脉搏96次/min,呼吸26次/min,血压170/90 mmHg,端坐位,口唇略发绀,双肺可闻及水泡音,散在干鸣音,心律齐。外院胸片示双肺纹理增强,左肺炎。血常规示WBC 13.7×109/L,中性粒细胞0.87,血红蛋白165 g/L,血小板138×109/L,血气分析示:pH7.42,PaO278.2 mmHg,PaCO223.6 mmHg。入院诊断:社区获得性肺炎。予哌拉西林/他唑巴坦抗感染4 d,症状无缓解,三次痰培养回报均为烟曲霉菌生长,血真菌培养阴性。肺CT示双肺内散在结节影、斑片影及实变影,少许磨玻璃样影(图1),可见树芽征(图2),纵隔内多组淋巴结肿大。空腹及餐后2 h血糖分别为 11.5 mmol/L及17.5 mmol/L,糖化血红蛋白为7.8%。诊断:①侵袭性肺曲霉病;②2型糖尿病。予卡泊芬净静点,第一天为70 mg,以后为50 mg/d,6 d后患者症状无改善,且出现少量咯血,复查肺CT提示肺内感染性病变较前增多,可见多发空洞。停用卡泊奋静。予两性霉素B脂质体静点,由10 mg/d开始,逐日增量至50 mg/d,应用的第二日呼吸困难即明显减轻,体温下降。应用至第17天时,患者仅低热,呼吸困难完全缓解,痰量少,双肺水泡音基本吸收,血常规正常,肝肾功能正常,但恶心明显,不能进食,周身肌肉酸痛,考虑与两性霉素B脂质体副作用有关,故将其停用。予伊曲康唑0.2,每天二次,口服,丙种球蛋白静脉滴注,丙球静点3 d,10 d后肺CT:右肺上叶前段及后段病变较前略好转。予出院,继予伊曲康唑口服,19 d后门诊复查肺CT示肺双肺病变较前好转。
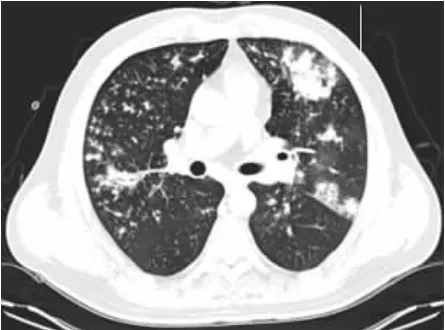
图1 CT示双肺内散在结节影、斑片影及实变影,少许磨玻璃影

图2 CT局部可见树芽征
病例2:患者,男,63岁,退休,因反复咳嗽咯痰喘息20年加重20 d入院。痰为灰黄色,发黑,粘稠,呼吸困难明显,不能平卧,体温最高38.4℃,于外院曾应用四代头孢、亚胺培南及阿奇霉素等药治疗,未见好转。无吸烟史。查体:体温36℃,脉搏148次/min,呼吸30次/min,血压126/88 mmHg,端坐位,口唇略发绀,颈静脉无充盈,肺肝界第7肋间,双肺散在水泡音及干鸣音,心律齐。肺CT示:双肺多发渗出性病变,肺气肿,纵隔内多组淋巴结肿大。血常规示WBC 35.5×109/L,中性粒细胞0.91,血红蛋白165 g/L,血小板 138×109/L,血气分析示:pH 7.46,PaO269.1 mmHg,PaCO242.5 mmHg。初步诊断:①慢性支气管炎;②阻塞性肺气肿。③肺炎。予哌拉西林/他唑巴坦及莫西沙星静点抗感染3 d症状无缓解。3次痰培养均为烟曲霉菌生长。血真菌培养阴性。予卡泊芬净静脉滴注6 d,并予丙种球蛋白增加免疫支持。患者症状无改善,并且出现了Ⅱ型呼吸衰竭,PaO2为 51.8 mmHg,PaCO2为 54.4 mmHg。复查肺CT示双肺多发斑片影,其内可见多发不规则空洞,洞壁欠光滑,其内可见丝絮状物(图3)。诊断:侵袭性肺曲霉病。予两性霉素B脂质体,由5 mg/d逐渐增量,4 d后增至20 mg/d,患者体温下降,咳嗽咯痰及呼吸困难均减轻,监测肝肾功能、心电图及血钾均正常,白细胞降至21.2×109/L,拟继续增量,患者家属因害怕出现肾毒性,拒绝增量,要求仅用20 mg/d维持治疗,之后患者一直低热,偶有痰中带血,PaCO2逐渐升至73 mmHg,出现嗜睡及谵妄,诊断为肺性脑病。应用两性霉素B脂质体至19 d时,患者呼吸困难加重,复查肺CT示双肺多发渗出性改变伴空洞形成,右腋-气胸(图4),患者家属拒绝胸腔闭式引流,患者于2 d后临床死亡。

图3 CT示双肺多发斑片影,其内可见多发不规则空洞,洞壁欠光滑,其内可见丝絮状物

图4 CT示双肺多发渗出性改变伴空洞形成,右腋-气胸
病例3:患者,男,57岁,农民,因咳嗽咯痰伴呼吸困难15 d,发热10 d入院。咯大量灰黄色粘痰,呼吸困难明显,不能平卧,体温最高38℃,于外院曾应用青霉素、头孢类药物及阿奇霉素等药病情无好转。既往健康,吸烟30包/年。查体:体温36.5℃,脉搏90次 /min,呼吸 22次 /min,血压 120/70 mmHg,双肺可闻及广泛水泡音,少量干鸣音,心脏听诊正常,双下肢无浮肿。初步诊断:社区获得性肺炎。予美罗培南抗感染4 d无效。三次痰培养均为烟曲霉菌生长,血真菌培养阴性。肺CT:双肺野内弥漫分布斑片状密度增高影,边界模糊,部分病变见空洞形成,内有丝絮状物,以双肺上叶为著(图5),纵隔内见多发稍肿大淋巴结影。诊断:侵袭性肺曲霉病。予两性霉素B脂质体,由10 mg/d逐渐增量至30 mg/d,患者体温略下降,但咳嗽咯痰及呼吸困难均无改善,出现少量咯血,于应用第5天肌酐升至142μmol/L,超声示:双肾弥漫性损伤改变,诊断为急性肾功能不全。两性霉素B脂质体暂未增量,用至10 d症状无改善,建议改用伏立康唑,患者家属拒绝,签字退院后很快死亡。

图5 双肺野内多发斑片影及磨玻璃样影,可见空洞形成,空洞内壁不光滑
此3例患者淋巴细胞亚群均正常。肺炎支原体、肺炎衣原体及军团菌抗体阴性。HIV及RPR阴性。痰结核菌培养及涂片阴性。心钠素阴性,均除外由心功能不全所导致的呼吸困难。
2 讨论
2.1 IPA的一般情况
IPA常由于大量吸入曲霉孢子而引起,常见的病原菌为烟曲霉、土曲霉、黄曲霉、构巢曲霉和雪白曲霉,其中,以烟曲霉最为常见[1]。IPA主要发生在免疫抑制的患者,是这类患者死亡的主要原因之一[2]。高危因素包括粒细胞减少、造血干细胞移植及实体器官移植术后、长期大量应用糖皮质激素、血液系统恶性肿瘤、细胞毒疗法、艾滋病及慢性肉芽肿性疾病。其中,粒细胞减少,尤其是中性粒细胞数<500个/mm3是最重要的高危因素。在化疗后中性粒细胞减少的急性白血病患者,IPA占所有感染的7.5%[3]。而免疫功能正常人群发生曲霉感染较少见。文献报道,免疫功能正常者发生IPA可能与糖皮质激素的使用、反复住院、广谱抗生素的应用以及伴随的一些其它疾病如严重的慢性阻塞性肺疾病、糖尿病、酒精中毒、慢性肝病及营养不良有关[3,4]。
本组3例患者免疫功能均正常,其中例1及例2分别有基础疾病糖尿病及慢性支气管炎,而例3体健,无任何基础疾病。文献报道,无基础肺疾病的患者中发生曲霉感染者约占18%[5]。例2曾应用广谱抗生素。追问病史,例1患者为地铁修建处司机,潮湿的工作环境可能存在大量的曲霉孢子,过量吸入导致致病。
2.2 IPA的临床特征
IPA患者通常表现为对抗生素无反应的发热、咳嗽、痰多及呼吸困难,也可有胸痛及咯血,咯血通常很轻,也可以大量咯血。曲霉菌感染也可以通过血流播散到其它器官,最常见是脑,也可到皮肤、肾脏、胸膜、食道及肝脏,但较少见。
本组的3例患者抗生素治疗均无效。临床表现以咳嗽咯痰及呼吸困难为主。痰的特点为灰黄色,粘稠,不易咯出。3例患者呼吸困难进行性加重,不能平卧,双肺可闻及干鸣,提示不易缓解的气道痉挛可能为IPA的临床特点之一[6]。3例患者在病程中都曾出现少量咯血,对症处理后很快缓解,未有大咯血发生。1例患者病程后期出现液-气胸。
2.3 CT影像特点
WON等人的研究表明,80%(4/5)的IPA患者CT影像呈现片状实变影及磨玻璃影,40%(2/5)的患者的CT影像上至少可以看到一个晕轮征[7]。晕轮征是指结节影周围的磨玻璃样影,其病理基础是曲霉破坏了肺部小血管导致的肺实质出血性梗死。晕轮征是IPA早期重要的CT征象[3,7],免疫功能缺陷患者CT见晕轮征时强烈提示IPA。然而,此征并非特异,毛霉菌病、机化性肺炎及肺出血也可出现,需结合临床症状及实验室检查综合判断。IPA的晚期征象主要为新月征或空洞形成[8]。
本组3例患者CT表现呈多样性,双肺均有多发结节影、斑片影及实变影,3例均可见多发空洞,空洞特点为内壁不光滑,内有丝絮状物。3例均有磨玻璃影及纵隔淋巴结肿大,1例有树芽征,均未有晕轮征及胸腔积液。
2.4 IPA的诊断
IPA的诊断由宿主因素、临床特征、微生物学检查和组织病理学4部分组成,国内外有关指南将IPA的诊断分为确诊、临床诊断和拟诊3个级别[4,9]。“确诊”要求在正常无菌的组织内检出曲霉菌,这需要行肺活检或支气管肺泡灌洗,IPA患者病情重,呼吸困难明显,很难耐受这样的侵入性操作,临床实施困难。痰曲霉菌培养阳性率较低(8%-34%),即使阳性也不能区分定植和感染,但2次以上痰培养阳性,同时结合宿主因素及临床特征可确定IPA的诊断[9]。本组3例患者痰烟曲霉菌培养均3次阳性,笔者认为,反复进行痰培养并结合临床表现及CT检查,对确定诊断有较高实用价值。
2.5 IPA的治疗
抗曲霉菌药物主要包括大环多烯类、三唑类及棘白菌素类,代表药物分别为两性霉素B、伏立康唑及卡泊芬净。多年来,两性霉素B一直是治疗IPA的一线药物,因其有严重的肾脏毒性,近年来已逐渐被两性霉素B含脂制剂所替代,包括两性霉素B脂质复合体、两性霉素B胆固醇复合体和两性霉素B脂质体。同两性霉素B相比较,两性霉素B脂质体的肾脏毒性明显减低,但在接受其治疗的患者中,仍有5.5%-18.7%会发生肾功能损害[10]。文献报道,棘白菌素类药物是IPA患者初始治疗无效时有效的治疗药物。一个对IPA进行补救性治疗的对照分析表明,同单用伏立康唑相比,联用伏立康唑和卡泊奋静有生存优势[11]。对于抗真菌治疗无效的IPA患者,联合治疗可能是一个策略,可选择一个棘白菌素类药物联用一个二性霉素B含脂制剂或三唑类药物。联合治疗仍有待于临床进一步观察和探讨,还不能推荐作为IPA患者的初始常规治疗。
本组的例1及例2应用了卡泊芬净进行初始治疗,均无效,改用两性霉素B脂质体,从低剂量开始逐渐增量,两个患者症状很快缓解。例1应用两性霉素B脂质体17 d,时间最长,后出现明显恶心,不能进食,周身肌肉酸痛,考虑为两性霉素B脂质体副作用,将其停用,改为伊曲康唑口服,病情好转出院。例2因家属拒绝增量,患者两性霉素B脂质体用量增至20 mg/d后一直维持此水平,后患者出现液气胸,家属不同意治疗,患者最终临床死亡。例3应用两性霉素B脂质体5 d,仅体温略有下降,却出现了急性肾功能不全,两性霉素B脂质体未能继续增量,拟改用伏立康唑,患者自动退院,很快死亡。从这3个病例可以看出,两性霉素B脂质体治疗IPA是有效的,但必须剂量够、疗程足才能获得好的预后,但因其毒副作用较多,应用剂量受到限制。从本组两例初始应用卡泊芬净的患者未看到该药的治疗优势,也可能和例数较少有关。
IPA少见于免疫功能正常者,而且其症状缺乏特异性,早期诊断困难,常误诊。我们认为,对于抗生素治疗无效的肺炎患者,要想到IPA的可能,应仔细询问患者的职业和居住环境,这可能会给我们提供重要的信息。同时,应注意观察患者痰液的性状,是否灰黄、粘稠,并反复行痰培养,注意肺部CT影像特点及动态变化,有助于及时地诊断和治疗。
[1]陈 琼,曲霉病,赵蓓蕾.主编.现代肺部真菌病学[M].北京:人民军医出版社,2004:150-163.
[1]ZHAO BL,SHI Y,editor in chief.Modern Pulmonery Mycosis[M].Beijing:People'sMilitary Medical Press,2004:150-163.Chinese
[2]YAMAMOTO Y,YANAGIHARA K,MIYAZAKI Y,et al.A case of legionella pneumophila pneumonia followed by invasive aspergillosis[J].Jpn.J.Infect.Dis,2008,61:379-381.
[3]The clinical spectrum of pulmonary aspergillosis[J].Chest,2002,121:1988-1999
[4]ZMEILI OS,SOUBANI AO.Pulmonary aspergillosis:a clinical update[J].QJ Med,2007,100:317-334
[5]KIM YT,KANG MC,SUNG SW,et al.Good long-term outcomes after surgical treatment of simple and complex pulmonary aspergilloma[J].Ann Thorac Surg,2005,79:294-298
[6]詹庆元,贺航咏,童朝晖等.重症慢性呼吸道疾病合并侵袭性肺曲霉病的临床特点[J].中华结核和呼吸杂志,2008,31(4):282-286
[6]ZHAN QY,HE HY,TONG CH,et al.Clinical features of pulmonary aspergillosis in critically ill patients with chronic respiratory diseases[J].Chinese Journal of Tuberculosis and Respiratory Diseases,2008,31(4):282-286.Chinese
[7]WON HJ,LEE KS,CHEON JE,et al.Invasive pulmonary aspergillosis:prediction at thin-section CT in patients with neutropenia-a prospective study[J].Radiology,1998,208:777-782.
[8]邓伟吾.关注侵袭性肺真菌病的诊断及治疗 [J].临床肺科杂志,2007,12(3):213-214.
[8]DENG WW.Paying close attention to the diagnosis and treatment of invasive pulmonary aspergillosis[J].Journal of Clinical Pulmonary Medicine,2007,12(3):213-214.Chinese
[9]中华内科杂志编辑委员会.侵袭性肺部真菌感染的诊断标准与治疗原则(草案)[J].中华内科杂志,2006,45(8):697-700.
[9]The editorial committee of chinese journal of internal medicine.The diagnostic criteria and therapeutic principle of invasive pulmonary fungal infection (protocol)[J].Chinese Journal of Internal Medicine,2006,45(8):697-700.Chinese
[10]GOTTFREDSSON M,STEINGRIMSDÓTTIRH.Disseminated invasive aspergillosis in a patient with acute Leukaemia[J].Acta Biomed,2006,77:10-13
[11]MARR KA,BOECKH M,CARTER RA,et al.Combination antifungaltherapy forinvasive aspergillosis[J].Clin InfectDis 2004,39:797-802
