PPAR-γ及CTGF对肝癌细胞生长的影响及相互作用的研究
2010-06-05杨爱军王晨昱
蔡 玮,张 芳,刘 伟,杨爱军,王晨昱,李 敏
(兰州大学基础医学院病理研究所,甘肃 兰州 730030)
过氧化物酶增殖激活受体-γ(peroxisome proliferators activated receptors,PPAR-γ) 是一类核转录因子[1],可以调控肿瘤细胞分化,抑制肿瘤细胞增殖。结缔组织生长因子(connective tissue growth factor,CTGF/)也与肿瘤细胞的增殖、血管的发生等方面相关[2]。有研究显示[3],转录生长因子 -β(transeription growth factor β,TGF-β)是 CTGF上游的调控分子,在肿瘤细胞中,PPAR-γ与TGF-β的表达也相关[4]。本实验通过体外实验观察了PPAR-γ及CTGF对肝癌细胞增殖、侵袭及迁移的影响及两者之间的关系。
1 实验材料
兔抗人多克隆PPAR-γ抗体及兔抗人多克隆CTGF抗体(武汉博士德生物工程有限公司)。鼠抗人单克隆CTGF抗体(美国Santa Cruz公司)。SP免疫组化染色试剂盒(北京中杉金桥生物技术有限公司)。人肝癌细胞株HepG-2由兰州大学基础医学院病理研究所提供。甲氮甲唑蓝(美国Sigma公司)。鼠尾胶(本实验室自制)。PPAR-γ激动剂-罗格列酮(rosgilitazone,RGZ)(浙江万马公司),完全溶于二甲亚砜,DMSO终浓度不超过0.1%。博依登小室(美国Millipore公司)。
1.1 实验方法
1.1.1 免疫组化检测HepG-2细胞中PPAR-γ及CTGF的表达 取对数生长期的HepG-2细胞制成单细胞悬液后爬片。免疫组织化学染色按试剂盒说明操作。制片后光镜下观察细胞,细胞浆或细胞核中出现棕黄色颗粒为阳性表达。
1.1.2 PPAR-γ对HepG-2增殖作用的影响 取对数生长期的HepG-2细胞制成单细胞悬液,调整密度为3×104/mL,悬浮于10%FBS的RPMI 1640培养液中,接种于96孔板,每孔200μL。待细胞帖壁后,吸去原培养基,加入终浓度分别为5、10、20、40和80μmol/L的RGZ,终体积为200μL。每个浓度级设4个复孔,每次设对照组(仅含二甲亚砜的RPMI 1640培养基)。加药后分别培养12、24、48和72 h,每孔加 MTT溶液 20μL,继续孵育 4 h,终止培养,小心吸弃上清,加二甲基亚砜150μL,振荡10 min,酶标仪测570 nm波长A值。重复3次试验,取均值。按以下公式计算,抑制率(inhibition rate,IR%)=(1-实验组A值/对照组A值)×100%。增殖率(growth rate,GR%)=(实验组 A值 /对照组 A值)×100%。
1.1.3 CTGF对HepG-2增殖作用的影响 细胞处理及加样方法同1.1.2。加入终浓度分别为5、10、20和50μg/mL的CTGF抗体,分别培养24、48、72 h,MTT检测方法及抑制率、增殖率计算公式同1.1.2。
1.1.4 PPAR-γ及CTGF对HepG-2侵袭性的影响 博依登小室下室加入含40%新生牛血清的RPMI 1640培养液,终体积为200μL。将3g/L的自制鼠尾胶按40μL/孔均匀地铺在博依登小室上下室之间的孔径为8μm的滤膜的上室面上,置37℃30 min聚合成凝胶。上室加入密度为1.0×106个/mL的HepG-2单细胞悬液(细胞预先在不含血清的RPMI 1640培养液中培养24 h),上室终体积为300μL。将小室置于6孔板内,培养48 h后用棉签头擦掉自制鼠尾胶,PBS洗3次,95%乙醇固定。对己穿透的细胞进行苏木素染色,相差显微镜观察、拍照并计数。每个滤膜分别计数随机5个视野内的穿膜细胞数后计算平均值。每组设3个平行小室,重复实验3次。
试验分为3组;A组:细胞不加处理组。B组:上室细胞预先用RGZ处理48h,浓度为40μmol/L。C组:上室细胞预先用CTGF抗体封闭处理48h,抗体浓度为10μg/mL。
1.1.5 PPAR-γ及CTGF对HepG-2细胞系迁移性的影响 方法两点不同:膜的上室面不铺胶;上室细胞浓度为6.0×105个/mL,分组同侵袭实验。
1.1.6 RT-PCR测定经PPAR-γ激动剂处理后CTGF的表达 设计引物序列如下:CTGF的上游引物5'-GCAGGCTAGAGAAGCAGAGC-3',下游引物 5'-ATGTCTTCATGCTGGTGCAG-3',产物大小为105 bp;内参β-actin的上游引物5'-TGGAGAAGAGCTATGAGCTGCCTG-3',下游引物 5'-GTGCCA CCAGACAGCACTGTGTTG-3',产物大小为202 bp。Marker由大连宝生物提供,序列号为D513A。RT-PCR引物设计参照有关文献,经基因库核实,由上海生物工程公司合成。细胞预先经RGZ处理(浓度为40μmol/L,处理48h),按Trizol试剂盒说明书提取细胞中的总RNA,反应条件为50℃逆转录30 min,94℃预变性 5 min,94℃变性 30 s,54℃退火 1 min,72℃延伸1 min,进行35个循环,最后72℃延伸7 min,琼脂糖凝胶电泳,凝胶成像系统中拍照记录、分析结果。
1.2 统计学处理
2 实验结果
2.1 免疫组化检测HepG-2中PPAR-γ及CTGF的表达

图1 HepG-2细胞中PPAR-γ的表达(×200)

图2 HepG-2细胞中CTGF的表达(×200)
2.2 RGZ对HepG-2作用的时间及剂量依赖性
RGZ对HepG-2细胞增殖有明显的抑制作用,呈时间和剂量依赖性。与对照组相比,20~80μmol/L的RGZ可以抑制HepG-2细胞的生长,差异有统计学意义(P <0.05),而 5μmol/L、10μmol/L的RGZ对细胞生长抑制作用与对照组间差异无统计学意义(P >0.05),见图 3。
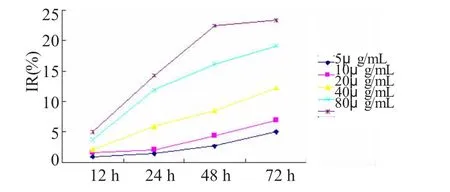
图3 RGZ对HepG-2作用曲线
2.3 CTGF抗体对HepG-2作用的时间及剂量依赖性
表1 不同浓度CTGF抗体处理后细胞抑制率差异()
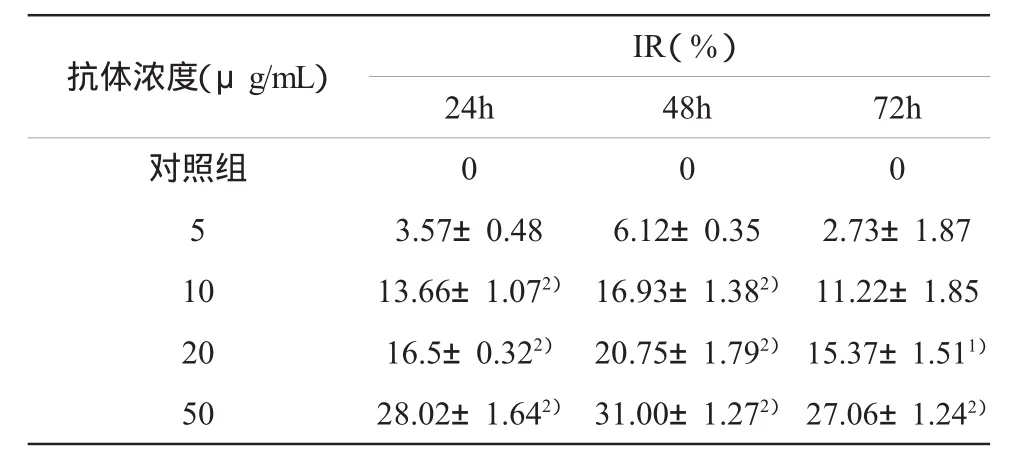
表1 不同浓度CTGF抗体处理后细胞抑制率差异()
注:1)与对照组比较,P<0.05;2)与对照组比较,P<0.01
抗体浓度(μg/mL)IR(%)24h 48h 72h对照组 0 0 053.57±0.48 6.12±0.35 2.73±1.8710 13.66±1.072) 16.93±1.382) 11.22±1.85205016.5±0.322)28.02±1.642)20.75±1.792)31.00±1.272)15.37±1.511)27.06±1.242)
经CTGF抗体处理后,HepG-2细胞增殖有明显的抑制,抗体剂量越大,抑制率越明显。同一抗体浓度时,48 h抑制率达到最大值。细胞增殖的抑制呈时间和剂量依赖性。10~50μg/mL的CTGF抗体处理后,HepG-2细胞的生长与对照组相比明显受抑制,差异有统计学意义(P<0.05),而5μg/mL组与对照组相比,差异无统计学意义(P>0.05),见表1。
2.4 PPAR-γ及CTGF对HepG-2侵袭及迁移能力的影响
可以看出,与RGZ处理前(图4A)相比,处理后(图4B)侵袭穿膜细胞数目明显减少(图中深染的为苏木素着色的细胞核)。
侵袭实验:加入RGZ和CTGF抗体封闭处理后,与对照组相比,侵袭穿膜细胞数目减少,差异有统计学意义(P<0.05),见表 2。
迁移试验:与对照组相比,PPAR-γ激动剂及CTGF抗体处理之后,迁移穿膜细胞数目都有所减少,差异有统计学意义(P<0.05)。PPAR-γ处理组穿膜细胞数变化较CTGF处理组明显,变化趋势基本与侵袭试验一致,见表2。
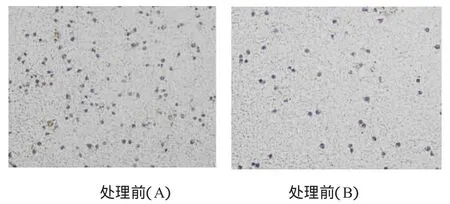
图4 RGZ处理前后侵袭穿膜细胞数目的变化(苏木素染色×100)
表2 RGZ及CTGF抗体处理后HepG-2细胞侵袭及迁移能力的改变()
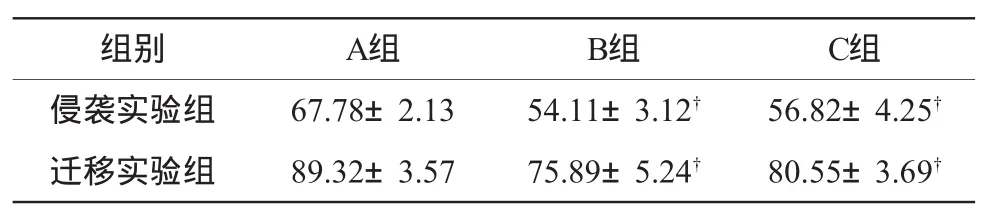
表2 RGZ及CTGF抗体处理后HepG-2细胞侵袭及迁移能力的改变()
注:†与A组比较,P<0.05
组别 A组 B组 C组侵袭实验组 67.78±2.13 54.11±3.12† 56.82±4.25†迁移实验组 89.32±3.57 75.89±5.24† 80.55±3.69†
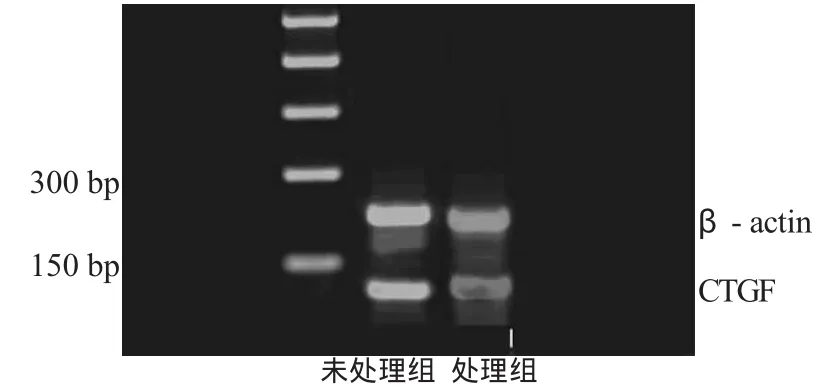
图5 RGZ处理前、后CTGF的表达
2.5 经RGZ处理前、后CTGF的表达
表3 RGZ处理前、后CTGF mRNA的表达()

表3 RGZ处理前、后CTGF mRNA的表达()
组别 CTGF mRNA未处理组 0.7841±0.0403处理组 0.5783±0.0332
HepG-2细胞中,CTGF有表达,经RGZ处理后CTGF的表达相对于未处理组降低,见图5,表3。
3 讨论
PPAR是核激素受体超家族的成员,它是由英国科学家ISSEMANN和GREEN[5]于1990年首先发现的。该受体有3种亚型:PPAR-α、PPAR-γ和PPAR-β-δ,这3种亚型在结构及功能上均有差异[6]。PPAR-γ与配体结合后被激活,其配体包括天然配体和合成配体两类。天然配体主要有:必需脂肪酸及其代谢产物,如亚麻酸、亚油酸、花生四烯酸等。人工合成激动剂,如噻唑烷二酮类也就是格列酮类药物,包括吡格列酮、罗格列酮、曲格列酮、环格列酮等。
起初对于PPAR-γ的研究主要集中在糖尿病方面,近年来对PPAR在肿瘤发生、发展过程中的影响作用的研究也日渐增多,尤其是γ亚型,与肿瘤关系最为密切。研究发现,PPAR-γ位于机体多种信号传导的交叉点,其被配体激活后可通过抑制细胞增殖、诱导细胞凋亡等途径发挥抗肿瘤作用,有望成为肿瘤化疗的一个新途径。研究还表明,PPAR-γ活化后抗癌机制主要通过调节细胞周期[7]、诱导凋亡[3]、抑制COX-2表达[8]等途径来实现。
本文的研究证实,加入PPAR-γ的激动剂后,HepG-2细胞的生长受到不同程度的抑制,呈剂量及时间依赖关系,且在48 h内,抑制率的改变最具意义,与国外文献报道一致[9]。进一步通过博依登小室的侵袭和迁移实验证实,PPAR-γ对细胞侵袭和迁移也同样发挥调控作用,加入PPAR-γ激动剂后,肝癌细胞侵袭和迁移能力受到抑制,说明PPAR-γ在肝癌的转移过程中发挥着一定的作用,抑制了肝癌细胞的生长、转移。
CTGF是 CCN家族成员之一,1991年由RADHAM等[10]首先在人类脐静脉内皮细胞的条件培养基中发现了人类的CTGF(hCTGF)。目前所发现的 CCN家族包括 Cry61,CTGF,Nov,W ISP-1,W ISP-2和W ISP-3六个成员。在发现伊始,对于CTGF的研究主要集中在纤维化方面,各种研究证实,CTGF是纤维化形成过程中的重要介质[4]。
近年来,CTGF与肿瘤的关系也逐渐受到重视。研究发现,胰腺癌、软骨肉瘤中CTGF的表达升高[11],在约61%的急性淋巴细胞白血病患者的骨髓中也出现CTGF的过度表达[12]。CCN是一组功能复杂的基因,它们不仅参与正常机体的生长调控,而且与肿瘤有密切联系,在肿瘤生长、血管生成、转移等生物学过程中起重要作用,且功能复杂多样。CTGF在肿瘤中的具体作用,目前还不是很清楚。
本文在对CTGF的研究过程中发现,加入CTGF的抗体封闭之后,HepG-2细胞的增殖受到抑制,也呈剂量及时间依赖关系,且肝癌细胞的侵袭及迁移能力也有所下降。CHANG等的研究也有相似的结果[13]。
RT-PCR检测经 RGZ事先处理(40μmol/L、48h)及未处理组的CTGF的表达的改变发现,处理组CTGF的表达相对于未处理组下降,提示PPAR-γ参与调控HepG-2的生长,部分是通过改变CTGF的表达来实现的。在肝脏组织中,不仅在纤维化的过程中PPAR-γ-CTGF途径发挥重要的作用,在肝癌的发展过程中,PPARγ-CTGF通路同样存在并且发挥调控作用。
PPAR-γ及CTGF都是近几年才被发现与癌症的发生、发展相关的因子,对于其具体的调控机制及作用通路研究并不十分明确,而发现PPAR-γ-CTGF途径,无疑为相关的研究和临床治疗提供了一个新的方向。
[1]H.PHILLIP KOEFFLER.Peroxisome proliferator-activated receptorγ and cancers[J].Clinical Cancer Research,2003,(9):1-9.
[2]S.MUEHLICH,B.KRUEGER,C.D.GARLICHS,et al.CCN abstracts[J].Clinical Pathology,2005,(58):466-478.
[3]BETH COYLE,CAROLINE FREATHY,TIMOTHY W.GANT,et al.Characterization of the transforming growth factor-B1-induced apoptotic transcriptome in FaO hepatoma cells[J].JBC Papers in Press,2002,(10):1074-1077.
[4]VIKTOR TODOROVIC,CHIH-CHIUN CHEN,NISSIM HAY,et al.The matrix protein CCN1 (CYR61)induces apoptosis in fibroblasts[J].JCB,2005,171(3):559-568.
[5]SIGAL GERY,DONG XIE,DONG YIN,etal.Ovarian carcinomas:CCN genes are aberrantly expressed and CCN1 promotes proliferation of these cells[J].Clinical Cancer Research,2005,(11):7243-7254.
[6]JIANG LQ,ZHUANG YZ,CAO JG,etal.Rosiglitazone enhanced growth inhibition of transplanted lung adenocarcinoma by Cisplatin in nude mice [J].China Journal of Modern Medicine,2008,18(9):1226-1229.Chinese
[7]MOUNIA ALAOUI-EL-AZHER,YONGZHENG WU,NATHALIE HAVET,et al.Arachidonic acid differentially affects basal and lipopolysaccharide-induced sPLA2-IIA expression in alveolar macrophages through NF-B and PPAR-γ dependent pathways[J].Mol Pharmacol,2002,(61):786-794.
[8]GUIDO EIBL,YASUNORI TAKATA,LASZLO G.BOROS,et al.Growth stimulation of COX-2-negative pancreatic cancer by a selective COX-2 inhibitor[J].Cancer Research,2005,(65):982-990.
[9]KOJIRO MATSUMOTO,SONGTAO YU,YUZHI JIA,et al.Critical role for transcription coactivator peroxisome proliferator-activated receptor (PPAR)-binding protein/TRAP220 in liver regeneration and PPAR ligand-induced liver tumor development[J].J.Biol.Chem.,2007,282(23):17053-17060.
[10]SEIJI KONDO,NORIKO TANAKA,SATOSHI KUBOTA,et al.Novel angiogenic inhibitor DN-9693 that inhibits post-transcriptional induction of connective tissue growth factor (CTGF/CCN2)by vascular endothelial growth factor in human endothelial cells[J].Mol Cancer Ther,2006,(5):129-137.
[11]WENGER C,ELLENRIEDERV,ALBERB,et al.Expression and differential regulation of connective tissue growth factor in pancreatic cancer cells[J].Oncogene,1999,18(4):1073-1080.
[12]VORWERK P,WEX H,HOHMANN B,et al.CTGF(IGFBP2rP2)is specifically exp ressed in malignant lymphoblasts of patients with acute lymphoblastic leukaemia (ALL)[J].Br J Cancer,2000,83(6):756-760.
[13]CHENG-CHI CHANG,JIN-YUAN SHIH,YUNG-MING JENG,et al.Connective tissue growth factor and its role in lung adenocarcinoma invasion and metastasis [J].Journal of the National Cancer Institute,2004,96(5):364-375.
