含醛基聚合物在生物医药领域中的应用研究进展
2010-06-04肖乃玉,周红军
表面带有官能团的聚合物因其独特的物理化学性质而受到许多研究者的关注。常见的功能基包括羟基、醛基、羧基、氨基、环氧基等,其中醛基最为引人注目,因为醛基可在温和条件下很容易地与带氨基的生物分子如酶、蛋白质、缩氨酸、核酸衍生物、药物等通过Schiff碱化学键合[1,2],这一特性使得含醛基聚合物在毒性和生物活性药物的包埋、蛋白质以及DNA的包埋、生物活性物质的分离和提纯、酶和细胞等生物医药领域具有重要的应用价值[3,4]。
1 药物控制释放
改善和控制药物在体内的分布和代谢、实现缓释给药和定向给药、提高药物利用率和治疗指数是现代药物研究领域的一个新方向[5,6]。早在20世纪初,Ehrlich就针对普通制剂在治疗疾病中存在的弊端,提出了靶向给药的设想。设计合成pH值敏感的偶联键将药物与聚合物载体相连接,是实现药物在体内定量、定位释放的一条重要途径。
醛基能够在温和的条件下,与带氨基的药物形成Schiff碱。Sokolsky-Papkov等[2]利用多糖中醛基与两性霉素B(AmB)通过Schiff碱共价连接,效果良好,有望用于真菌和利什曼原虫感染的治疗;Ma等[7]利用碳磁性纳米微球(CMNP)表面的醛基与抗癌药阿霉素(DOX)连接,得到结合药CMNP-DOX,负载效率高。
Schiff碱是对酸敏感的基团,在中性及弱碱条件下是稳定的;但在酸及弱酸环境下,Schiff碱断裂,释放药物。Ulbrich等利用该特性做了大量的研究工作[8~13]。
据报道[14],癌细胞及癌变部位呈弱酸性,而正常细胞呈中性,载体通过形成Schiff碱连接药物,只在癌变部位释放药物,只杀死癌细胞而不损害正常细胞,达到定位释放的目的,从而减少对人体的毒副作用。
Yoo等[15]利用聚氧乙烯-b-聚(L-乳酸)(PEO-b-PLLA)共价结合DOX,所形成的胶束具有pH值依赖性,由于胞饮作用和内涵体的酸性,导致Schiff碱断裂,释放DOX;以人淋巴母细胞(HSB-2)为模型,48 h后共价结合的药物在肿瘤细胞释放的DOX比游离药物更多,从而显示出更大毒性。
2 酶和细胞的固定化
酶是高效、专一性强的生物催化剂,生物体内的各类化学反应都是在酶催化下进行的。但酶对高离子浓度、热、强碱、强酸及部分有机溶剂不够稳定,容易失活而降低其催化性能;而且自由酶在水溶液中很不稳定,不能重复使用[16],这些不足大大限制了酶促反应的应用范围。
20世纪60年代,随着固定化酶技术(Immobilized enzyme technology)的出现,不仅克服了上述缺点,而且酶可以重复使用,提高了利用率,更有利于发挥其功效[17,18],使之成为生物技术中最为活跃的研究领域之一。酶(细胞)的固定化方法大致可分为包埋法、吸附法、共价偶联法三种[19]。其中共价偶联法是将酶直接通过共价键与载体的功能基相结合,具有较好的稳定性,有利于酶的连续使用,是目前研究和应用最为活跃的一类酶固定化方法。醛基在温和条件下即可直接与酶(细胞)上的-NH2形成Schiff碱而偶联,不需要活化,为共价固定酶(细胞)提供了非常便利的固定化方法[1,20,21]。Bartlett等[22]以γ-射线引发丙烯醛与聚乙烯膜接枝聚合后,利用活泼醛基共价固定葡萄糖氧化酶,效果良好。李军等[23]利用丙烯醛接枝苯乙烯共聚物中的醛基与蛋白质的氨基形成Schiff碱共价固定蛋白质,蛋白质不仅固定牢固、不会脱落,而且固定量可以控制。
固定化细胞是固定化酶技术的进一步发展,类似于多酶的固定化。固定化细胞不仅可以省去酶的分离纯化工作,减少酶活性损失;而且可以利用其包含的多酶系统完成催化过程,比固定化酶更具优势,因此倍受重视。目前日本和欧美各国都在开发这类技术,有的已应用于工业生产。
设计和合成具有特定反应性功能团的功能高分子载体,使其所带功能团在温和条件下与所吸附酶(细胞)的氨基、羧基等蛋白质残基共价偶联,所得的固定化酶(细胞)活力损失较小、传质效率高、同时具有吸附法及共价偶联法的优势而避免了包埋法的缺点,是固定化酶(细胞)载体材料的发展方向。含醛基聚合物在固定化酶(细胞)方面具有广阔的发展前景。
3 临床诊断试剂
由于抗体能够高选择性地和抗原结合,因此,临床上常以此来诊断疾病。其诊断机理为:将抗体固定在含功能团的微球上,因抗体-抗原间的特异性结合而在微球表面发生凝聚反应(图1),可快速、直观、方便地定性或定量确认诊断液中是否存在抗原,该法灵敏度高。
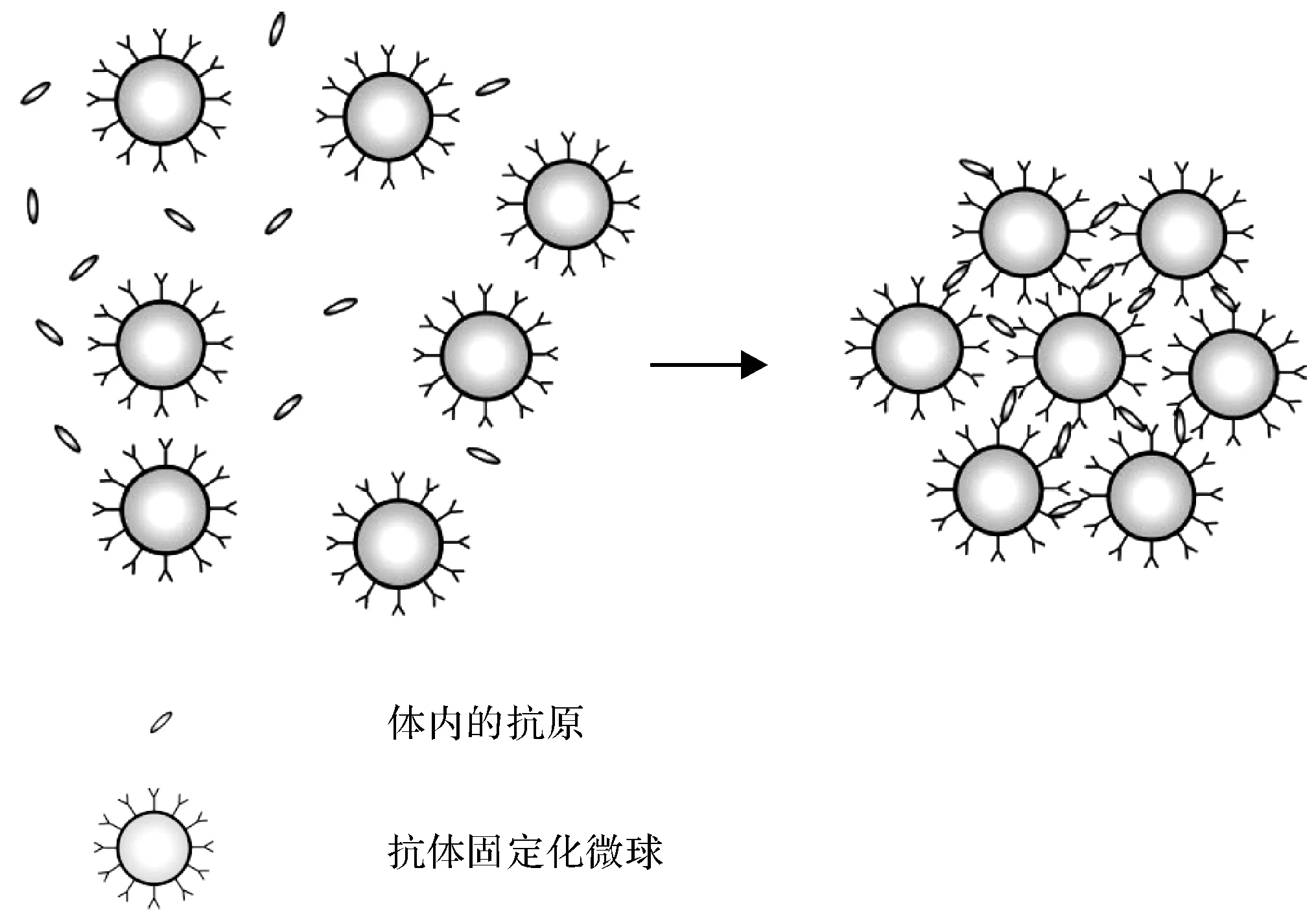
图1 凝聚反应
早在20世纪六七十年代,人们就利用聚苯乙烯微球固定抗体gamma-Globulins用于临床诊断测试[24,25],但聚苯乙烯微球只单纯地依靠疏水作用吸附抗体,非特异性吸附非常严重;亲水性表面有利于抑制抗体以外的蛋白质类的吸附,但是抗体不能通过吸附进行固定。因此,人们开始采用亲水性较强的微球通过化学法来固定抗体,如聚(2-羟乙基甲基丙烯酸酯)微球和聚(甲基丙烯酸缩水甘油酯)微球等[26]。
醛基是亲水性的活泼官能团,在温和条件下不需活化即可直接与抗原反应,不仅减少了反应步骤,而且能保持更好的活性。特异性好、亲和力强的含醛基聚合物微球是新一代先进的免疫载体微球,是研究开发的重点。有人曾将1~20 μm的磁性含醛基聚合物微球成功用于人血、尿和脑脊液中蛋白的荧光免疫分析和甲状腺素的放射免疫分析。Slomkowski等[27]采用乳液聚合法制备了具有-CHO、-CH2OH和-COOH的三种聚合物微球(图2),共价固定γ-球蛋白(γ-G)、人纤维蛋白原(Fb)、人血清蛋白(HAS)、葡萄糖氧化酶(GOD)等生物活性大分子,其中含醛基聚合物的共价绑定不需要活化;并对共价固定抗体、抗原的聚合物微球进行了抗体抗原的凝聚反应测试。结果表明,除抗原和抗体之间的引力外,抗体固定化微球之间的静电引力、抗原之间的静电引力均会影响凝聚反应,这与Okubo等[28]研究结果一致。
含醛基聚合物微球还可用于免疫亲和色谱分离中以纯化蛋白质或血液灌注除去体内有毒成分,如去除剧毒农药百草枯、有毒药物地高辛、有毒金属和抗原、抗体复合物等。此外,含醛基聚合物微球还有望通过检测突变基因DNA或RNA,用于癌症的早期发现;利用药物和作用靶点的特异相互作用,用于药物的筛选和药物作用靶点的探索。
4 组合化学中的聚合物载体材料及聚合物清除剂
1963年,自Merrifield[29]提出固相多肽合成法以来,以聚合物为载体的固相合成以其独特的魅力引起了研究者的注意。随着快速、高效的药物筛选技术高通量筛选(High throughout screening)的确立,20世纪90年代初,出现了第一个用固相法合成的小分子库,组合化学应运而生。随后,组合化学作为一门新兴学科活跃于化学界和医药界,组合化学技术成为一种高效、可靠的重要开发工具。而作为组合合成中的聚合物载体不仅要求化学惰性、有一定的溶胀性、机械稳定性好、易于再生,而且对载体的连接臂和功能团也有

图2 含有醛基、羧基和羟基的聚合物微球共价固定蛋白质
有一定的要求,因为它直接影响到产物的解脱方式,进而影响产物的产率及纯度。因而开发含多种形式功能团的新型聚合物载体材料是组合化学中的重要内容。
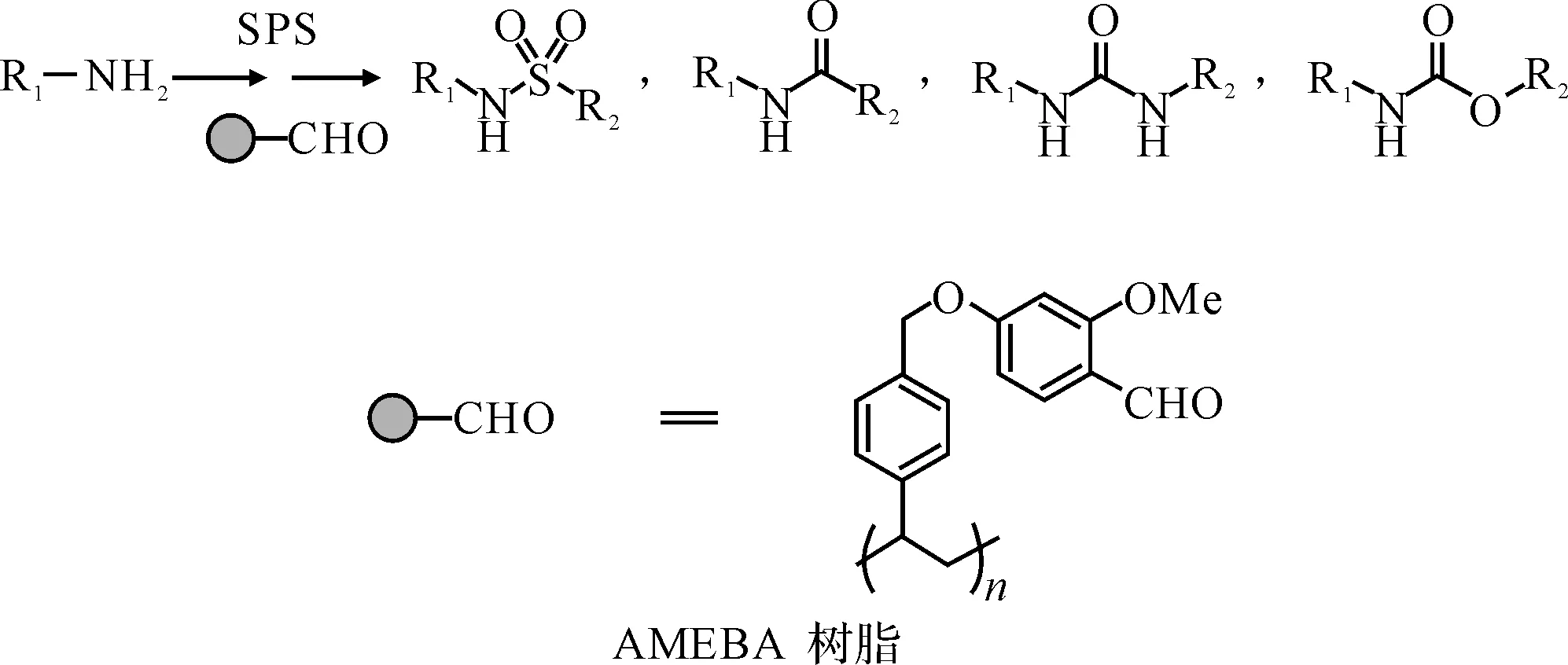
图3 AMEBA树脂的固相合成
组合化学另外一个技术是液相合成,与固相合成相比,液相合成反应时间短、技术成熟,但后处理繁杂。如果在液相反应结束后,将带有特殊功能基的固相试剂加入到液相体系中,使其与体系中过量的原料及副产物反应,最后通过简单过滤就可达到纯化反应产物的目的,这样不但保持了液相反应的优点,而且简化了后处理过程。所加的固相试剂被称为清除树脂(Scavenger resin)或聚合物清除剂。1996年,Kaldor等[38,39]首次使用不同的清除树脂(伯胺、异氰酸酯、醛基、酰氯树脂)对液相平行合成制备的小分子库进行了纯化操作,结果发现,清除树脂对较复杂化合物的合成均能起到很好的清除作用,证实了这种纯化技术的优越性。
以醛基为反应活性基团的交联聚苯乙烯树脂是一类用途广泛的功能高分子材料,不仅可用作固相有机合成载体,而且可作为液相合成树脂清除剂[40],用于清除肼、羟氨、巯氨等[41]过量试剂。Lin等[42]以丙烯醛树脂作为清除树脂用于苯甲酰氯与一系列的伯胺反应制备酰胺小分子库,产物纯度高达98.2%~99.9%。
5 结语
含醛基聚合物是一类用途广泛的功能高分子,尤其在新材料、生物医药等领域中的应用更能显示其优异的性能和很高的附加值,近年来,逐渐受到人们的重视。但含醛基聚合物的合成研究和应用进展相对比较缓慢,国内这方面的研究更显不足,基本处于研究阶段, 其产品的工业化、市场化还有待进一步探索,研究和开发含醛基聚合物具有重要的理论和现实意义。
参考文献:
[1] Slomkowski S. Polyacrolein-containing microspheres: Synthesis, properties and possible medical applications[J]. Progress in Polymer Science, 1998, 23(5): 815-874.
[2] Sokolsky-Papkov M, Domb A J, Golenser J. Impact of aldehyde content on amphotericin B-dextran imine conjugate toxicity[J]. Biomacromolecules, 2006, 7(5): 1529-1535.
[3] Liu J Q, Bulmus V, Herlambang D L, et al. In situ formation of protein-polymer conjugates through reversible addition fragmentation chain transfer polymerization[J]. Angewandte Chemie-International Edition, 2007, 46(17): 3099-3103.
[4] Bathfield M, D′Agosto F, Spitz R, et al. Versatile precursors of functional RAFT agents. Application to the synthesis of bio-related end-functionalized polymers[J]. Journal of the American Chemical Society,2006, 128(8): 2546-2547.
[5] 曾嘉,郑连英,余世清. 壳聚糖微球固定化葡萄糖氧化酶的研究[J]. 食品工业科技, 2002, 23(1): 29-31.
[6] Duncan R. The dawning era of polymer therapeutics[J]. Nature Reviews Drug Discovery, 2003, 2(5): 347-360.
[7] Ma Y H, Manolache S, Denes F S, et al. Plasma synthesis of carbon magnetic nanoparticles and immobilization of doxorubicin for targeted drug delivery[J]. Journal of Biomaterials Science, Polymer Edition, 2004, 15(8): 1033-1049.
[8] Ulbrich K, Subr V. Polymeric anticancer drugs with pHcontrol-led activation[J]. Advanced Drug Delivery Reviews, 2004, 56(7): 1023-1050.
[9] Hruby M, Konak C, Ulbrich K. Polymeric micellar pH-sensitive drug delivery system for doxorubicin[J]. Journal of Controlled Release, 2005, 103(1): 137-148.
[10] Chytil P, Etrych T, Konak C, et al. Properties of HPMA copolymer-doxorubicin conjugates with pH-controlled activation: Effect of polymer chain modification[J]. Journal of Controlled Release, 2006, 115(1): 26-36.
[11] Etrych T, Chytil P, Jelinkova M, et al. Synthesis of HPMA copolymers containing doxorubicin bound via a hydrazone linkage. Effect of spacer on drug release andinvitrocytotoxicity[J]. Macromolecular Bioscience, 2002, 2(1): 43-52.
[12] Ulbrich K, Subr V, Strohalm J, et al. Polymeric drugs based on conjugates of synthetic and natural macromolecules I. Synthesis and physico-chemical characterization[J]. Journal of Controlled Release, 2000, 64(1-3): 63-79.
[14] Gillies E R, Frechet J M J. pH-Responsive copolymer assemblies for controlled release of doxorubicin[J]. Bioconjugate Chemistry, 2005, 16(2): 361-368.
[15] Yoo H S, Lee E A, Park T G. Doxorubicin-conjugated biodegradable polymeric micelles having acid-cleavable linkages[J]. Journal of Controlled Release,2002, 82(1): 17-27.
[16] 陈石根, 周润琦. 酶学[M].上海: 复旦大学出版社, 2001: 8-20.
[17] Kondo A, Fukuda H. Preparation of thermo-sensitive magnetic microspheres and their application to bioprocesses[J]. Colloid and Surface A: Physicochemical and Engineering Aspects, 1999, 153(1-3): 435-438.
[18] 任广智,李振华,何炳林. 磁性壳聚糖微球用于脲激酶的固定化研究I.磁性壳聚糖微球的制备和表征[J]. 离子交换与吸附, 2000, 16(4):304-310.
[19] van de V F, Lourenco N D, Pinheiro H M, et al. Carrageenan: A food-grade and biocompatible support for immobilization techniques[J]. Advanced Synthesis and Catalysis, 2002, 344(8): 815-835.
[20] Salo H, Virta P, Hakala H, et al. Aminooxy functionalized oligonucleotides: Preparation, on-support derivatization, and postsynthetic attachment polymer support[J]. Bioconjugate Chemistry, 1999, 10(15): 815-823.
[21] Li S J, Hu J, Liu B L. Use of chemically modified PMMA microspheres for enzyme immobilization[J]. Biosystems, 2004, 77(1-3): 25-32.
[22] Bartlett P N, Tebbutt P, Tyrrell C H. Electrochemical immobilization of enzymes. 3. Immobilization of glucose oxidase in thin films of electrochemically polymerized phenols[J]. Analytical Chemistry, 1992, 64(2): 138-142.
[23] 李军, 伊敏, 吴清泉, 等. 丙烯醛在聚苯乙烯小球表面预辐射接枝及其对蛋白质固定化[J]. 高分子学报, 1999, (2): 252-254.
[24] Hipp S S, Berns D S, Tompkins V, et al. Latex slide agglutination test forAspergillusantibodies[J]. Medical Mycology, 1970, 8(3): 237-241.
[25] Smith R T, Ts′ao C H. Fibrin degradation products in the postoperative period. Evaluation of a new latex agglutination method[J]. American Journal of Clinical Pathology, 1973, 60(5): 644-647.
[26] Harchali A A, Montagne P, Ruf J, et al. Microparticle-enhan-ced nephelometric immunoassay of anti-thyroid peroxidase autoantibodies in thyroid disorders[J]. Clinical Chemistry, 1994, 40(3): 442-447.
[27] Slomkowski S, Basinska T, Miksa B. New types of microsphe-res and microsphere-related materials for medical diagnostics[J]. Polymers for Advanced Technologies, 2002, 13(10-12): 906-918.
[28] Okubo M, Hattori H. Competitive adsorption of fibrinogen and albumin onto polymer microspheres having hydrophilic/hydrophobic heterogeneous surface structures[J]. Colloid & Polymer Science, 1993, 271(12): 1157-1164.
[29] Merrifield R B. Solid phase peptide synthesis (Ι):The synthesis of a tetrapeptide[J]. Journal of the American Chemical Society, 1963, 85(14): 2149-2154.
[30] Raju B, Kogan T P. Use of halomethyl resins to immobilize amines: An efficient method for synthesis of sulfonamides and amides on a solid support[J]. Tetrahedron Letters, 1997, 38(28): 4965-4968.
[31] Tumelty D, Schwarz M K, Cao K, et al. Solid-phase synthesis of substituted benzimidazoles[J]. Tetrahedron Letters, 1999, 40(34): 6185-6188.
[32] Alsina J, Yokum T S, Albericio F, et al. Backbone amide linker (BAL) strategy forNa-9-fluorenylmethoxycarbonyl(Fmoc) solid-phase synthesis of unprotected peptidep-nitroanilides and thioesters[J]. The Journal of Organic Chemistry, 1999, 64(24): 8761-8769.
[33] Bilodeau M T , Cunningham A M. Solid-supported synthesis of imidazoles: A strategy for direct resin-attachment to the imidazole core[J]. The Journal of Organic Chemistry, 1998, 63(9): 2800-2801.
[34] Kiselyov A S, Smith L, Virgilio A, et al. Immobilized aldehydes and olefins in the solid support synthesis of tetrahydroquinolines via a three component condensation[J]. Tetrahedron, 1998, 54(28): 7987-7996.
[35] Ouyang X , Kiselyov A S. Novel synthesis of dibenzo[b,g] 1, 5-oxazocines[J]. Tetrahedron Letters, 1999, 40(32): 5827-5830.
[36] Fivush A M , Willson T M. AMEBA: An acid sensitive aldehyde resin for solid phase synthesis[J]. Tetrahedron Letters, 1997, 38(41): 7151-7154.
[37] Yan B , Nguyen N , Liu L , et al. Kinetic comparison of trifluoroacetic acid cleavage reactions of resin-bound carbamates, ureas, secondary amides, and sulfonamides from benzyl-, benzhydryl-, and indole-based linkers[J]. Journal of Combinatorial Chemistry, 2000, 2(1): 66-74.
[38] Kaldor S W, Siegel M G, Fritz J E, et al. Use of solid supported nucleophiles and electrophiles for the purification of non-peptide small molecule libraries[J]. Tetrahedron Letters, 1996, 37(40): 7193-7196.
[39] Kaldor S W, Siegel M G. Combinatorial chemistry using polymer-supported reagents[J]. Current Opinion in Chemical Biology, 1997, 1(1): 101-106.
[40] 林超, 张政朴, 朱晓夏. 清除树脂在组合化学中的应用[J]. 化学通报, 2003, 66(8): 536-543.
[41] Creswell M W, Bolton G L, Hodges J C, et al. Combinatorial synthesis of dihydropyridone libraries and their derivatives[J]. Tetrahedron, 1998, 54(16): 3983-3998.
[42] Lin C, Zhang Z P, Zheng J F, et al. Crosslinked polyacrolein microspheres with high loading of aldehyde groups for use as scavenger resins in organic synthesis[J]. Macromolecular Rapid Communications, 2004, 25(19): 1719-1723.
