魔芋葡甘聚糖在离子液体中的均相乙酰化研究
2010-06-04高山俊,万超
目前,石油类不可再生资源日益枯竭,白色污染造成的环境污染日益严重,迫切需要开发天然可降解的高分子材料。魔芋主要分布在东南亚和非洲等地,是一种重要的可食用的健康食品[1]。魔芋葡苷聚糖(KGM)是从魔芋中分离出来的具有类似纤维素和淀粉结构的中性天然多糖[2],具有资源丰富、可再生、可生物降解和价格低廉等优点,且因含有大量羟基而易于引入官能团,因此近年来KGM的相关研究逐渐引起人们的重视。但是KGM分子链呈刚性,没有很好的溶剂,其化学改性一般通过异相反应进行。由于异相反应产率低、反应时间长,寻找KGM的有效溶剂就十分重要。目前,仅发现乙酸异戊酯[3]、蒸馏水[4]、镉乙二胺、NaOH/硫脲[5]、NaOH/尿素[6]溶液能够溶解KGM,但所形成的KGM溶液在室温下均不稳定,迄今为止,还没有在这些溶剂中进行KGM的均相衍生化反应的相关报道。
室温离子液体(RTIL)是一种由正负离子构成的在室温下呈液体状态的新型绿色溶剂。由于其溶解能力强、液态范围广、蒸气压小且热稳定性好,也越来越受到研究者的关注[7]。最近研究发现,很多天然多糖如纤维素、淀粉、玉米蛋白等能够直接溶解在某些咪唑类离子液体中且并无衍生物产生,作者在实验室中也发现室温离子液体1-烯丙基-3-甲基咪唑盐酸盐(AMIMCL)为KGM的真溶剂。作者在此以AMIMCL为溶剂,通过均相反应得到了一系列不同取代度的KGM乙酰化产物,对其结构进行了红外、核磁共振分析,并对其在不同溶剂中的溶解性能进行了研究。
1 实验
1.1 试剂与仪器
N-甲基咪唑,爱斯特(成都)医药技术有限公司;氯丙烯,国药集团化学试剂有限公司;乙酸酐、异丙醇,天津广成化学试剂有限公司;以上试剂均为分析纯。
60SXB型傅立叶变换红处光谱仪,美国Nicolet公司;Varian INOVA-600型核磁共振仪;G3型砂芯漏斗。
1.2 AMIMCL的合成[8]
将22.1 mLN-甲基咪唑和26.9 mL氯丙烯加入到100 mL的三口烧瓶中,在60℃、N2保护、磁力搅拌的条件下回流反应8 h,当回流液滴较少、基本上无回流现象时,停止反应。将得到的产物用无水乙醚混合萃取,除去未反应的N-甲基咪唑。然后将离子液体旋转蒸发,最后在80℃真空干燥箱中干燥48 h,得到透明的淡黄色液体,装入瓶中密封保存备用。
1.3 魔芋葡甘聚糖的均相乙酰化
在小玻璃瓶中称取一定质量的离子液体AMIMCL,然后按照2%的比例称取一定质量的魔芋粉末分散在AMIMCL中,将小瓶密封置于100℃的油浴中磁力搅拌。待魔芋粉末完全溶解后取出,加入一定比例的乙酸酐,密封玻璃瓶。然后在一定的温度下反应一定时间后取出,用异丙醇将所得产品沉淀,通过砂芯漏斗过滤,反复洗涤几次,最后将所得产物放入真空干燥箱中在60℃下干燥4 h。
1.4 取代度的测定
乙酰度(DA)的测定采用美国材料实验学会(ASTM)制定的体积测定方法,通过皂化反应和酸式滴定确定醋酸纤维素中乙酰基团的含量[9,10]。取代度(DS)按下式计算:
1.5 结构分析
将原始KGM和不同取代度的乙酰化KGM粉末分别与KBr混合压片,用傅立叶变换红外光谱仪进行结构特征分析,扫描范围为500~4000 cm-1。
将乙酰化KGM样品以质量分数2%溶解在DMSO-d6中,在室温(25℃)下用核磁共振仪测定1HNMR和13CNMR。
1.6 溶解性能测试
为能更加充分地利用KGM,对原始KGM和所得不同取代度的乙酰化KGM在溶剂二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)、四氢呋喃(THF)中的溶解性能做了相关的研究。
2 结果与讨论
2.1 反应条件对KGM乙酰化的影响
通常,KGM的乙酰化是由乙酸酐在ZnCl2[11]或吡啶[12]为催化剂的条件下通过异相反应进行的。但这种方法的取代度很低,且不能控制乙酰基所取代的位置。作者在无催化剂的条件下以AMIMCL为溶剂通过均相反应获得了一系列取代度较高的乙酰化KGM。不同反应条件所得乙酰化KGM的取代度见表1。
2.1.1 反应时间对取代度的影响
由表1可以看出,当反应温度为80℃、乙酸酐与KGM中羟基的摩尔比为6∶1时,反应时间由0.25 h延长到0.75 h,取代度由1.02迅速增加到2.15;但继续延长反应时间,取代度逐渐减小,反应1.5 h时取代度减小至1.29。这可能是因为,相同的反应条件下,延长反应时间可能增加乙酸酐与KGM分子的接触几率,所以反应时间越长,反应越完全、取代度也越大,但KGM的乙酰化过程是一个可逆反应,在乙酰化的同时脱乙酰化也在进行[13,14],当反应时间超过一定的界限时,脱乙酰化反应占主导地位,如继续延长反应时间,取代度反而有所下降。
2.1.2 反应温度对取代度的影响
由表1可以看出,当反应时间为0.5 h、乙酸酐与KGM中羟基的摩尔比为6∶1时,反应温度从60℃升到80℃,取代度从1.32增加到1.93;但继续升温到100℃,取代度却又下降为1.51。这可能是因为,升高反应温度有利于乙酰化反应的进行,但反应温度过高时,KGM可能发生降解从而脱乙酰基,导致取代度有所下降。
2.1.3 乙酸酐与KGM中羟基的摩尔比对取代度的影响
由表1可以看出,当反应时间为0.5 h、反应温度为80℃时,乙酸酐与KGM中羟基的摩尔比从3∶1增加到9∶1,取代度由1.01增加到2.01;但当摩尔比由9∶1增加到12∶1时,取代度却又有所下降。这可能是因为,乙酸酐的浓度越大,其与KGM分子接触的几率越大,所以增加摩尔比可增大KGM的乙酰化程度,但过多的乙酸酐会破坏离子液体AMIMCL对乙酰化反应的促进作用,所以当乙酸酐与KGM中羟基的摩尔比超过9∶1时取代度反而下降。文献[15]也有类似报道。
2.2 红外光谱分析
图1为原始KGM和乙酰化KGM样品2#、3#、4#和8#的红外光谱图。
由图1可知,原始KGM的红外光谱中,3424 cm-1、2929 cm-1、1739 cm-1、1080 cm-1、871 cm-1和803 cm-1处为KGM的特征峰。其中3424 cm-1处为羟基的吸收峰,2929 cm-1处为KGM分子链中-CH2和-CH3的C-H吸收峰,1739 cm-1处为C=O的吸收峰,从而证明KGM分子中含有乙酰基[16]。1080 cm-1处的吸收峰为吡喃糖环中C-O-C不对称振动的特征峰。871 cm-1和803 cm-1处的吸收峰则为甘露糖的特征吸收峰。与原始KGM对比,乙酰化KGM的红外光谱在1375 cm-1、1245 cm-1处出现了两个新的吸收峰,并且随着取代度的增大1739 cm-1、1375 cm-1和1245 cm-1三处的峰强也逐渐增强。其中1375 cm-1处为-C-H的振动吸收峰,这是由乙酰基团的加入增强了-C-CH3处的振动所导致的。并且随着取代度的增大乙酰基对-C-CH3的影响越大,此处吸收强度也越大。1245 cm-1处的吸收峰为乙酰基团中C-O的特征吸收峰。1739 cm-1、1375 cm-1和 1245 cm-1这三处峰的出现和增强表明KGM的乙酰化反应成功进行。

图1 原始KGM与不同取代度乙酰化KGM样品2#、3#、4#、8#的红外图谱
2.3 1HNMR和 13CNMR分析
为了进一步了解KGM乙酰化后的结构,对9#样品(取代度为2.01)进行1HNMR和13CNMR分析,其图谱分别见图2、图3。

图2 乙酰化KGM(样品9#)的1HNMR图谱

图3 乙酰化KGM(样品9#)的 13CNMR图谱
由图2可知,在化学位移δ=2.04 ppm处的峰对应为与乙酰基相连甲基上的氢原子。由图3可知,在化学位移δ=170.4~170.9 ppm处的峰对应为羰基中的碳原子,而在δ= 21.19 ppm处的峰则对应为乙酰基中的碳原子。因此通过1HNMR和13CNMR图谱再度表明乙酰基团的成功引入,从而证明KGM在AMIMCL中成功进行了乙酰化。
2.4 溶解性能(表2)
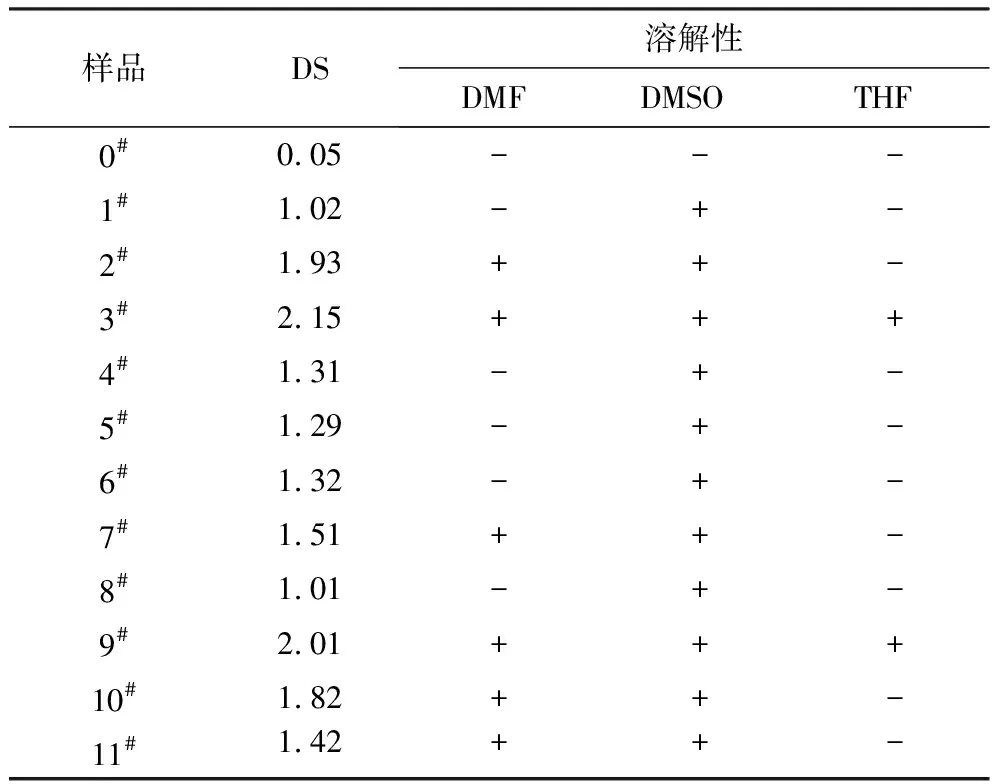
表2 原始KGM和乙酰化KGM样品在不同溶剂 中的溶解性能
从表2可以看出,原始KGM均不溶于DMF、DMSO和THF这三种有机溶剂;取代度大于1.01的所有乙酰化产物均溶解于DMSO,并且随着取代度的增大溶解越来越容易;在DMF中,取代度低于1.32的乙酰化产物溶胀但不溶解,当取代度达到1.42后产物开始缓慢溶解,并随着取代度的增大溶解性能也越来越好;而在THF中,取代度达到2.01后产物才开始慢慢溶解。
3 结论
通过红外、1HNMR 和13CNMR光谱对原始KGM及其乙酰化产物进行结构分析,表明在离子液体中,KGM在无催化剂的条件下成功进行均相乙酰化反应,获得了一系列不同取代度的乙酰化产物。反应温度、反应时间、乙酸酐与KGM中羟基的摩尔比均对乙酰化KGM的取代度有影响,当反应时间为0.75 h、反应温度为80℃、乙酸酐与KGM中羟基的摩尔比为6∶1时,可达到最高取代度2.15。与以往所用ZnCl2或吡啶作催化剂的异相乙酰化相比,在AMIMCL中均相乙酰化不仅可取得较高的取代度、更加环保,并且所用 AMIMCL可以回收重复使用。基于离子液体的这些优点,推断KGM在AMIMCL中也可进行其它酯化、醚化、接枝等一系列的均相反应,有待进一步研究。
参考文献:
[1] Xiao Chaobo,Gao Shanjun,Zhang Lina.Blend films from konjac glucomannan and sodium alginate solutions and their preservative effect[J].Journal of Applied Polymer Science,2000,77(3):617-626.
[2] Nishinari K,Williams P A,Phillip G O.Review of the physico-chemical characteristics and properties of konjac mannan[J].Food Hydrocolloid,1992,6(2):199-222.
[3] Torigata,Inagaki H,Kitano N.Study of konjac mannan IV.Molecular weight and molecular form of nitrated konjac mannan[J].Nippon Kagaku Zasshi,1951,73:30-32.
[4] Yu Huiqun,Huang Yihong,Ying Hou,et al.Preparation and char-acterization of a quaternary ammonium derivative of konjac glucomannan[J].Carbohydrate Polymers,2007,69(1):29-40.
[5] Yang Guang,Xiong Xiaopeng,Zhang Lina.Microporous formation of blend membranes from cellulose/konjac glucomannan in NaOH/thiourea aqueous solution[J].Journal of Membrane Science,2002,201(1-2):161-173.
[6] Gao Shanjun,Wu Chengdong,Nishinari Katsuyoshi.In situ pH-d-ecrease induced gelation of carboxymethylated konjac glucomannan / sodium alginate[J].Appl Polym Sci,2008,108(5):2825-2832.
[7] Forsyth S A,MacFarlane D R,Thomson R J,et al.Rapid,clean,and mildO-acetylation of alcohols and carbohydrates in an ionic liquid[J].Chem Commun,2002,(7):714-715.
[8] Zhang Hao,Wu Jin,Zhang Jun,et al.1-Allyl-3-methylimidazolium chloride room temperature ionic liquid:A new and powerful nonderivatizing solvent for cellulose[J].Macromolecules,2005,38(20):8272-8277.
[9] Tanghe L J,Genung L B,Mench W J.Determination of acetyl content and degree of substitution of cellulose acetate[J].Methods in Carbohydrate Chemistry,1963,(3):201-203.
[10] ASTM Designation D-871-61T,Tentative methods of testing cellulose acetate[S].
[11] Huang L,Takahashi R,Kobayashi S T,et al.Gelation behavior of native and acetylated konjac glucomannan[J].Biomacromolecules,2002,3(6):1296.
[12] Gao Shanjun,Nishinari Katsuyoshi.Effect of degree of acetylation on gelation of konjac glucomannan[J].Biomacromolecules,2004,5(1):175-185
[13] Liu Zhaotie,Shen Lihong,Liu Zhongwen,et al.Acetylation ofβ-cyclodextrin in ionic liquid green solvent[J].Mater Sci,2009,44(7):1813-1820.
[14] Adebajo Moses O,Frost Ray L.Acetylation of raw cotton for oil spill cleanup application: An FTIR and13C MAS NMR spectroscopic investigation[J].Spectrochimica Acta Part A,2004,60(10):2315-2321.
[15] Wu Jin,Zhang Jun,Zhang Hao,et al.Homogeneous acetylation of cellulose in a new ionic liquid[J].Biomacromolecules,2004,5(2):266-268.
[16] Maeda M,Shimahara H,Sugiyamsa N.Detailed examination of the branched structure of konjac glucomannan[J].Agric Biol Chem,1980,44(2):245-252.
