几丁质酶高产菌的筛选及其产酶条件的优化研究
2010-06-04邓红梅,毕方铖,叶炬斌等
几丁质(Chitin)又名甲壳素,广泛存在于虾、蟹等甲壳动物的外壳中,是虾、蟹等甲壳动物可食用部分外的主要废弃物,自然界每年的产量估计约100亿t,是我国近海海域主要的有机污染源之一,同时又是一种用之不竭的生物资源。几丁质被誉为人体所必需的第六生命要素,其衍生物低分子量几丁寡糖因具有多种生物活性,可用于治疗艾滋病、癌症及心血管疾病,在口腔医学和人体保健等领域也有着广泛的应用[1,2]。几丁质酶产生菌是一类能利用几丁质作为碳源而生存、繁殖的特殊的微生物群体,它能通过分泌几丁质酶降解几丁质为几丁寡糖、几丁二糖直至几丁单糖,直接被人体吸收利用,从而使几丁质用途更加广泛。茂名是一个海滨城市,虾、蟹资源非常丰富,虾、蟹壳等废弃物一直影响着茂名地区的生态环境。作者在此筛选了一株几丁质酶活力高的菌株并对其产酶条件进行优化,拟为 “渔业垃圾”虾、蟹等甲壳动物的外壳的再生利用提供理论基础。
1 实验
1.1 土样及试剂
5份土样采自茂名沿海地区。
几丁质粉,上海市生物制品有限公司;其它试剂均为国产分析纯。
1.2 培养基
平板分离培养基(g·L-1):胶体几丁质5,K2HPO40.7,KH2PO40.3,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01,琼脂 15,pH值7.0,蒸馏水定容至1 L。
LB培养基(种子培养基,g·L-1):蛋白胨10,酵母膏 5,氯化钠10,pH值7.0,蒸馏水定容至1 L。
摇瓶发酵培养基(g·L-1):细粉几丁质5,蛋白胨10, K2HPO40.7,KH2PO40.3,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01, pH值7.0,蒸馏水定容至1 L。
1.3 胶体几丁质的制备
称取10 g几丁质粉末,加入40 mL丙酮,充分研磨至糊状。在低温下边研磨边慢慢加入浓盐酸400 mL,几分钟后,用玻璃棉过滤,在剧烈搅拌下将滤液缓缓加入到剧烈搅拌的50%乙醇(至少是滤液的5 BV以上)中,使胶体几丁质沉淀析出,离心收集胶体几丁质,用蒸馏水冲洗几次,置透析袋过夜,避光保存在冰箱中。
1.4 菌种筛选方法
采用平板稀释法。取土样1 g,用无菌水以10倍梯度稀释成10-1~ 10-6稀释液,取10-4~10-6稀释液0.1 mL涂几丁质平板,在30℃下培养3~5 d。挑取产透明圈直径与菌落直径比最大的菌株纯化培养并保存待用。
按照常规细菌学方法[3]鉴定到属。
1.5 产酶条件实验方法
取30 mL种子培养基置于 250 mL三角瓶中,接入1~2环斜面菌种,30℃、180 r·min-1振荡培养2 d作为种子。以2%接种量接入各个实验的培养基中,除另有说明外,产酶实验条件均为30℃、180 r·min-1培养72 h,每一实验3次平行。发酵培养液经过4层纱布过滤,再于6000 r·min-1离心10 min,除去沉淀,得粗酶液,测定酶活力。
采用L9(34)正交实验优化产酶条件,正交实验的因素与水平见表1。

表1 正交实验的因素和水平
1.6 酶活力测定方法
酶活力测定用DNS法[4,5]。取1 mL发酵上清液加入1 mL含1%胶体几丁质的磷酸缓冲溶液(pH值7.0),50℃保温 1 h,加入1 mL 3,5-二硝基水杨酸试剂中止反应,沸水浴5 min,冰浴冷却,离心后取上清
液通过紫外分光光度计在波长200~700 nm范围内全波扫描,得到最大吸收波长为470 nm。以不含胶体几丁质的上清液为对照,测吸光度,根据标准曲线计算产生的N-乙酰氨基葡萄糖 (NAG)的量。
酶活单位定义:在特定条件下,每分钟水解几丁质产生相当于1 μmolN-乙酰氨基葡萄糖的还原糖所需的酶量。
2 结果与讨论
2.1 产几丁质酶菌株的筛选与初步鉴定
实验分离得到4株产透明圈较大的菌株,选取产生透明圈最大(透明圈与菌落直径比2.16)、最稳定的一株命名为X,其菌落圆形,淡黄色,不透明,中央凸起,边缘整齐(图1a)。在显微镜下观察,该菌为短杆状,长0.7~1.0 μm,无鞭毛(图1b),该菌的芽孢形态为圆形或卵圆形(图1c)。
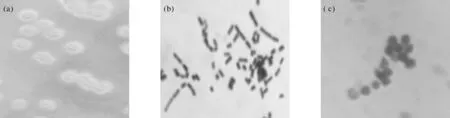
图1 菌株X的菌落形态和透明圈(a)、显微镜下的形态(b)、芽孢在显微镜下的形态(c)
菌株X的生理生化特征见表2。

表2 菌株X 的生理生化特征
综合图1、表1结果可知,菌体直杆状,革兰氏阳性,长0.7~1.0 μm,无鞭毛不可运动,好氧型,菌落形态为圆形,淡黄色,不透明,菌落边缘整齐,中间隆起,接触性酶反应阴性,V-P和甲基红试验呈阴性,有芽孢及营养体。糖酵解反应中产酸不产气,符合短芽孢杆菌属(Brevibacillusshida,Agri,1996)[3]的一般特征。
2.2 培养时间对菌株X产酶的影响
以2%接种量接种于发酵培养基,培养至24 h开始,每隔12 h取样品测酶活,结果见图2。
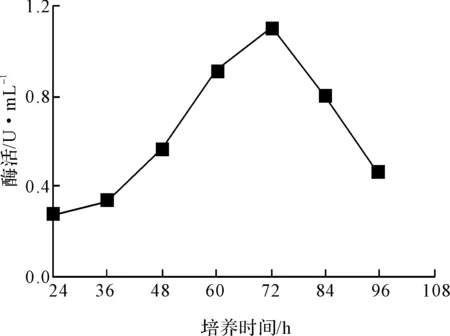
图2 培养时间对菌株X产酶的影响
由图2可知,菌株X产酶活性在培养72 h 时达到最大值,此后随着培养时间的延长,酶活迅速下降。后续实验均培养至72 h测定酶活。
2.3 温度对菌株X产酶的影响
以2%接种量接种于发酵培养基,分别在25℃、30℃、35℃、40℃下培养72 h,测酶活,结果见图3。
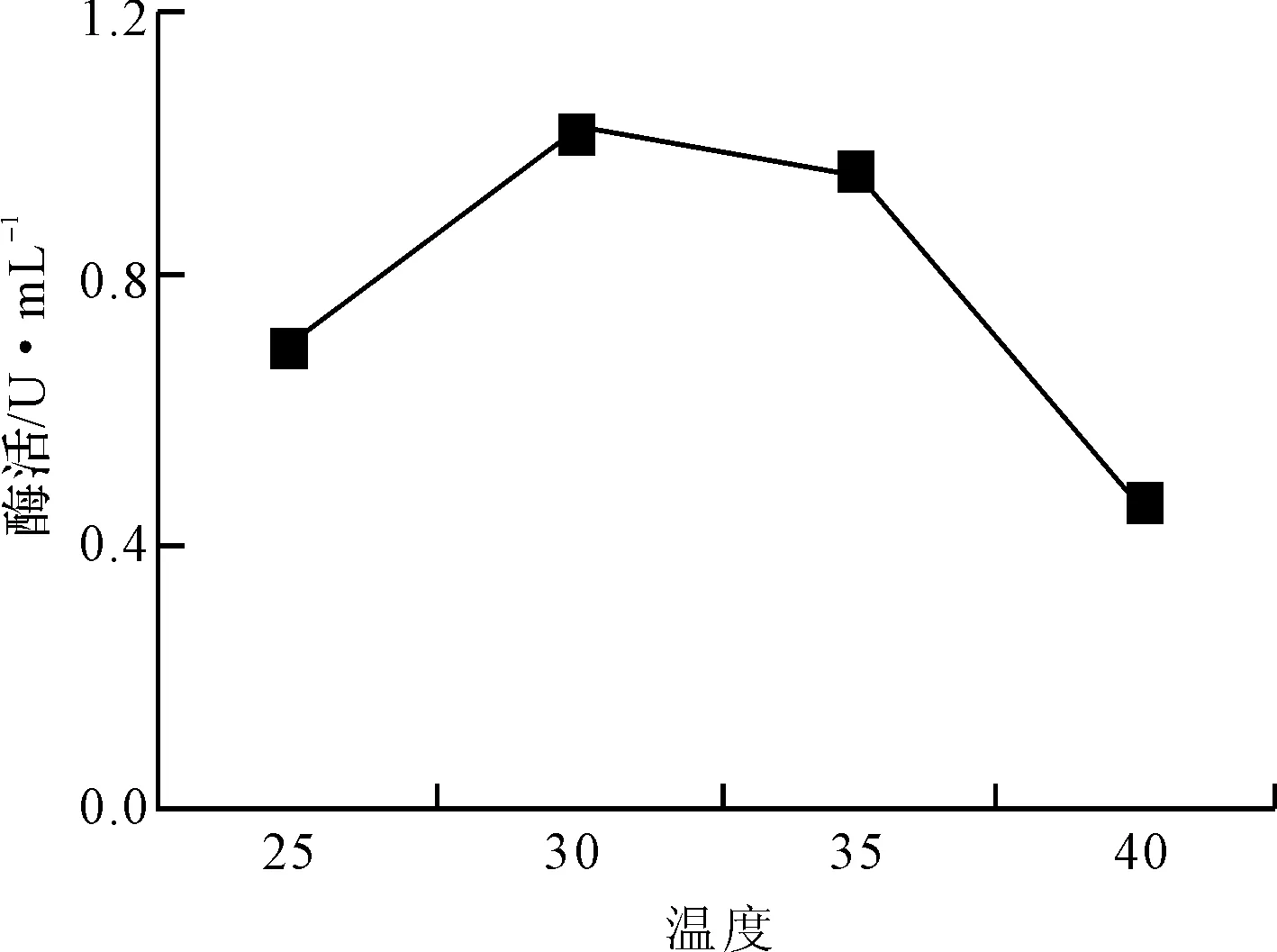
图3 温度对菌株X产酶的影响
由图3可知,菌株X在30~35℃温度范围内产酶活性较高,且较稳定。最适产酶温度在30℃,酶活达1.02 U·mL-1,在40℃时菌株产酶活性最低。表明菌株X较适宜在低温环境中产酶,过高的温度会抑制其产酶活性。
2.4 初始pH值对菌株X产酶的影响
以2%接种量接种于初始pH值分别为4.0、5.0、6.0、7.0、8.0的发酵培养基中,培养72 h,测酶活,结果见图4。

图4 初始pH值对菌株X产酶的影响
由图4可知,菌株X在初始pH值为7.0时产酶活性达到最大,酶活达1.08 U·mL-1,其次是pH值为8.0,表明菌株比较适合在弱碱性环境中产酶,这与许多文献报道相一致[6,7]。pH值为4.0时产酶活性最低,可能是因为pH值过低会抑制菌株的产酶活性。
2.5 氮源对菌株X产酶的影响
以2%接种量接种于以细粉几丁质为唯一碳源,分别以2%蛋白胨、2%牛肉膏、2%硫酸铵、2%硝酸铵为氮源的发酵培养基中,培养72 h,测酶活,结果见图5。
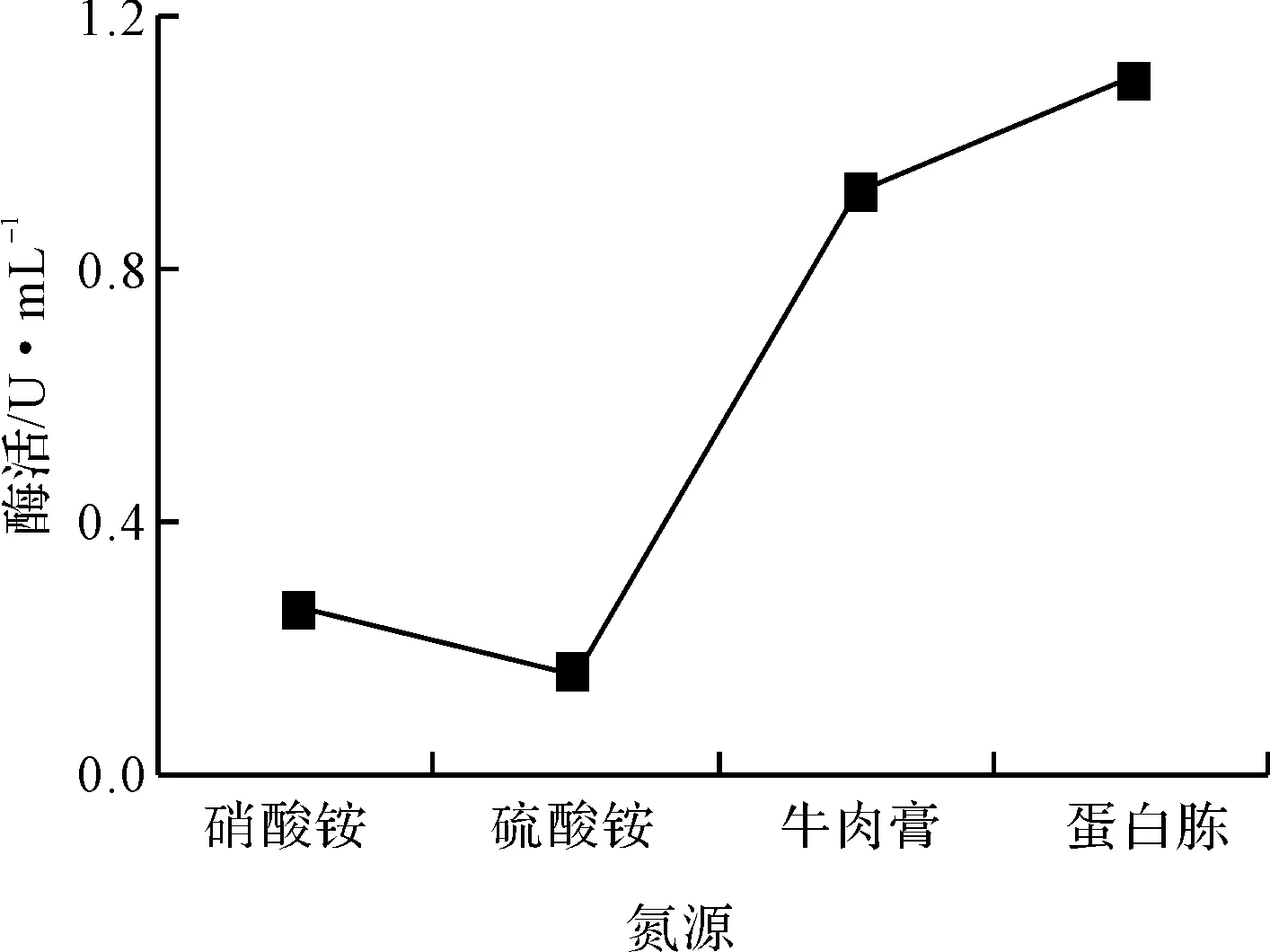
图5 氮源对菌株X产酶的影响
由图5可知,菌株X在以蛋白胨为氮源的培养基中产酶情况最好,酶活达1.10 U·mL-1。其次是牛肉膏。以硫酸铵、硝酸铵为氮源时产酶较差,说明菌株X在有机氮源中易产酶,特别是对蛋白胨的利用率最高,却不能较好地利用无机氮源。
2.6 碳源对菌株X产酶的影响
以2%接种量接种于以蛋白胨为唯一氮源,分别以2%细粉几丁质、2%胶体几丁质、2%葡萄糖、2%淀粉为碳源的发酵培养基中,培养72 h,测酶活,结果见图6。

图6 碳源对菌株X产酶的影响
由图6可知,菌株X在不同碳源的培养基中均可产酶,以细粉几丁质、胶体几丁质为碳源时产酶较好,其中以细粉几丁质为碳源时最好,酶活达1.08 U·mL-1,而以葡萄糖和淀粉为碳源时产酶效果较差。这可能是因为细粉几丁质或胶体几丁质可作为菌株生长所需的碳源。说明该菌株所产的几丁质酶为一种诱导酶,几丁质或其衍生物可以充当诱导物[8]。而葡萄糖可能有阻遏作用。
2.7 菌株X产酶条件的优化
在单因素优化实验的基础上,设计了L9(34)正交实验对最佳产酶碳源(细粉几丁质)、氮源(蛋白胨)、初始pH值和温度之间的交互作用做了进一步的研究。正交实验的结果与分析见表3。

表3 正交实验结果与分析
由表3可以看出,各因素对产酶影响大小依次为D>C>A>B,即影响最大的是碳源,其次是氮源,再次是温度,最小是pH值。可能是由于碳源、氮源都是菌株产酶所必需的物质,所以影响最大。菌株X的最适产酶组合为A1B2C1D2,即温度为30℃、pH值为7.0、细粉几丁质10 g·L-1、蛋白胨10 g·L-1。
2.8 优化条件下菌株X的产酶活性
取培养2 d的菌种的种子培养液,按2%的接种量接入以10 g·L-1细粉几丁质为唯一碳源、10 g·L-1蛋白胨为唯一氮源的发酵培养液中,在pH值7.0、30℃、180 r·min-1条件下振荡培养72 h,发酵培养液经过4层纱布过滤再于6000 r·min-1离心10 min,除去沉淀,得粗酶液,测得酶活为1.24 U·mL-1、1.25 U·mL-1、1.25 U·mL-1,平均酶活约1.25 U·mL-1,比条件优化前有较大提高。
3 结论
(1)通过平板透明圈法初筛、复筛,从土壤中获得一株透明圈最大(透明圈与菌落直径比2.16)、最稳定的菌株X。根据菌株和菌落的形态以及生理生化特征,初步判断该菌为短芽孢杆菌属(Brevibacillusshida.Agri)。
(2)菌株X培养72 h 时产酶达高峰。单因素实验和正交实验表明,各因素对产酶的影响大小依次为碳源>氮源>温度>pH值,即影响最大的是碳源,其次是氮源,再次是温度,最小是pH值。菌株X产几丁质酶的最佳条件为:温度30℃、pH值7.0、细粉几丁质10 g·L-1、蛋白胨10 g·L-1。在此优化条件下几丁质酶活达1.25 U·mL-1。
参考文献:
[1] 关海宁,徐桂花,刁小琴.微生物产几丁质酶的研究概况及其应用[J].中国食物与营养,2006,(8):33-35.
[2] 郑志成,周美英,姚炳新.蜂房芽孢杆菌B-91几丁质酶的合成条件[J].厦门大学学报(自然科学版),1995,34(3):447-451.
[3] 陈秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:58-61.
[4] 陶刚,刘杏忠,王革,等.产几丁质酶木霉生防菌株的生化测定[J].西南农业学报,2005,18(4):452-455.
[5] Miller G L.Use of dinitrosalic acid regent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-428.
[6] 王海东,陈飚,伦镜盛,等.产几丁质酶菌株SWCH-6的筛选、鉴定及其产酶条件的优化研究[J].微生物学通报,2008,35(5):705-711.
[7] 张荣奎,贺淹才,刘爱花,等.土壤产几丁质酶菌株的筛选鉴定及产酶条件[J].华侨大学学报(自然科学版),2007,28(2):178-181.
[8] 曹军卫,马辉文,张甲耀.微生物工程(第二版)[M].北京:科学出版社,2007:22-50.
