葡萄糖氧化酶法筛选西洋参干预胰岛素抵抗脂肪细胞模型的活性成分
2010-06-02葛鹏玲李冀马育轩尚广巍
葛鹏玲,李冀,马育轩,尚广巍
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
胰岛素抵抗(IR)是由遗传和环境因素导致的机体对胰岛素生理作用的反应性降低。即胰岛素促进葡萄糖摄取作用受损,导致代偿性胰岛素分泌增多,其重要标志为高胰岛素血症[1]。主要表现为外周组织对胰岛素敏感性下降,对葡萄糖的利用障碍[2]。
本实验通过葡萄糖消耗试验测定西洋参单体成分对IR脂肪细胞模型葡萄糖消耗量的影响,筛选西洋参干预胰岛素抵抗的有效成分。从而为进一步探讨其作用机制及开发新药奠定基础。
1 材料及方法
1.1 细胞株
小鼠3T3-L1前脂肪细胞株来源于American Type Culture Collection(ATCC),由中国医学科学院协和医科大学细胞中心提供。
1.2 仪器与试剂
胰岛素(诺和诺德公司);地塞米松(Sigma公司);异丁基—甲基—黄嘌呤(Sigma公司);牛血清白蛋白(BSA,澳大利亚ST1006);DMEM培养液(Gibco公司);葡萄糖氧化酶法测定试剂盒(上海伊华生物科技有限公司);荧光显微镜(OLYMPUS IX71);CO2培养箱(Forma Scientific);超净工作台(上海造鑫企业有限公司);酶标仪(TECAN公司)。
1.3 西洋参单体成分的分离
将西洋参的根部用70%EtOH回流提取,将此提取物进行AB-8型大孔树脂柱色谱分析,按不同浓度洗脱,得到西洋参95%醇提组、西洋参60%醇提组、西洋参30%醇提组和水提组四个部分。前期药效学试验证明,西洋参60%醇提组为活性部位。再将西洋参60%醇提部位用硅胶柱色谱及HPLC等分离技术与方法分离和纯化,通过理化常数及光谱数据确定其结构。共得12个化合物。
1.4 3T3-L1前脂肪细胞培养及诱导分化
培养:3T3-L1前脂肪细胞可经定向诱导分化为成熟的脂肪细胞。3T3-L1脂肪细胞培养包括培养、传代、冻存、复苏及诱导分化过程。将3T3-L1前脂肪细胞种入25cm2细胞培养瓶,加入含10%优级小牛血清及青、链霉素的高糖(25mmol·L-1glucose)DMDM培养液4~5mL,置37℃细胞孵育箱中,5%CO2条件下培养,每2d换1次培养液。每天观察细胞生长情况,细胞生长至80%满后进行传代或冻存。
分化:3T3-L1前脂肪细胞生长至接触抑制,待细胞汇合2天后加0.05mmol·L-13-异丁基-1-甲基黄嘌呤(IBMX),1mmol·L-1地塞米松,10mg·L-1胰岛素和10%小牛血清的高糖培养基培养48h,10mg·L-1胰岛素和10%小牛血清的高糖培养基培养48h,10%小牛血清的高糖培养基培养,2d换1次培养液,8~12d细胞90%以上呈成熟脂肪细胞表形。
1.5 葡萄糖氧化酶法测培养基中葡萄糖浓度
1瓶葡萄糖工作试剂加100mL ddH2O,振荡混匀;96孔板中每孔取8μL培养液,加入含1mL工作试剂的试管中,振荡混匀,另取标准液8μL,加入含1mL工作试剂的试管中;37℃水浴20min;每试管取100μL混合液,加入96孔酶标板中;酶标仪在510nm处测吸光光度值(OD值);根据公式计算待测液葡萄糖浓度。待测葡萄糖浓度(mmol·L-1)=待测液OD值/标准液 OD 值 ×5.5mmol·L-1。
1.6 统计学处理
2 实验结果
2.1 成熟脂肪细胞诱导
光镜下3T3-L1前脂肪细胞形态与成纤维细胞相似,呈长梭型,细胞内没有脂肪积聚,诱导分化后,细胞形态变圆,胞浆出现脂滴,随着分化程度的加深,脂滴积聚增多。诱导分化8d后,90%以上呈成熟脂肪细胞表形,胞浆内有大量的脂滴,如图1所示。

图1 脂肪细胞
2.2 胰岛素抵抗脂肪细胞模型的建立及鉴定
将24孔培养板中分化成熟的脂肪细胞,以含1%BSA的低糖DMEM培养基培养12h后,分为正常葡萄糖正常胰岛素组(5.5mmol·L-1葡萄糖,1×10-9mol·L-1胰岛素)及高葡萄糖高胰岛素组(25mmol·L-1葡萄糖,1 ×10-6mol·L-1胰岛素),每组7个样本。干预24h后,通过葡萄糖消耗试验测定两组脂肪细胞葡萄糖消耗量的情况。
表1 高糖高胰岛素对葡萄糖消耗量的影响(±s,n=7)

表1 高糖高胰岛素对葡萄糖消耗量的影响(±s,n=7)
注:与正常组比较,★P<0.01;RG-葡萄糖剩余量,CG-葡萄糖消耗量。
2.70±0.15 2.80±0.15高糖高胰岛素组 4.21±0.22★ 1.29±0.22正常组★
如表1所示,与正常葡萄糖正常胰岛素组葡萄糖消耗量比较,高葡萄糖高胰岛素组葡萄糖消耗量明显下降,差异极显著(P<0.01),说明应用此法可建立胰岛素抵抗细胞模型。
2.3 西洋参单体成分对胰岛素抵抗脂肪细胞模型葡萄糖消耗量的影响
实验分为空白对照组、模型组、西洋参单体成分组(12)及罗格列酮组。干预培养24h后,通过葡萄糖消耗试验测定西洋参单体成分对IR脂肪细胞模型葡萄糖消耗量的影响,筛选西洋参干预胰岛素抵抗的活性成分。
表2 药物对IR细胞模型葡萄糖消耗量的影响(±s,n=7)
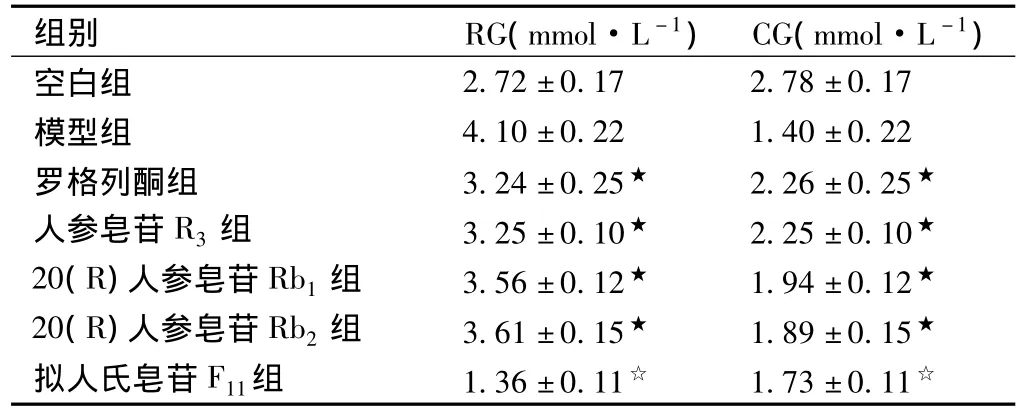
表2 药物对IR细胞模型葡萄糖消耗量的影响(±s,n=7)
注:与模型组比较,☆P<0.05,★P<0.01。
2.72±0.17 2.78±0.17模型组 4.10±0.22 1.40±0.22罗格列酮组 3.24±0.25★ 2.26±0.25★人参皂苷R3组 3.25±0.10★ 2.25±0.10★20(R)人参皂苷Rb1组 3.56±0.12★ 1.94±0.12★20(R)人参皂苷Rb2组 3.61±0.15★ 1.89±0.15★拟人氏皂苷F11组 1.36±0.11☆ 1.73±0.11空白组☆
实验结果如表2所示,与模型组细胞葡萄糖消耗量比较,罗格列酮组、人参皂苷R3组、20(R)人参皂苷Rb1组、20(R)人参皂苷Rb2组、拟人参皂苷F11组细胞葡萄糖消耗量有不同程度的升高,其中人参皂苷R3组、20(R)人参皂苷Rb1组、20(R)人参皂苷Rb2组、罗格列酮组葡萄糖消耗量明显升高,差异极显著(P<0.01),拟人参皂苷F11组差异显著(P<0.05)。其余化合物组与模型组比较,葡萄糖消耗量无统计学差异。提示,20(R)人参皂苷 Rb1,20(R)人参皂苷 Rb2,人参皂苷R3,拟人参皂苷F11可能为西洋参干预胰岛素抵抗脂肪细胞模型的活性成分。
3 讨论
细胞模型相对于动物模型具有重复性好、造模周期短、外界影响因素易于控制的优点。建立胰岛素抵抗的细胞模型,不仅广泛应用细胞水平研究胰岛素抵抗的发病机制,尤其适用于改善胰岛素抵抗药物的筛选及其机制研究。
1988年,Reaven[3]提出的胰岛素抵抗定义为胰岛素靶细胞对胰岛素介导的葡萄糖摄取及利用的抵抗,它反映的是胰岛素的糖代谢效应。在细胞实验中,对胰岛素敏感性的评价主要采用胰岛素刺激下对同位素标记的脱氧葡萄糖的摄取。但此法成本高、毒害作用大。葡萄糖氧化酶法测定脂肪细胞培养基中的葡萄糖消耗量,相对污染小、经济方便、优越性明显,可作为评价胰岛素敏感性的良好手段。
本实验通过葡萄糖消耗试验测定西洋参单体成分对IR脂肪细胞模型葡萄糖消耗量的影响,与模型组细胞葡萄糖消耗量比较,罗格列酮组、人参皂苷R3组、20(R)人参皂苷Rb1组、20(R)人参皂苷Rb2组、拟人参皂苷F11组细胞葡萄糖消耗量有不同程度的升高,20(R)人参皂苷 Rb1,20(R)人参皂苷 Rb2,人参皂苷R3,拟人参皂苷F11可能是西洋参干预胰岛素抵抗脂肪细胞模型的活性成分。
[1]李冀,马育轩,高彦宇,等.中医药对2型糖尿病胰岛素抵抗的研究进展[J].中医药信息,2009,26(3):5-7.
[2]李冀,马育轩,葛鹏玲,等.西洋参治疗胰岛素抵抗大鼠活性部位对骨骼肌转运蛋白-4mRNA表达的影响[J].中医药学报,2009,37(5):9-11.
[3]Reaven GM.Role of insulin resistance in human diseases[J].Diabetes,1988,37(12):1595-1607.
