DL-乙硫氨酸诱导大鼠肝细胞脂肪变性病理模型研究
2010-06-01汪恩强马玉忠徐丽娜
高 颖,汪恩强,马玉忠,徐丽娜
(河北农业大学动物科技学院,河北保定071001)
肝脏所含脂质绝大部分为甘油三酯(triglyceride,TG),各种致病因素可导致肝细胞内 TG异常堆积而导致脂肪肝(fatty liver,FL)的发生,同时伴随肝脏功能紊乱[1]。脂肪肝的发病机制是极其复杂的,它的发生与肝脏TG输出的相对不足和绝对不足而导致肝脏脂质大量堆积有关[2-3],至今尚不完全清楚。为更好的研究脂肪肝,首先要建立理想的研究模型。目前,对动物脂肪肝的研究主要采用动物体内模型,存在个体差异较大,试验条件不易控制,整体影响因素众多、周期较长等缺点,而细胞模型试验却可以很好的克服上述缺点,并且能针对性探究脂肪肝发病的细胞机理[4-5]。本文利用DL-乙硫氨酸诱导大鼠肝细胞,对药物导致肝细胞脂肪变性病理模型进行研究。
1 材料与方法
1.1 实验动物 SD大鼠,雄性,体重100~150g,清洁级,由河北省实验动物中心提供。
主要试剂和仪器:预灌流液、细胞洗液,参照参考文献[6]配制;RPMI-1640培养基(Gibco公司);胎牛血清(杭州四季青生物工程材料有限公司);胶原酶Ⅳ(Sigma公司);DL-乙硫氨酸(北京恒业中远公司);油红O(分析纯)(上海化学试剂采购供应站分装厂);苏木色精(北京化工厂);丙氨酸氨基转移酶(ALT)试剂盒、天门冬氨酸氨基转移酶(AST)试剂盒、甘油三酯(TG)试剂盒(中生北控生物科技股份有限公司)。二氧化碳恒温培养箱(日本SANYO公司);超净工作台(德国Heraeus公司);倒置相差显微镜成像系统(OLYMPUS公司);光学显微镜成像系统(JVC公司);6孔细胞培养板(NUNC公司);A-6型半自动生化分析仪(北京松上技术有限公司)。
1.2 原代肝细胞分离培养[7-9]按二步灌流法获取肝细胞后,用200目尼龙网布过滤,收集过滤液,以800 r/min离心3 min,去掉上清液,加入 RPMI-1640培养基使细胞重新悬浮,吹打几次混匀,再离心,如此重复2次。计数细胞总数和细胞活力,稀释细胞密度至1.5×105个/mL,铺于6孔板中,每孔放置一块灭菌的盖玻片,置于二氧化碳恒温培养箱中,培养24 h。
1.3 DL-乙硫氨酸处理大鼠肝细胞 待细胞贴壁,培养24 h后,用倒置相差显微镜观察细胞生长情况。将贴壁生长良好的肝细胞分为对照组,5.0 mmol/L DL-乙硫氨酸处理模型组,不换液培养48 h。
1.4 脂肪变性肝细胞染色和分析 培养48 h后,吸掉培养基,取出盖玻片,同时用冷的 PBS(pH 7.2)冲洗盖玻片3次,10%中性甲醛固定30 min,用油红O染色,光学显微镜成像系统观察拍照。按Wada方法进行脂质染色半定量分析,每一块玻片计数100个细胞。所有数据均以表示,采用SPSS 13.0软件进行单因子方差分析(One-Way ANOVA),0.01<P<0.05有统计学差异,P<0.01有极显著性差异。
1.5 生化指标测定 利用生化分析仪分别测定对照组和模型组48h细胞培养基上清液中的ALT,AST活性以及细胞裂解液中的TG含量,方法参照各试剂盒操作说明书进行测定。所有数据均以±S表示,采用SPSS 13.0软件进行单因子方差分析。
2 结果
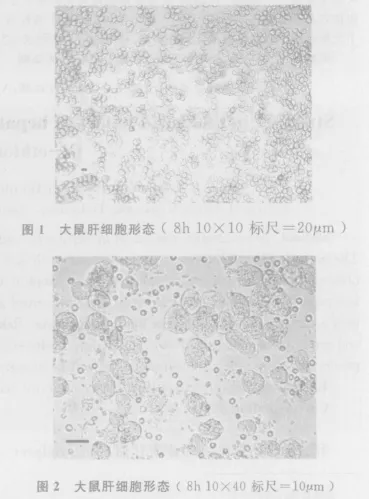
2.1 肝细胞分离与培养 倒置显微镜下,新分离的肝细胞呈圆形或椭圆形,胞浆透亮,多成单个分散状态,少量成团。用0.4%台盼蓝拒染计数显示,95%细胞排斥染色。细胞接种数小时后,开始贴壁,生长良好,细胞为球形,边界轮廓清晰(图1,图2)。
2.2 脂肪变性肝细胞染色与分析 光学显微镜下观察,对照组细胞边缘清晰、核大、细胞内少见橘红色脂滴,颜色浅(图3);模型组细胞内可见许多橘红色的脂滴存在,且大部分细胞内含多个脂滴,有的地方染色后模糊成片,颜色深,有的细胞膜边缘已不完整,与对照组比较有显著差异(图4)。Wada方法进行脂质染色半定量分析统计结果(表1),统计数据代表细胞脂滴的面积等于或大于细胞核的面积的细胞,模型组与对照组比较有极显著差异(P<0.01)。
2.3 DL-乙硫氨酸作用48 h后ALT,AST活性与TG含量 用DL-乙硫氨酸处理贴壁培养的大鼠肝细胞后,均出现不同程度的细胞损伤。肝细胞培养基上清液中生化指标测定结果显示,作用48 h时,
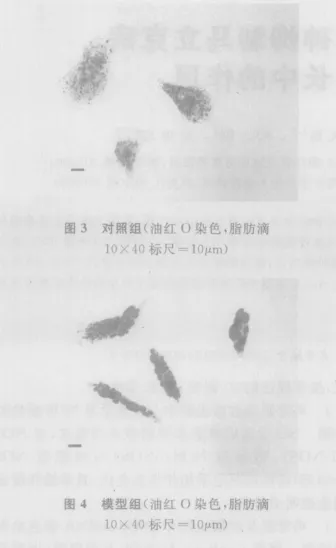
表1 DL-乙硫氨酸对培养的肝细胞作用48 h后Wada方法分析结果(±S,n=6)

表1 DL-乙硫氨酸对培养的肝细胞作用48 h后Wada方法分析结果(±S,n=6)
**:差异极显著,P<0.01
?
模型组ALT,AST活性升高,与对照组比较差异显著(P<0.01,P<0.05)。模型组细胞裂解液中TG含量升高,与对照组比较差异极显著(P<0.01)(表2)。
3 讨论
脂肪肝模型建立是否成功,主要看其肝细胞的病理形态与TG含量的变化。在培养基中添加DL-乙硫氨酸培养大鼠肝细胞,发现细胞模型都有一个共同特征:细胞内的TG含量增加了,油红O染色在光学显微镜下显示为橘红色脂肪滴颗粒,符合脂肪化肝细胞特点,表明DL-乙硫氨酸作用于肝细胞,能够使肝细胞脂质代谢紊乱,从生化指标数据看出,TG从0.179 mmol/L增加到1.361 mmol/L,说明细胞内有大量TG聚集,造模成功。细胞膜完整性受到破坏,转氨酶就会从受损的肝细胞内释放到培养基中。模型组培养基中ALT,AST的活性比对照组的活性明显增高,说明DL-乙硫氨酸破坏细胞膜完整性,这在细胞染片中也可反映出来。
生物膜是细胞的基本结构,具有保护细胞的作用。在本细胞水平试验中,模型组培养基中ALT,AST的活性比正常组的活性明显增高,说明各浓度DL-乙硫氨酸对肝细胞有一定损伤,同时出现细胞内TG积聚现象,与动物水平的试验性脂肪肝基本一致,相对动物试验而言,细胞试验的影响因素少,可行性高。故认为,细胞水平的试验可以作为动物水平试验的补充,二者的有机结合,将为进一步研究脂肪肝的发病机制以及临床治疗药物的筛选提供有效的途径。
总之,DL-乙硫氨酸可诱导肝细胞脂肪变性,引起细胞浆中脂肪滴含量增加,从而建立大鼠脂肪肝药物损伤的体外模型,为在细胞水平筛选治疗脂肪肝药物提供参考模型。
表2 DL-乙硫氨酸对培养的肝细胞作用48 h后ALT、AST和TG的影响(±S,n=6)

表2 DL-乙硫氨酸对培养的肝细胞作用48 h后ALT、AST和TG的影响(±S,n=6)
*:差异显著,0.01<P<0.05;**:差异极显著,P<0.01
?
[1]周红宇,阳学风.瘦素对肝细胞三酰甘油沉积的影响[J].临床军医杂志,2006,3:265-268.
[2]Chitturi S,Farre1l G C.Etio,Pathogenes is of nona1eoholic steatohepatitis[J].Semin Liver Dis,2001,21:27-41.
[3]杨丽英.复方茵陈制剂对动物保肝作用机理的研究[D].福州:福建农林大学,2006.
[4]林青,李立纪,曹东.抗脂肪肝研究的思考[J].云南中医学院学报,2002,25:41-42.
[5]李仪奎.中药药理实验方法学[M].上海:上海科学技术出版社,1991:462.
[6]徐叔云,卞如濂,陈修,等.实验药理方法学[M].北京:人民卫生出版社,2002:5812-5841.
[7]Seglen P O.Solation of hepatocy tes by collagenase perfusion methods[J].Toxicol,1993,1:2312-2341.
[8]徐哲,白雪帆,滕光菊,等.大鼠肝细胞分离、原代培养及生物学特性研究[J].医学研究生学报,2003,16:342-351.
[9]Pichard L,Raulet E,Fabre G,et al.Human hepatocyte culture[J].Methods in Molecular Biology,2006,320:283-293.