水貂IFN-α基因的克隆与原核表达
2010-06-01盖春云
盖春云 ,张 灿,单 虎
(青岛农业大学预防兽医学实验室,山东青岛266109)
干扰素是在特定的诱生剂作用下,由淋巴细胞分泌的具有抗病毒、影响细胞生长分化、抗肿瘤和调节免疫功能等活性的糖蛋白[1]。但在动物体内自身存在的干扰素极其微量,以传统的方法难以制备和纯化,因此利用基因工程技术生产重组干扰素是解决这一难题的有效途径。国内外已经对鸭、猪甚至大熊猫等许多动物的干扰素的抗病毒活性进行了研究,均产生了良好的效果[2-4]。而对于水貂α干扰素的研究现在做的人很少,只有人在GenBank上发表了α干扰素的基因序列,对于其蛋白质的表达及生物学作用的研究探讨现在还没有相关文章的报道。
在我国干扰素研究起步较晚,而我国水貂养殖业的发展迅速,而对于水貂等经济动物的疫病防控措施又很少。因此通过本试验水貂干扰素的重组质粒的构建,并在大肠杆菌中进行有效表达,为进一步探讨表达产物的临床应用奠定了基础,可对于水貂一些疾病如水貂犬瘟热、水貂细小病毒性肠炎、水貂阿留申病等水貂病毒性疾病的预防与治疗有重要作用。
1 材料与方法
1.1 菌株和质粒 pMD-18T购自 TaKaRa公司,E.coli BL21及pET32a表达质粒均由本实验室提供。
1.2 酶和试剂 EcoR I、XholⅠ限制性内切酶及附带的10×Buffer,dNTP,Taq DNA聚合酶 ,均为宝生物工程(大连)有限公司产品。T4 DNA连接酶,质粒DNA快速提取试剂盒,DNA凝胶回收试剂盒,购自北京赛百盛公司。
1.3 水貂基因组的提取 参照“分子克隆实验指南”提取基因组DNA[5]。
1.4 基因克隆及其质粒的构建 根据GenBank上报道的水貂IFN-α序列设计引物,以提取的总基因组为模板进行PCR。反应体系25μ L,62℃退火,32个循环。引物如下:
上游:5′-ATGGCCCTGCCCTGCTCCT-3′;下游 :5′-TCACTTCCTGCTCCGCAATCTC-3′将扩增的目的条带与pMD-18T连接,构建质粒pMD-18T/IFN-α,PCR鉴定后,送T aKaRa公司测序。采用DNAMAN软件及在线软件进行序列分析。根据测序结果,以pMD-18T/IFN-α为模板,扩增水貂 IFN-α成熟肽,反应体系 25 μ L,退火62℃,32个循环。引物如下:
上游 :5′-GCC GAA T TC CT T GT T TGT GGC CCT GGT G-3′含 EcoRⅠ酶切位点 ,下游:5′-GCA CTC GAG TCA CTT CCT GCT CCG CAA TCT-3′含 XholⅠ酶切位点。
对产物进行回收,连接到pET32a载体上,构建质粒pET32a/IFN-α,进行PCR鉴定以及双酶切鉴定。
1.5 重组质粒在大肠杆菌中的诱导表达及纯化取阳性菌株接种于含氨苄青霉素的新鲜LB培养基中,37℃,200 r/min振摇培养待其生长至 A600为1.0左右,加入IPTG至终浓度为1 mmol/L,诱导6 h,分别取上清及沉淀,进行 SDS-PAGE电泳及Western blot分析。
1.6 少量目的蛋白的纯化回收 运用KCL染色方法对蛋白进行少量回收[6]。
1.7 活性测定 本试验通过细胞病变抑制法测定干扰素的抗病毒活性。以能抑制 50%细胞病变的干扰素最高稀释度作为 1个单位。根据待测样品不同稀释度的保护能力,计算出干扰素生物学活性单位。将已稀释的蛋白,取20 μ L进行梯度稀释分别于 20 μ L鸭肠炎病毒(COV)进行混合,接种于96孔细胞培养板生长良好的24 h鸡胚成纤维(MDCK)细胞,同时设鸭肠炎病毒阳性对照(以PBS取代IFN-α)以及空白对照,72 h后观察细胞病变[7]。
2 结果
2.1 IFN-α基因的克隆及序列分析 PCR产物经1%琼脂糖凝胶电泳后结果如图1所示。在约564 bp处有一条特异性目的条带,大小与预期结果一致。测序结果与GenBank有关文献报道的IFN-α的核苷酸序列进行比较,其同源性为98%。通过用在线软件SOPMA及Signal P3.0server对IFN-α基因氨基酸序列进行二级结构分析结果表明,N末端的18个疏水氨基酸为信号肽,成熟多肽为163个氨基酸,成熟多肽中有6个半胱氨酸残基;a螺旋的比例为62.03%。
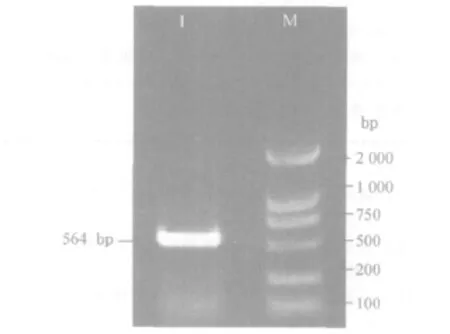
图1 IFN-αPCR扩增结果
2.2 IFN-α成熟肽基因扩增及表达载体的鉴定构建质粒经双酶切以及PCR鉴定结果如图2所示。酶切图谱与预期结果相同,在约543 bp处有一条特异条带。表明已成功构建了重组表达质粒pET 32 a/IFN-α。

图2 重组质粒酶切鉴定
2.3 SDS-PAGE电泳 筛选鉴定的阳性工程菌进行热诱导表达,同时进行BL21空菌体诱导对照,诱导6 h离心后,分别取上清和沉淀各15 μ L,经SDSPAGE分析显示,分子量约为36 ku,Western blot结果显示,在约36 ku处出现特异性条带(图3)。菌体上清中可获得高效表达,经BandScan 5.0软件分析,其表达量约占整个菌体的50%。
2.4 活性测定结果 倍比稀释的水貂 IFN-α与CDV混合后,分别接种于MDCK细胞,72 h后观察稀释到空白对照组显示正常,而阳性毒组出现明显病变。算得其标准效价约为1.6×104U·mL-1,其比活性为1.1×105U·mg-1。
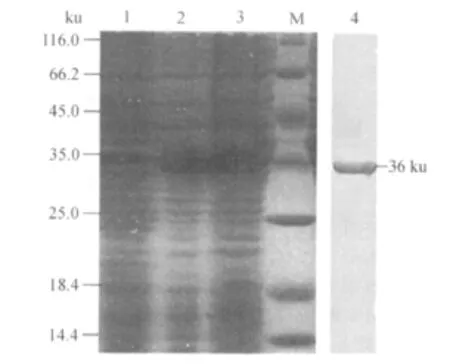
图3 pET32a/IFN-α重组质粒诱导表达产物SDS-PAGE分析及 Western blot检测
3 讨论
干扰素(IFN)系统是目前所知的发挥作用最快的第一病毒防御体系,可在很短时间(几分钟内)使动物机体处于抗病毒状态,使动物机体在1~3周内对病毒重复感染有抵抗作用[8]。
国内外仅对水貂IFN-α的基因序列做过报道,本试验对水貂IFN-α蛋白的表达及活性测定,可以进一步提高对水貂干扰素的生物学特性的认识,为其发挥对某些经济动物的病毒性疾病的预防及治疗等临床应用奠定基础。
在对其他物种的干扰素的研究中,已有发现其种族特异相对比较强但其诱导的抗病毒活性在不同物种间存在一定相互交叉现象[9],其抗病毒效果具有非特异性。本试验水貂IFN-α在鸡胚成纤维细胞可以对鸭瘟病毒产生抗病毒活性,但效果比鸡的干扰素的较差,主要可能是水貂与鸡的亲缘关系较远造成的。另外利用原核表达系统对真核生物基因表达存在着一定的弊端,不能实现在真核生物中翻译后加工、修饰等也是重组IFN-α活力比较低的可能原因之一。
影响外源基因在大肠杆菌中表达的因素有很多,如载体类型、宿主菌特征、外源基因结构、培养条件及营养状况等,因此,对不同的基因必须对其诱导条件进行优化,才能获得最大程度的表达。因此在对水貂IFN-α做进一步的研究中,可以对表达条件及载体等因素进行选择,选择成熟的蛋白表达条件,进而进一步分析其蛋白特性及生物学功能,发挥其抗病毒的作用,为水貂及其他鼬类动物的某些病毒性疾病的预防与治疗提供新的思路。
[1]刘皓,焦丹,葛继乾.干扰素国内市场的现状与发展分析[J].中国药业,2001,10(10):11-13.
[2]Schultz U,Chisari F V.Recombinant duck interferon gammainhibits duck hepatitis B virus replication in primary hepatocy tes[J].J Virol,1999,73(4):3162-3168.
[3]A rtursson K,Gobl A,Lindersson M,et al.M olecular cloning of agene encoding porcine interferon-beta[J].J Interferon Res,1992,12(3):153-160.
[4]黄道超,张志和,杨光友.大熊猫γ-干扰素基因的克隆与序列分析[J].中国预防兽医学报,2008,30(1):35-38.
[5]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].黄培堂,王嘉玺,朱厚础,等译.3版.北京:科学出版社,2002.
[6]马云,孙大业,孙颖.水稻类受体激酶OsCR4的抗体制备及特异性检测[J].中国生物化学与分子生物学报,2006,22(11):924-930.
[7]付加雷,宋长征,张更林.干扰素-tau的原核表达、纯化和活性测定[J].中国生物工程杂志,2007,27(3):6-11.
[8]汪恭富,朱燕.干扰素在犬类疾病治疗中的应用[J].养犬,2006(1):23-24.
[9]连京华,李玉峰,高广饶,等.兽用干扰素的研究进展[J].山东农业科学,2005(1):78-80.