铽离子荧光增敏洛美沙星及其含量测定
2010-06-01聂松柳戚雪勇张怀敬
聂松柳,戚雪勇,张怀敬,何 华
(1.安徽省六安市人民医院药剂科,安徽 六安 237005; 2.江苏大学药学院,江苏 镇江 212001;3.中国药科大学分析化学教研室,江苏 南京 210009)
洛美沙星(lomefloxacin,LFLX)是新一代广谱氟喹诺酮类抗菌药物,抗菌活性强、抗菌谱广、不良反应小,用于治疗泌尿系统、呼吸道、前列腺等细菌感染性疾病,效果良好。洛美沙星的含量测定方法较多,如紫外分光光度法[1-2]、荧光分析法[3-5]、化学发光法[6]、原子吸收法[7]、高效液相色谱法[8-11]、毛细管电泳法[12]、伏安法[13]、非水滴定法[14]、微生物检测法[15]等,但这些方法各有优势和不足,在简便性、灵敏性、专属性和稳定性等方面有待完善和提高。因此,有必要探索能同时进行洛美沙星体内和体外分析的新方法。
1 仪器与试药
RF-5301PC型荧光分光光度计(日本,岛津);FTIR-8400S型红外光谱仪(日本,岛津);FA 1004型电子天平(上海天平仪器厂);pHS-2C型酸度计(上海雷磁仪器厂)。天门冬酸洛美沙星对照品(法国巴黎十一大药学院赠送);Tb4O7(上海跃龙有色金属有限公司);盐酸洛美沙星胶囊(南京第二制药厂);其他试剂均为分析纯,水为双蒸水(本实验室自制)。
2 方法与结果
2.1 溶液配制
TbCl3溶液的配制:称取 (MTb=159,MTb4O7=748)0.074 8 g Tb4O7,滴加盐酸(1∶1)数滴,并加入几滴H2O2,小心加热使其溶解,待蒸至近干,用水于100 mL量瓶中定容,配成4.0×10-3mol/L的Tb3+离子贮备液,置冰箱中保存。
洛美沙星贮备液:称取天门冬酸洛美沙星对照品(M=466)0.046 6 g,用水于100 mL量瓶中定容,配成1.0×10-3mol/L的对照品贮备液,冰箱中保存。临用前吸取1 mL,置100 mL量瓶中,用水定容,配成1.0×10-5mol/L的工作溶液。
醋酸-醋酸钠缓冲液(0.1 mol/L):将适当体积的0.1 mol/L醋酸和适当体积的0.1 mol/L醋酸钠溶液混和,在酸度计上调节至所需pH。
Tris-HCl缓冲液(0.1 mol/L):取三羟甲基氨基甲烷12.41 g,加水800 mL,搅拌溶解,并稀释至 1 000 mL,用 6 mol/L盐酸溶液在酸度计上调节至所需pH。
2.2 测定方法
于25 mL量瓶中依次加入洛美沙星贮备液2.5 mL、Tb3+离子溶液 1.25 mL、pH=6.0的醋酸 -醋酸钠缓冲液2 mL,水定容,摇匀。以320 nm为激发波长,545 nm为发射波长,用1 cm石英池,在荧光分光光度计上测定其荧光强度,激发和发射狭缝均为5 nm。
2.3 荧光测定条件选择

图1 荧光光谱图
激发波长和发射波长:光谱图见图1。洛美沙星在273 nm和320 nm波长处有最大两个激发波长,洛美沙星与Tb3+生成络合物后峰位基本没有位移,且275 nm波长处的强度明显增大(图1 A)。由图1 B可见,洛美沙星的荧光峰位于435 nm波长处,但当它与Tb3+离子结合后,其自身435 nm波长处的荧光峰则显著减小,而在490,544,590,620 nm波长处产生了铽的特征荧光峰(峰形较窄),它们分别对应于Tb3+的5D4→7F6,5D4→7F5,5D4→7F4,5D4→7F3跃迁。由 Tb3+水溶液的荧光光谱可知,Tb3+的荧光强度极弱。由此可见,Tb3+的特征荧光峰是由于洛美沙星将吸收的能量传递给Tb3+,从而敏化了Tb3+的发光,与Tb3+水合离子相比较极大地提高了Tb3+的发光强度。由图1C可知,铽离子本身的激发波长在270~290 nm波长之间,为了避免对铽的激发,因此将络合物的激发波长选择为315~330 nm,最终确定为320 nm。综上所述,荧光测定条件确定为1cm石英池,激发波长λex=320nm,发射波长 λem=545nm,狭缝均5 nm。
介质pH确定:于25 mL量瓶中依次加入洛美沙星工作溶液2.5 mL,Tb3+离子贮备液 1.25 mL,pH 分别为 3.0,4.0,5.0,6.0,7.0,8.0,8.0,9.0,10.0 的缓冲液 2 mL,以水定容,摇匀,依法测定,结果见图2。在pH较低或较高的介质里,Tb3+与洛美沙星很难反应;当介质pH为6.0~6.5时,体系的荧光强度达到最大并且稳定。在碱性条件下,Tb3+易水解,生成铽的氢氧化物沉淀;在强酸时,—COOH难以电离,不易形成络合物。从理论上讲,pH应大于8.0,反应易进行,但会产生沉淀,尤其是磷酸盐缓冲液也会产生TbPO4沉淀。固定pH为6.0,试验了不同缓冲体系醋酸-醋酸钠、磷酸氢二钠-磷酸二氢钠、Tris-盐酸中Tb3+与洛美沙星的反应情况,发现醋酸-醋酸钠最好,适宜用量在1.5~2.0 mL之间。故本试验选用pH=6.0的醋酸-醋酸钠缓冲溶液2 mL。
Tb3+离子浓度确定:于25 mL量瓶中依次加入洛美沙星工作溶液 2.5 mL、醋酸 -醋酸钠缓冲液(0.1 mol/L,pH=6.0)2 mL,分别加入 Tb3+离子贮备液 0 mL(0 倍 )、0.1 mL(16 倍 )、0.2 mL(32倍)、0.5 mL(80 倍)、0.8 mL(128 倍)、1.0 mL(160 倍)、1.5 mL(240倍)、2.0 mL(320 倍)、3.0 mL(480 倍)、6.0 mL(960 倍),以水定容,摇匀。依法测定,结果见图3。

图2 LFLX-Tb3+荧光的影响(1.0×10-6~2.0×10-4mol/L)

图3 Tb3+离子浓度对LFLX-Tb3+荧光的影响
洛美沙星-铽离子络合物荧光强度受Tb3+离子浓度影响极大。Tb3+离子浓度增大,有利于配合物的形成,并使络合物体系的荧光强度增大。试验中固定洛美沙星浓度为1.0×10-6mol/L,改变Tb3+离子浓度,发现随着Tb3+离子浓度逐渐增加,在545 nm波长处Tb3+离子的特征荧光强度逐渐增大,同时在435 nm波长处洛美沙星自身的荧光强度逐渐减小。当[Tb3+]/[LFLX]≥200时,体系荧光强度趋于恒定。
2.4 方法学考察
稳定性试验:于25 mL量瓶中依次加入洛美沙星工作溶液1.25 mL、醋酸 -醋酸钠缓冲液(0.1 mol/L,pH=6.0)2 mL、Tb3+离子贮备液 0.65 mL,水定容,摇匀。分别于放置 5,15,25,30,60,120 min时依法测定,结果见图4。可见,最大荧光强度为289.9,最小荧光强度为275.7,最大改变幅度为5.15%,表明络合物的荧光在2 h内稳定。
标准曲线制备:吸取 0,0.025,0.1,0.5,1.0,2.0,3.0 mL 洛美沙星工作溶液,置25 mL量瓶中,加2.0 mL醋酸-醋酸钠缓冲液,加1.25 mL Tb3+离子贮备液,用双蒸水定容,配成浓度为0,1.0×10-8,4.0 ×10-8,2.0 × 10-7,4.0 × 10-7,8.0 × 10-7,1.2 × 10-6,2.4×10-6mol/L的系列溶液,放置30 s,依法测定相对荧光强度。以浓度为横坐标、荧光强度为纵坐标进行线性回归,回归方程为F=6.448 7 ×108C-5.985 6,r=0.999 9(n=7)。结果表明,洛美沙星浓度在1.0×10-8~2.4×10-6mol/L范围内与荧光强度线性关系良好。检测限为3.5 ng/mL。试验显示,加空白血清对制作标准曲线无干扰。
回收率试验:用标准加入法测定回收率,结果见表1。
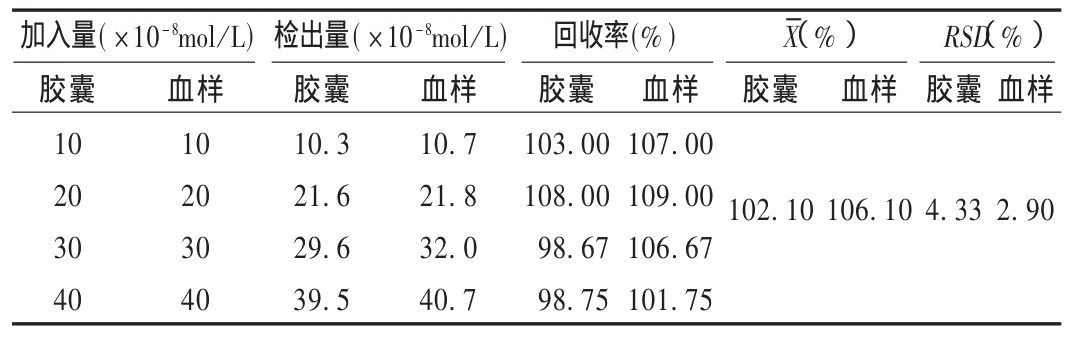
表1 胶囊和血样的回收率试验结果(n=6)
2.5 样品测定
洛美沙星胶囊测定:取胶囊10粒(0.1 g/粒),将内容物混匀,取相当于1粒胶囊的药粉,加水少许充分振摇,使药物溶解,过滤除去不溶物,用水洗涤,合并滤液与洗液,置100 mL量瓶中,定容;从中吸取5.0 mL,置50 mL量瓶中,定容;移取0.5 mL于25 mL量瓶中,加Tb3+离子贮备液1.5 mL,0.1 mol/L醋酸-酸酸钠(pH=6.0)缓冲液2 mL,以水定容。依法测定相对荧光强度,结果以百分标示量计。结果3批样品中洛美沙星的百分标示量分别为98.6%,98.9%,99.4%,平均98.98%,均符合国家药品标准WS-203(X-177)-96的规定。
兔血清中洛美沙星测定:取洛美沙星200 mg,加少许0.1 mol/L NaOH溶解,加水10 mL稀释,从兔耳缘静脉注射。分别于给药后0.25,0.75,1.25,1.75,4.0,6.0,8.0,24.0 h 时,从兔耳缘静脉采血 3.0 mL,静置 1 h,离心(4 000 r/min)5 min。取血清 0.5 mL,置另一离心管中,加水 1 mL,乙腈 1 mL,离心(4 000 r/min)5 min。取上清液2 mL,置25 mL量瓶中,加Tb3+离子贮备液1.5 mL,0.1 mol/L醋酸-醋酸钠(pH=6.0)缓冲液2 mL,以水定容。结果见图 5。以logC对时间进行线性回归,计算半衰期(t1/2)为 1.60 h,与文献[16]报道的基本一致,说明本方法可用于洛美沙星的药代动力学研究。

图5 洛美沙星的血药浓度曲线
3 讨论
镧系元素具有在能量转移过程中起重要作用的4f电子。在溶液中,由于游离态镧系离子的摩尔吸收系数ε小,并受水分子光淬灭效应的影响,其发射光很弱。但在加入光敏试剂以后,镧系离子(Ln3+)的发射光大大增强[17]。在溶液中,镧系离子的络合物可吸收有机物(供体)在特征波长处的能量,然后发射出具有镧系离子特征波长的辐射光。本试验利用这一“能量转移”现象,将具有α-酮酸结构的洛美沙星与镧系离子中的铽(Tb3+)结合,吸收外界给予的能量,再以能量转移的形式传给铽(Tb3+),使之发出特征荧光,检测该荧光强度即可测定洛美沙星的含量。
曾考察了pH、Tb3+浓度、乙醇、甲醇、TOPO、β-CD等影响荧光强度的因素,结果表明荧光强度受pH及Tb3+浓度的影响最大,故选择中性条件下,[Tb3+]/[LFLX]=200测定洛美沙星。
喹诺酮类药物的结构特点决定了其具有良好的紫外吸收和荧光性质,因此光谱法广泛适用于此类药物的分析测定。本试验建立的分析方法背景干扰小、专属性和灵敏度高,样品仅做简单的预处理,可直接应用于洛美沙星血样、动力学研究和胶囊质量分析。
[1]许庆琴,杜黎明,王静萍.导数-同步荧光光谱法直接测定尿样中的洛美沙星[J]. 光谱学与光谱分析,2002,22(3):444-445.
[2]杜黎明,周 静,袁建梅.氯冉酸为受体的荷移荧光光谱法测定洛美沙星[J]. 光谱学与光谱分析,2004,24(12):1 623-1 625.
[3]Du LM,Yang YQ,Wang QM.Spectrofluorimetric determination of certain quinolone through charge transfer complex formation[J].Anal Chim Acta,2004,516(1-2):237-243.
[4]储 倩,魏庆云,陈 彪,等.磺化杯[6]芳烃 -洛美沙星 -CTAB体系的荧光光谱研究及其应用[J].安徽师范大学学报(自然科学版),2009,32(1):55-59.
[5]Du LM,Xu QQ,Yuan JM.Fluorescence spectroscopy determination of fluoroquinolones by charge-transfer reaction[J].Journal of Pharmaceutical and Biomedical Analysis,2003,33(4):693-698.
[6]Sun HW,Li LQ,Chen XY.Investigation on sensitized chemiluminescence systemsand theirmechanism forfive fluoroquinolones[J].Analytica Chimica Acta,2006,576(2):192-199.
[7]李 媛,郎惠云,谢志海,等.间接原子吸收法测定药物中盐酸洛美沙星含量[J]. 西北大学学报(自然科学报),2000,30(1):39-42.
[8]王君耀,刘 放.RP-HPLC测定盐酸洛美沙星及其制剂的含量[J].华西药学杂志,2002,17(2):135-136.
[9]Shervington LA,Abba M,Hussain B,et al.The simultaneous separation and determination of five quinolone antibotics using isocratic reversed phase HPLC:application to stability studies on an ofloxacin tablet formulation[J].J Pharm Biomed Anal,2005,39(3-4):769-775.
[10]Santoro IRM,Kassab NM,Singh AK,et al.Quantitative determination of gatifloxacin,levofloxacin,lomefloxacin and pefloxacin fluoroquinolonic antibiotics in pharmaceutical preparations by high-performance liquid chromatography[J].J Pharm Biomed Anal,2006,40(1):179-184.
[11]Garcia MA,Solans C,Calvo A,et al.Determination of lomefloxacin in plasma samples by HPLC with fluorescence detection.Application to pharmacokinetic studies[J].Chromatographia,2001,54:9-10.
[12]Hernandez M,Borrull F,Calull M.Determination of quinolones in plasma samples by capillary electrophoresis using solid-phase extraction[J].J Chromatogr B,2000,742(2):255-265.
[13]Vllchez JL,Araujo L,Prieto A,et al.Differential-pulse adsorptive stripping voltammetric determination of the antibacterial lomefloxacin[J].J Pharm Biomed Anal,2001,26(1):23-29.
[14]冯 琳,储秋萍,邵志高.荧光分光光度法测定盐酸洛美沙星胶囊含量[J]. 中国抗生素杂志,1996,21(1):17-19.
[15]娄建石,张京玲,张才丽,等.国产洛美沙星胶囊临床药代动力学和生物利用度[J]. 中国抗生素杂志,1994,19(4):253-258.
[16]杨 健,杜继昭,郑德霖.洛美沙星的药代动力学[J].国外医药·抗生素分册,1995,16(5):367-371.
[17]戚雪勇,何 华,顾 飞,等.铽离子增敏环丙沙星研究及其应用[J].中国药学杂志,2005,40(19):1 500-1 503.
