锂电池正极材料CuCrO4的合成及表征
2010-05-31李益孝
李 琳,李益孝,杨 勇
(厦门大学固体表面物理化学国家重点实验室化学化工学院化学系,福建厦门 361005)
高比容量和高能量是衡量锂离子一次电池材料性能的主要指标,一些具有多电子交换反应的正极材料,例如Ag2CrO4[1]和Ag2V4O11[2],均先后受到人们广泛的关注并得到商业应用。这两种材料因其放电产物单质银能够提高电极的电导性而具有较好的倍率性能[1]。与此类似,CuCrO4的得失电子数目大,放电过程也可能发生多电子交换反应。而且,CuCrO4的分子量相对较轻,具有比Ag2CrO4更高的理论容量。若CuCrO4在放电过程中以五个电子的转换反应来计算,即Cr(VI)→Cr(III)和 Cu(II)→Cu,理论比容量是 744 mAh/g,并且CuCrO4材料在放电过程中形成的金属铜会提高材料的倍率性能。因此,CuCrO4材料是近年来非常令人们感兴趣的锂电池正极材料。
近年来,一些研究团体已经报道了合成铬酸铜锂电池正极材料的方法。Dey用原位石墨的方法合成CuCrO4,但是因为石墨的分散不均匀,使材料的电化学性能相比不加石墨的电极材料并无太大改善[3-4]。Kachibaya等[5]通过研究CuCrO4体系中的锂离子插入机理表明,CuCrO4在放电过程中形成了Cr(V)化合物。
本文报道了一种合成CuCrO4的改进方法,并用XRD和恒流放电技术对材料的结构和电化学性能进行了表征;采用非原位X射线衍射技术(XRD) 和傅里叶反射红外光谱(FTIR)的方法研究了其放电机理。
1 实验
1.1 试剂与仪器
所用各种化学试剂均为分析纯(中国医药上海化学试剂公司)。
所采用的仪器包括:Panalytical X'Pert型粉末X射线衍射仪 (荷兰Philip公司),LEO 1530型场发射电子显微镜(英国Oxford Instrument公司),CT2001A充放电测试系统(武汉兰电公司);Autolab电化学工作站(荷兰Eco Chem ie公司)以及Nicolet Avatar 360傅里叶红外光谱仪(美国Thermoelectro公司)。
1.2 CuCrO4的制备
沉淀法合成CuCrO4材料在文献[3]中已有报道,我们在此基础上进行了一些改进。将过量的CrO3缓慢加入到去离子水中,形成红色的H2CrO4溶液,再在不断搅拌下将化学计量比的 CuCO3·Cu(OH)2·x H2O(质量分数为 52%Cu)缓慢加入到H2CrO4溶液中,可看到形成红棕色浊液,并有气体产生,继续在常温下搅拌24 h至反应完全,方程(1)表示的是其中发生的主要化学反应。
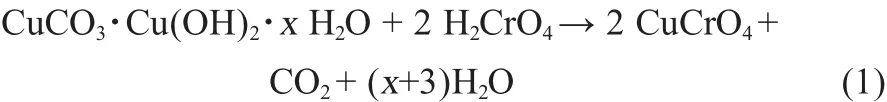
抽滤,并将滤渣置于200℃反应10 h。冷却后,依次用去离子水和乙醇洗涤,并在真空下60℃干燥6 h得到目标产物。
1.3 电池组装
将活性物质,乙炔黑,聚偏氟乙烯(PVDF)按质量比8∶1∶1在N-甲基吡咯烷酮(NMP)分散剂中混合,球磨3 h,将制得的浆均匀涂布在铝集流体上,于120℃烘干1 h,18MPa压力下压片,得到电极片。将所得电极作正极,金属锂作负极,Celgard2300作隔膜,电解液为1 mol/L的LiPF6+EC/DMC(质量比1∶1),在填充氩气手套箱中组装成CR2025型扣式电池,并在充放电测试仪上以不同的电流密度进行放电测试。
2 结果与讨论
2.1 XRD表征
图1是合成的CuCrO4材料的XRD谱图。据图1可以看出,样品的衍射峰与CuCrO4标准卡片(JCPDS card No:01-077-2474)对比一致,属于正交晶系,Cmcm空间群。样品的XRD图中只有CuCrO4物相的衍射峰,并不存在其他杂相,说明合成的材料纯度高。
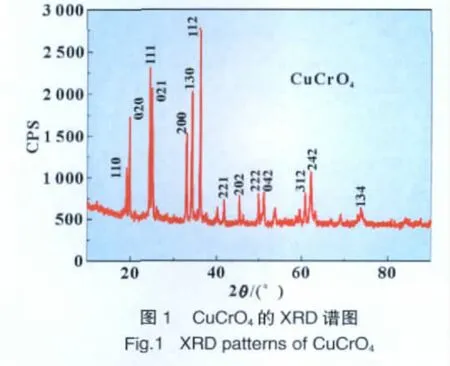
2.2 SEM形貌表征
图2是CuCrO4的SEM图。由图可知,该正极材料呈类似棒状的形貌,规则形状的棒状粒子宽度约为400 nm,长度为1~3μm。虽然图中存在不规则形状的粒子,但粒径分布相对较均匀。
2.3 电化学性能测试
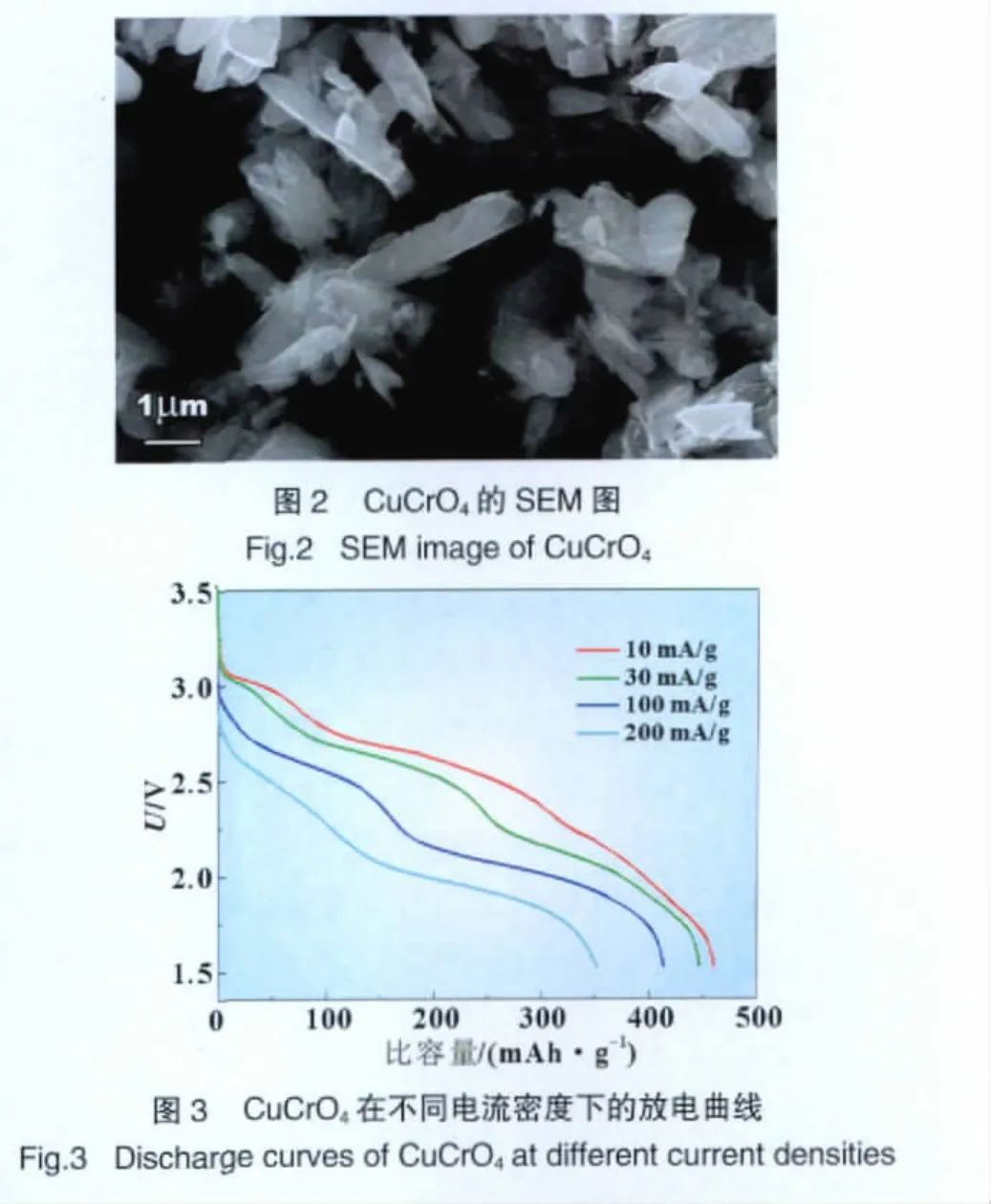
图 3 是 CuCrO4材料在 10、30、100、200mA/g 的不同电流密度下,截止电压为1.5 V的放电曲线。由图中可以看出,当在常温下以10mA/g的电流密度放电,CuCrO4材料的首次放电比容量高达460mAh/g,电压平台大约在2.5 V(相当于放出了62%的理论容量,且每个CuCrO4分子约有3.1个电子的交换)。随着电流密度的增大,电极极化增大,放电比容量趋于下降。在30、100mA/g和200mA/g的较高电流密度下,Cu-CrO4的放电比容量依然分别达到了450、417 mAh/g和352 mAh/g。这表明通过改进方法所合成的CuCrO4具有高的比容量和优异的高倍率放电性能。
2.4 CuCrO4放电机理研究
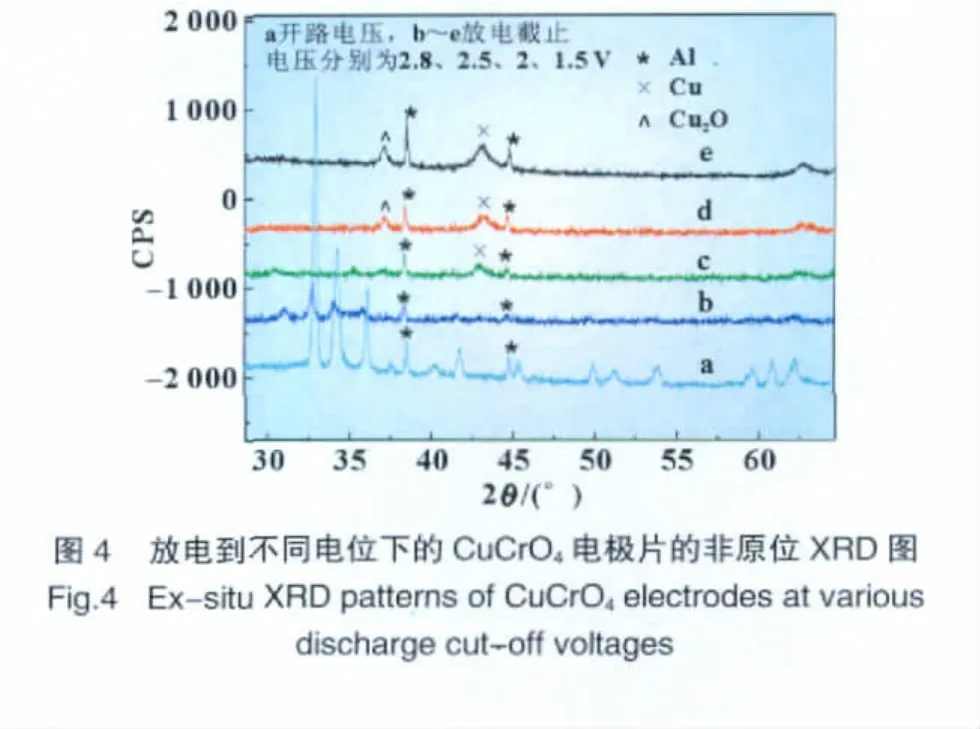
为了研究CuCrO4的放电机理,及验证其可能的放电产物单质铜,将材料装配成扣式电池,在10mA/g、3.5~1.5 V范围内进行放电测试;在放电结束后,将放电到不同电位的扣式电池立即在填充氩气手套箱中小心解剖 (应防止短路发生),取出正极片用DMC冲洗后,在填充氩气手套箱中晾干后做XRD和IR检测。图4为CuCrO4原始材料和其放电后的ex-situ XRD图。从图中可以看出,当电极放电到2.8 V后,CuCrO4的衍射峰就开始变弱,并在随后的放电过程中完全消失。这说明CuCrO4在放电过程中,由晶态变为无定形态或者转变为其他化合物。而当电极片放电到2.0、2.0 V和1.5 V,在2θ约为37.2°和43.2°处出现了两个小峰,分别对应着Cu2O和单质Cu的特征衍射峰。这说明产物有Cu2O和Cu单质。但是Cu2O也有可能是在非原位测试中,Cu接触到空气被氧化而形成。而且随着放电深度的增加,Cu和Cu2O的特征衍射峰增强,说明它们的量增多。结合图2~4的数据,一方面,材料的棒状形态和亚微米级的粒径缩短了锂离子的扩散路径;另一方面,放电过程中单质铜的析出,提高了正极的电子电导。这样,该电极就具备了良好的锂离子传输和电子传递的条件,从而使材料体现出较好的电化学性能。
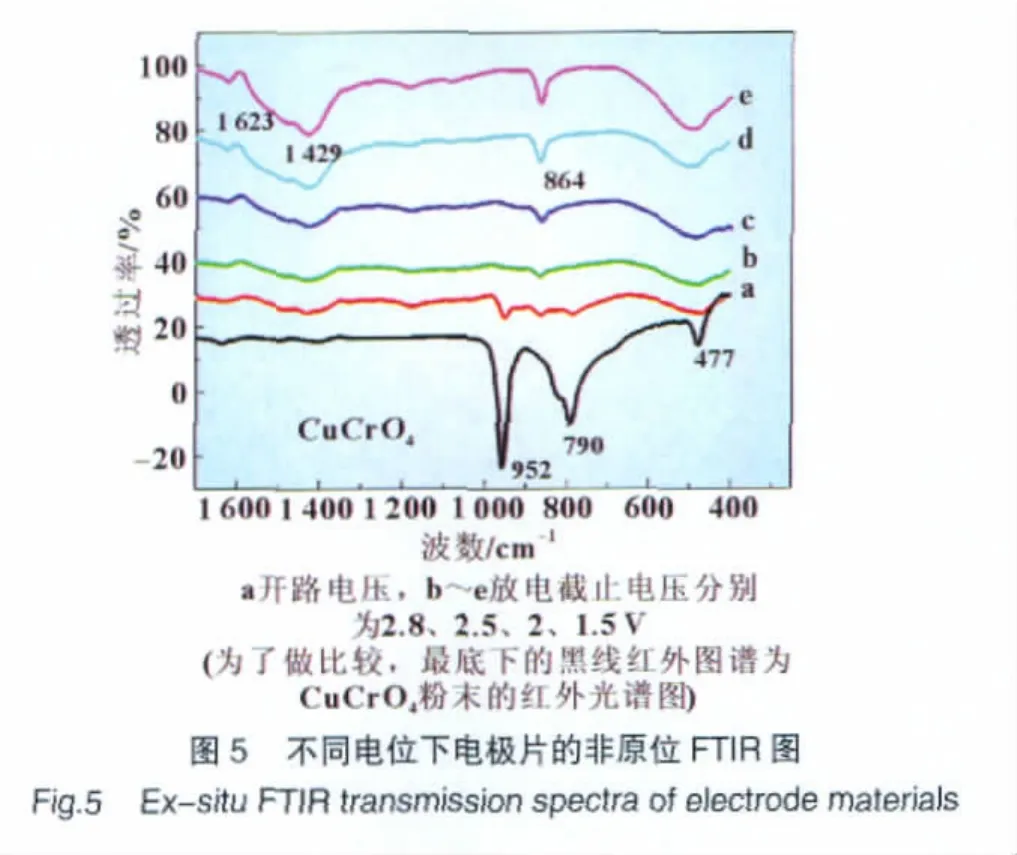
图5为与图4相同条件下的电极片的非原位FTIR图。图中在1 623 cm-1看到的较弱的吸收峰为水的弯曲振动峰,1 429 cm-1的吸收峰对应着碳酸盐的v3振动模式[6],且此吸收峰存在于所有与电解液接触的电极片中[图5(a~e)],而Cu-CrO4粉末中未见到,所以碳酸盐可能来自于电解液与电极材料表面接触反应形成的SEI层,并且随着放电深度的增加,峰的强度加强,这说明SEI层逐渐增厚。952 cm-1和790 cm-1对应着CuCrO4的特征峰[7]。然而在放电过程中,CrO42-的特征主峰消失,取而代之的是一个新的峰864 cm-1,指认为Cr3+离子的红外峰[6]。结合XRD和IR的数据说明说明CuCrO4刚开始放电时,晶态结构就发生了塌陷。此外,CuCrO4在放电过程中转变为其他化合物,如Cr3+化合物,并形成反应产物Cu和Cu2O。
3 结论
采用改进的沉淀方法制备了CuCrO4正极材料,此方法合成的CuCrO4材料,作为一次锂电池正极材料,具有放电比容量高、倍率性能好等优点。以10mA/g和200mA/g的倍率放电到1.5 V,比容量分别达到460mAh/g和350mAh/g。该材料的棒状形态和亚微米级的粒子大小,使材料具有较好的离子传输条件;单质铜在放电过程中的析出,使材料的电子电导得到改善。这两点是该材料倍率放电特性优异的主要原因。XRD和IR的研究结果揭示了CuCrO4在放电过程中可能转变为了其他化合物,如Cr3+化合物,并形成反应产物单质Cu和Cu2O。
[1]MESSINA R,PERICHON J,BROUSSELY M.Electrochem ical reduction mechanism of silver chromate in lithium cells[J].JElectroanalChem Interfacial Electrochem,1982,133(1):115-123.
[2]BENINATIS,FANTUZZIM,MASTRAGOSTINO M,et al.MW-assisted synthesis of SVO for ICD primary batteries[J].Journal of Power Sources,2006,157(1):483-487.
[3]DEY A N.Lithium-metal chromate organic electrolyte cell:US,3658592[P].1970.
[4]DEY A N.lithium-metal chromate organic electrolyte cell and method for cathode:US,4423124[P].1976.
[5]KACHIBAYA E I,DZHAPARIDZE L N,IMNADZE R A,et al.Physicochem ical study of products of CuCrO4electrochemical reduction in Libatteriesduring discharge[J].Soobshcheniya Akademii Nauk Gruzii,1995,151(1):65-69.
[6]CRIVELLO M,PEREZ C,FERNANDEZ J,et al.Synthesis and characterization of Cr/Cu/Mgm ixed oxidesobtained from hydrotalcite-type compoundsand theirapplication in the dehydrogenation of isoamylic alcohol[J].Applied Catalysis a-General,2007,317(1):11-19.
[7]HARRISON PG,LLOYD N C,DANIELLW,et al.Evolution of m icrostructure during the thermal activation of copper(II)and chrom ium(III)doubly promoted tin(IV)oxide catalysts:An FT-IR,XRD,TEM,XANES/EXAFS,and XPS study[J].Chem Mater,2000,12(10):3113-3122.
