锂离子电池用离子液体电解质的研究
2010-05-31孙珊珊安茂忠崔闻宇杨培霞
孙珊珊,安茂忠,崔闻宇,杨培霞
(哈尔滨工业大学化工学院,黑龙江哈尔滨 150001)
锂离子电池具有能量密度大、充放电寿命长、无污染、工作电压高等诸多优异性能而应用广泛。然而,目前锂离子电池仍存在许多问题亟待解决,包括循环寿命、安全性能以及能量密度等,其中安全性是制约锂离子电池发展最关键的因素。对锂离子电池电解质体系进行改进是提高锂离子电池安全性的重要途径。
离子液体是在室温及相邻温度下完全由离子组成的有机液体物质[1],具有蒸气压低、无可燃性、热容量大等优点,在消除锂离子电池安全缺陷的应用研究中显示出良好性能,有希望彻底解决锂离子电池在高能量密度下的安全性问题[2]。
咪唑类离子液体具有黏度低、电导率高 (最高可达10-2S/cm)的特点而被广泛应用。而以TFSI-阴离子组成的离子液体,由于氟取代基对负电荷的强离域作用减弱了TFSI-离子与阳离子的氢键作用,因而具有低黏度、低熔点、高导电性等优点,所以TFSI-成为被广泛研究的阴离子[3]。以咪唑为阳离子,TFSI-为阴离子组合而成的离子液体综合了两者的优点,在锂离子电池中有较好的应用前景。
本文研究了纯离子液体1-甲基-3-乙基咪唑二(三氟甲基磺酰)亚胺(EMI-TFSI)和1-丁基-3-乙基咪唑二(三氟甲基磺酰)亚胺(BMI-TFSI)以及离子液体电解质EMI-TFSI+1.0mol/L LiTFSI、BMI-TFSI+1.0mol/L LiTFSI的性质,并研究了以Li-CoO2、LiFePO4为正极材料,以 EMITFSI+1 mol/L LiTFSI、BMITFSI+1mol/L LiTFSI为电解质组装的半电池的循环性能。
1 实验
1.1 离子液体EMI-TFSI和BMI-TFSI的合成
取等摩尔比的1-乙基-3-甲基咪唑溴化物EMIBr(上海成捷)或BMIBr(上海成捷)与二(三氟甲基磺酰)亚胺锂(LiTFSI)(上海成捷)分别溶解于去离子水中,混合后常温搅拌12 h,用二氯甲烷萃取下层油状液体,并用去离子水洗至用硝酸银检验上层水溶液无浑浊生成。收集下层溶液,旋转蒸发除去二氯甲烷,最后将产物真空干燥24 h,得到离子液体EMI-TFSI或BMI-TFSI[4]。
在充满氩气的手套箱中,将计算量的LiTFSI(按其在电解液中的浓度为1mol/L计)分别加入两种离子液体中,室温搅拌6~8 h,使其完全溶解,得到离子液体电解质。
1.2 离子液体性质的测定
离子液体的密度采用比重计测量;电化学窗口通过20℃下的线性扫描伏安法(LV)进行测试,扫描速率为10mV/s,使用三电极体系,工作电极使用半径为0.7 cm的Pt盘电极,每次测量前电极用0.3μm的α-氧化铝粉打磨,用二次蒸馏水洗净,干燥后使用。参比电极和辅助电极均采用锂箔[5];电导率使用DDS-11A型数字电导率仪测量。电导电极为DJS-1C型(黑),电极常数为1.00/298 K。离子液体电解质置于自制的筒型容器内,温度使用MH250电子调温电热套控制,控温精度为±1 K。同一浓度样品的电导率测试三次,相对误差小于5%,取其平均值。上述测量均在氩气氛的手套箱中进行。
1.3 电池性能测试
将LiCoO2(哈尔滨光宇)、乙炔黑、PVDF按质量比为8∶1∶1溶解于NMP中,混合成糊状后均匀的涂覆在铝箔上,120℃真空干燥12 h,再以10 MPa的压力辊压成形,冲压成直径为14mm的圆片,制成LiCoO2正极。
LiFePO4(哈尔滨光宇)正极的制备方法同上。
隔膜为Celgard 2300薄膜,电池的组装在氩气氛的手套箱中完成。
2 结果与讨论
2.1 离子液体的物理性质
本文考察两种离子液体的有机离子结构式如图1所示。
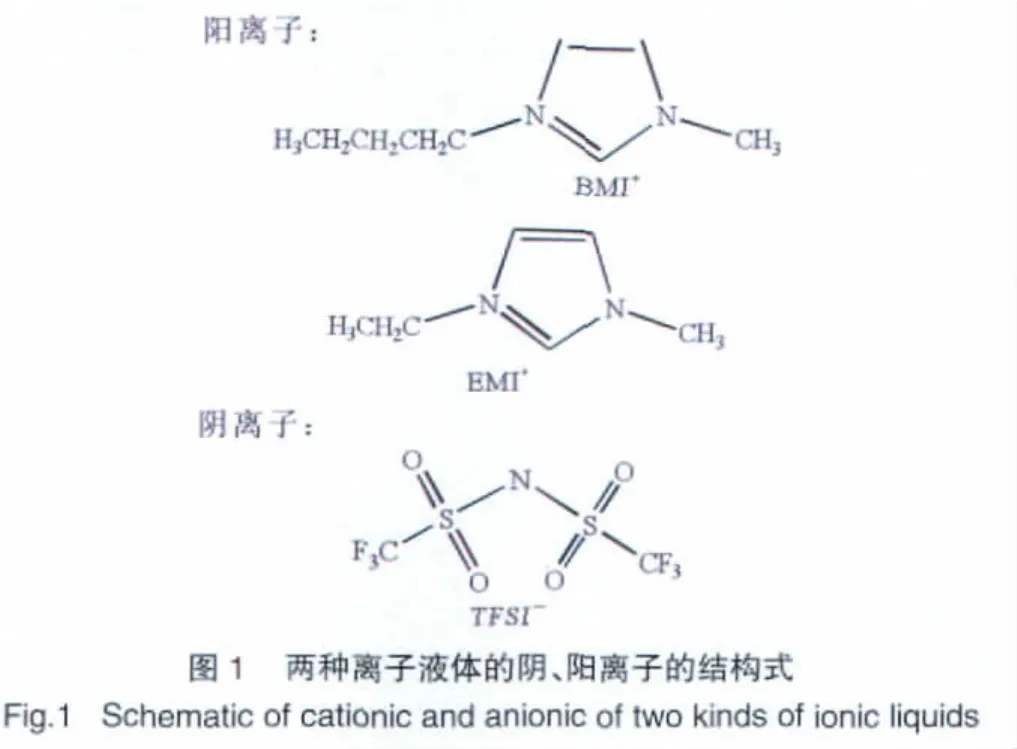
合成的两种离子液体1-甲基-3-乙基咪唑二 (三氟甲基磺酰)亚胺(EMI-TFSI)和1-丁基-3-乙基咪唑二(三氟甲基磺酰)亚胺(BMI-TFSI)在室温下均为无色透明粘稠状的液体,密度分别约为1.52 g/cm3和1.49 g/cm3,前者的密度略大于后者。Hyun等[7]研究了离子液体[Cnm im]NTf2中阳离子烷基链长对密度的影响,研究结果表明,在298 K时离子液体的密度随阳离子取代基碳原子数的增加而降低。本实验中,BMI+阳离子上的取代基碳原子数比EMI+阳离子多,因此BMI-TFSI的密度略低一些,这与前人的研究结果相一致。
2.2 离子液体的电化学窗口
电化学窗口是离子液体从开始发生氧化反应到开始发生还原反应时电位的差值,离子液体的电化学窗口主要取决于阴、阳离子自身的电化学稳定性。温度为298 K时测试离子液体EMI-TFSI和BMI-TFSI的电化学窗口的LV曲线如图2所示。
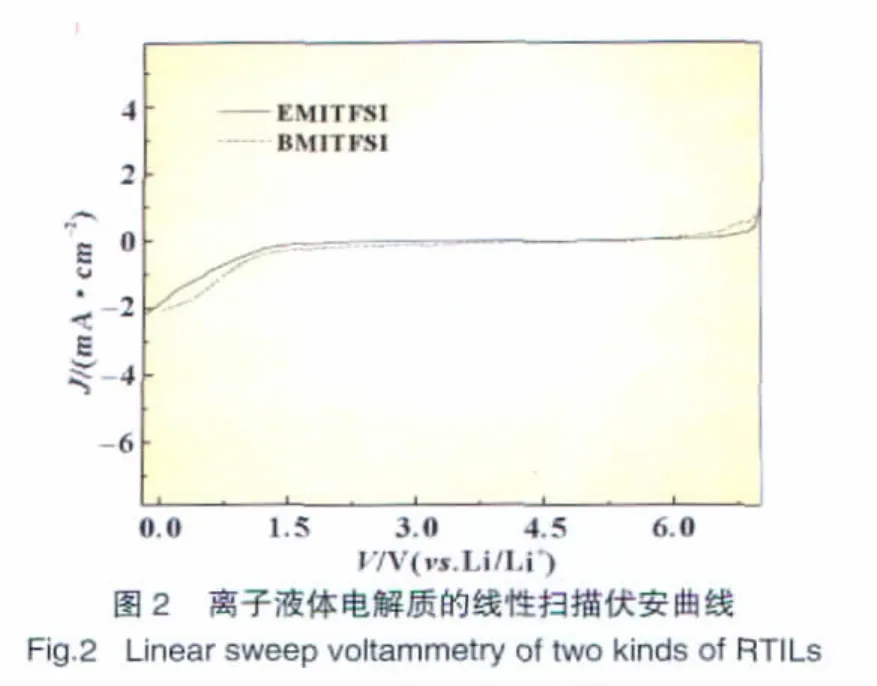
从图2可以看出,EMITFSI的电化学窗口和BMITFSI的电化学窗口数值比较接近,分别为4.8 V和4.6 V。这说明对于阴离子为TFSI-系列的离子液体来说,咪唑阳离子结构上烷基碳链长度的变化对离子液体的电化学窗口影响不大。
2.3 离子液体电解质的电导率
电导率是离子液体重要的电化学性质之一,室温下咪唑类离子液体的电导率一般在10-3S/cm左右,其大小与离子液体的黏度、分子量、密度以及离子大小有关。其中黏度的影响最明显,黏度越大,离子导电性越小。然而,密度越大,导电性越好[8]。
在不同测试温度下,纯的离子液体EMI-TFSI和BMI-TFSI以及电解质 EMI-TFSI+1 mol/L LiTFSI和 BMI-TFSI+1 mol/L LiTFSI的电导率如图3所示。
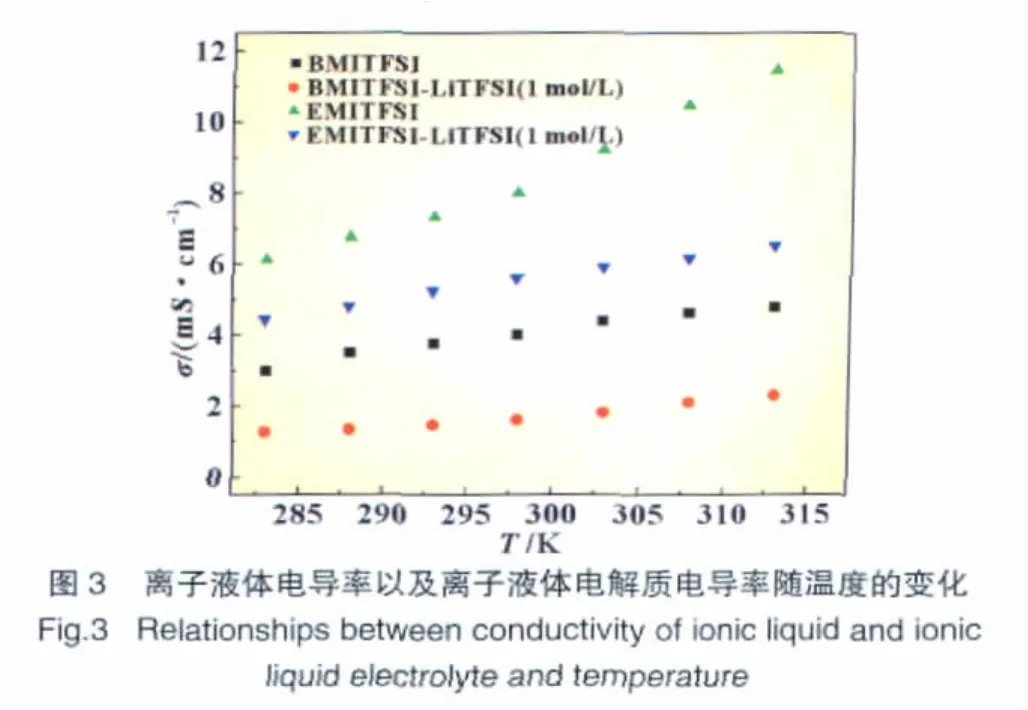
由图3可以看出,纯离子液体BMI-TFSI的电导率低于EMI-TFSI,这可能是由于前者咪唑阳离子上的烷基碳链较长,分子体积较大,从而使得导电离子迁移困难。随着温度的升高,两种离子液体的电导率均有较大幅度的升高;但加入1mol/L LiTFSI后电导率均有不同程度的降低。在温度为298 K时,离子液体EMI-TFSI加入锂盐后电导率由7.8mS/cm降低为5.4 mS/cm,而离子液体BMI-TFSI则由3.8 mS/cm降低为1.6 mS/cm。这可能是由于加入锂盐后电解质的黏度增加,从而导致电导率下降,这与Beatrice等[9]观察到的实验结果基本一致。
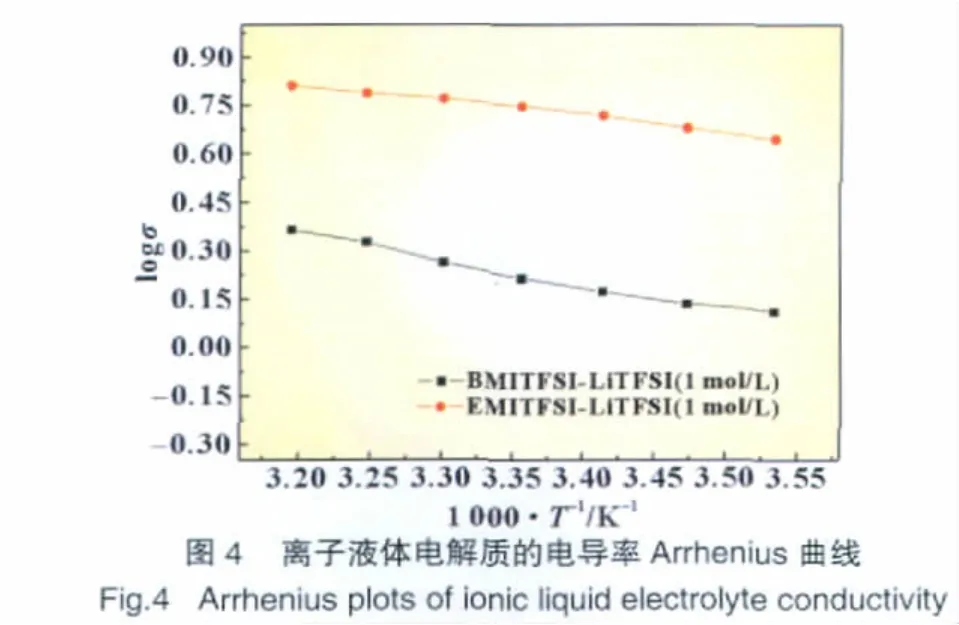
在较低的温度范围内,电导率与温度的关系符合Arrhenius方程[σ=A exp(Ea/RT)]随着温度的升高,电导率逐渐增大,呈现如下图4所示的Arrhenius行为。
2.4 Li/LiCoO2半电池的充放电特征
图5是Li/LiCoO2半电池 (分别使用EMI-TFSI+1mol/L LiTFSI和BMI-TFSI+1mol/L LiTFSI为电解质)的充放电曲线,充放电倍率均为0.1 C,充放电电压范围均为2.7~4.2 V。
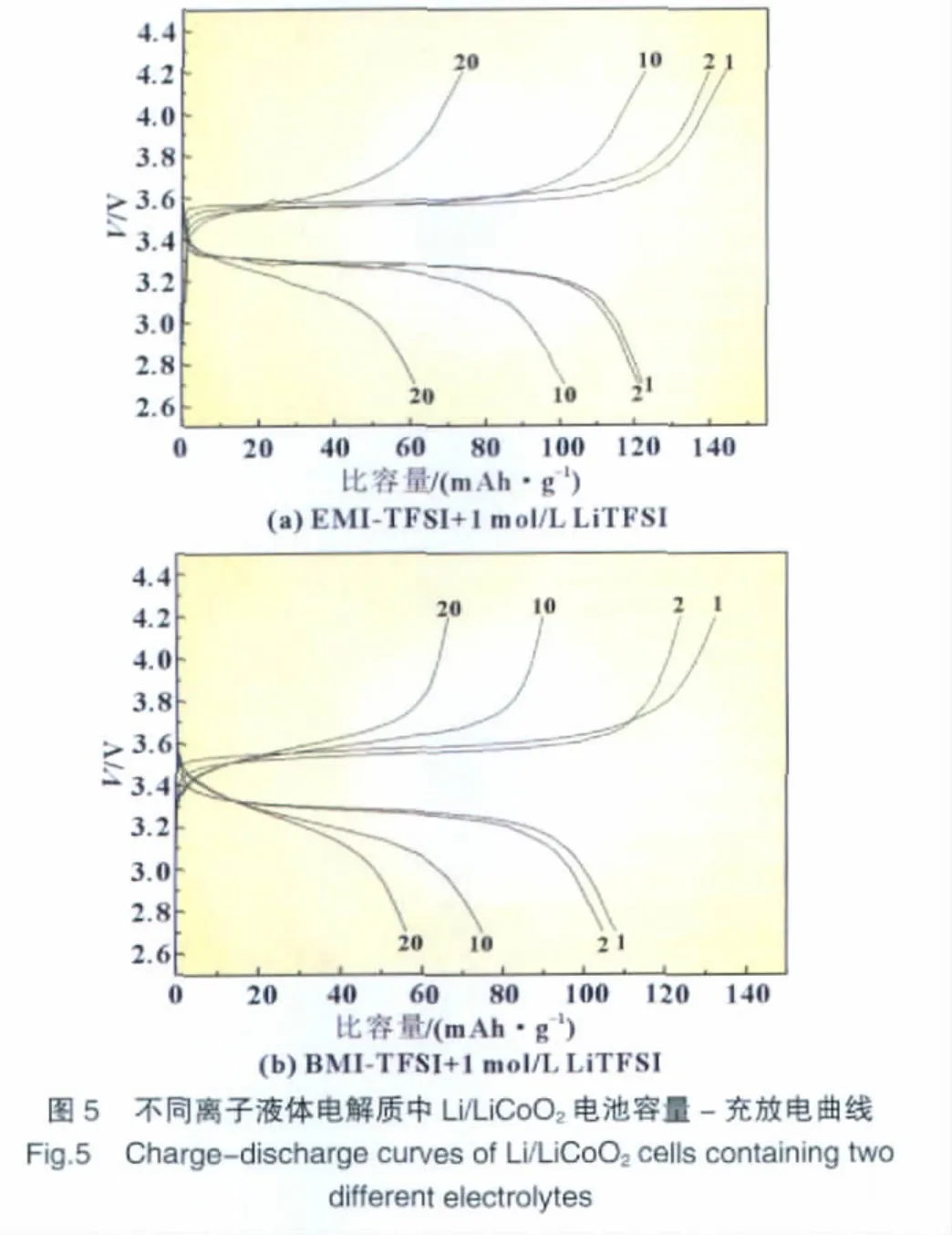
分别使用两种离子液体作为电解质时,“Li/LiCoO2”半电池的放电比容量衰减均比较大。由图5可知,Li/LiCoO2半电池以EMI-TFSI+1mol/L LiTFSI作为电解质时,经过20次充放电循环后,放电比容量从122 mAh/g逐步下降到58 mAh/g,且没有平稳的充放电电压平台,H.Sakaebe[10]研究了该体系作为锂离子电池电解质与LiCoO2的相容性,也发现Li/LiCoO2半电池的衰减比较大。当使用BMI-TFSI+1mol/L LiTFSI作为电解质时Li/LiCoO2半电池的放电比容量从108 mAh/g逐渐下降为56mAh/g,情况与前者类似。LiCoO2与离子液体电解质EMI-TFSI+1 mol/L LiTFSI以及BMI-TFSI+1 mol/L LiTFSI的相容性均比较差,原因可能是咪唑阳离子的稳定性欠佳,而且由于离子液体的黏度较大,当电池进行充放电循环时,会导致电导率下降以及与电极的浸润性变差,从而使得LiCoO2的比容量降低。
2.5 Li/LiFePO4半电池的充放电特征
图 6是 Li/LiFePO4电池 (分别使用EMI-TFSI+1 mol/L LiTFSI和BMI-TFSI+1mol/L LiTFSI为电解质)的充放电曲线,充放电倍率为0.1 C,充放电电压范围为2.7~4.2 V。
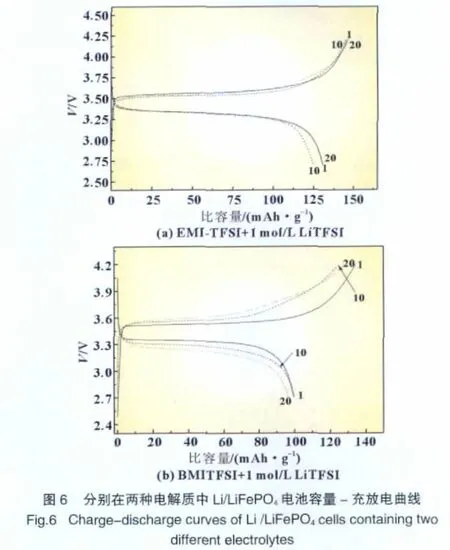
由图6(a)可以看出,以LiFePO4为正极材料,使用EMITFSI+1mol/L LiTFSI为电解质组装的半电池表现出了较高的比容量,且20次循环后几乎没有衰减,仍保持在128 mAh/g左右。而根据图6(b),电解质为BMI-TFSI+1mol/L LiTFSI时,半电池的放电比容量只有100mAh/g,但衰减也不很明显。离子液体电解质EMI-TFSI+1mol/L LiTFSI与LiFe-PO4的相容性要优于电解质BMI-TFSI+1mol/L LiTFSI。
以LiFePO4为正极材料,使用这两种不同的电解质组装半电池时,LiFePO4表现出了不同的性能,这可能是由于BMI-TFSI+1mol/L LiTFSI具有较低的电导率和较高的黏度,从而使得Li+从LiFePO4结构中脱出时更困难一些。此外由于BMI-TFSI的阳离子烷基碳链较长,也可能导致离子液体与电极材料的浸润性较差,从而降低了LiFePO4以BMI-TFSI+1 mol/L LiTFSI为电解质组装半电池的放电比容量。
3 结论
(1)离子液体电解质EMI-TFSI+1mol/L LiTFSI和BMI-TFSI+1mol/L LiTFSI具有较宽的电化学窗口,均大于4.5 V,都能满足锂离子电池实用性的需要。
(2)电解质 EMI-TFSI+1 mol/L LiTFSI和 BMI-TFSI+1 mol/L LiTFSI在温度为298 K时电导率分别为5.4 mS/cm和1.6mS/cm。在一定的温度范围内电导率与温度的关系均符合Arrhenius曲线。
(3)锂离子电池正极使用LiCoO2与阴离子为TFSI-的咪唑类离子液体电解质组装电池时比容量衰减较快,而采用LiFePO4时电池容量则基本上没有衰减,以EMI-TFSI+1.0 mol/L LiTFSI为电解质组装的半电池经过20次充放电循环,放电比容量仍能保持在120mAh/g以上。因此,LiFePO4与以TFSI-为阴离子的咪唑类离子液体电解质的相容性要优于Li-CoO2,是将来开发安全性能优异的以离子液体为电解质的锂离子电池的较好的正极材料。
[1]李汝雄.绿色溶剂——离子液体的合成和应用[M].北京:化学工业出社,2004:10.
[2]MARKEVICH E,BARANCHUGOV V,AURBACH D.On the possibility of using ionic liquidsaselectrolyte solution for rechargeable 5 V Li ion batteries[J].Electrochem istry Communications,2006,8:1331-1334.
[3]黄再波,高德淑,李朝晖,等.离子液体用作锂二次电池电解液的研究进展[J].电源技术,2006,30:774-778.
[4]SAKAEBE H,MATSUMOTO H.N-Methyl-N-propyl piperidiniumbis(trifluoro methansulfonyl)imide(PP13-TFSI)-novel electrolyte base for Li battery[J].Electrochem istry Communications,2003,5:594-598.
[5]XU JQ,YANG J,NULIY N,etal.Additive-containing ionic liquid electrolytes for secondary lithium battery[J].Journal of Power Sources,2006,160:621-626.
[6]W ILKES JS,LEVISKY JA,WILSON R A,et al.Dialkylim idazolium choroalum inatemelts:A new classof room-temperature ionic liquids for electrochem istry,spectroscopy,and synthesis[J].Inorganic Chem istry,1982,21:1263.
[7]HYUN B,DZYUBA SV,BARTSCH R A,etal.Intermolecular dynam icsof room-temperature ionic liquids:fem tosecong optical Kerr effectmeasurements on 1-alkyl-3-methylim idazolium bis((trifluoromethy)sulfony)imides[J].Journal of Physical Chem istry A,2002,106:7579-7585.
[8]邓友全.离子液体——性质、制备与应用[M].北京:中国石化出版社,2006:381-382.
[9]BEATRICE G,SERGE L,GERALD P,et al.Room temperature molten salts as lithium battery electrolyte[J].Electrochim ica Acta,2004,49:4583-4588.
[10]SAKAEBE H,MATSUMOTO H,TATSUMI K.Application of room temperature ionic liquids to Li batteries[J].Electrochimica Acta,2007,53:1048-1054.
