利用菌落多重PCR对传染性胸膜肺炎放线杆菌进行血清分型
2010-05-31杜昕波李伟杰
赵 耘,杜昕波,李伟杰,陈 敏,康 凯
(中国兽医药品监察所,北京 100081)
利用菌落多重PCR对传染性胸膜肺炎放线杆菌进行血清分型
赵 耘,杜昕波,李伟杰,陈 敏,康 凯
(中国兽医药品监察所,北京 100081)
参照文献报道的传染性胸膜肺炎放线杆菌的特异基因合成5对特异引物,建立传染性胸膜肺炎放线杆菌血清型分型的菌落多重PCR方法,结果为10株传染性胸膜肺炎放线杆菌血清型参考菌株均扩增出了相应的预期片段,而支气管败血波氏杆菌、多杀性巴氏杆菌、大肠埃希菌的扩增均为阴性。利用此多重PCR方法对41株传染性胸膜肺炎放线杆菌分离菌株进行血清型分型,结果所有菌株均扩增出了相应的特异片段,其中6株为1型,5株为7型,1株为5型,29株为9型。
传染性胸膜肺炎放线杆菌;菌落多重PCR;血清型;分型
猪传染性胸膜肺炎是由胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,App)引起的猪的呼吸道疾病。该病以胸膜肺炎和出血性、坏死性脑炎为特征,具有高发病率和死亡率的特点[1]。该病在世界范围内广泛存在,给养猪业带来严重的经济损失。目前,发现胸膜肺炎放线杆菌有15个血清型(其中5型又分为5a和5b),而且某些血清型之间存在交叉反应。不同血清型之间及同一血清型不同菌株之间的毒力均存在差异,从而导致该病的诊断非常困难[2]。研究发现本菌可产生4种毒素,即apxⅠ、apxⅡ、apxⅢ和apxⅣ。其中apxⅠ、apxⅡ、apxⅢ不仅是本菌主要的毒力因子,而且是主要的保护性抗原。apxⅠ主要由1、5、9、11和14型分泌,apxⅡ由除10和14型的所有型菌株分泌,apxⅢ由2、4、6、8和15型分泌,而apxⅣ存在于所有的血清型中,但其只能在猪体内表达,此毒素在不同的型之间其大小是不同的[3]。本试验参照文献报道[3]合成5对引物建立多重PCR方法,并利用所建立的多重PCR方法对41株传染性胸膜肺炎放线杆菌分离菌株进行鉴定和分型,以期为传染性胸膜肺炎的临床快速诊断提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株 传染性胸膜肺炎放线杆菌定型参考菌 株 包 括 CVCC259、CVCC260、CVCC261、CVCC262、 CVCC263、 CVCC264、 CVCC265、CVCC266、CVCC267、CVCC268,血清型分别为1 型~10型,由中国兽医药品监察所菌种保藏中心提供;传染性胸膜肺炎放线杆菌分离菌株41株由兽医微生物资源平台项目收集,保存于中国兽医药品监察所菌种保藏中心,编号分别为 CVCC3559~CVCC3595、CVCC3597 ~ CVCC3600,用时供应 ;支气管败血波杆菌 CVCC3000、多杀性巴氏杆菌CVCC431、大肠埃希菌CVCC195由中国兽医药品监察所菌种保藏中心提供。
1.1.2 主要试剂及培养基Taq酶、10×PCR buffer(含 25 mmol/μ L MgCl2)、dNTP、DNA Marker DL 2 000、琼脂糖购自宝生物工程(大连)有限公司;其他培养基均由本所基础保障室提供。
1.2 方法
1.2.1 菌株培养 将冻干保存的多杀性巴氏杆菌用适量马丁汤溶解,接种改良马丁琼脂斜面,37℃过夜培养,取斜面培养物划线接种改良马丁琼脂平板(含40 mL/L马血清和1 g/L血红素)、普通琼脂平板以及麦康凯琼脂平板,37℃培养24 h;支气管败血波氏杆菌和大肠埃希菌是用适量的营养肉汤溶解冻干菌株,接种普通琼脂斜面,37℃过夜培养,取斜面培养物划线接种普通琼脂平板,37℃培养24 h;胸膜肺炎放线杆菌是用适量添加200 mg/L辅酶Ⅰ(NAD)、80 mL/L灭活小牛血清的胰蛋白胨大豆肉汤溶解冻干菌株,接种添加200 mg/L辅酶Ⅰ、80 mL/L灭活小牛血清的胰蛋白胨大豆琼脂斜面,37℃过夜培养,取斜面培养物划线接种添加200 mg/L辅酶Ⅰ、80 mL/L灭活小牛血清的胰蛋白胨大豆琼脂平板[4]。分别取传染性胸膜肺炎放线杆菌培养物涂片、革兰染色。单菌落直接作为PCR反应的模板进行菌落PCR。
1.2.2 PCR引物合成 参考文献报道的引物序列[3],由上海Invitrogen公司合成。将各引物浓度稀释至25 μ mol/L置-20℃保存备用。引物的序列和位置见表1,血清型与片段大小对照见表2。

表1 引物的序列及位置Table 1 The sequence and position of primers
1.2.3 PCR扩增 PCR反应体系为50 μ L,依次加入10×PCR 缓冲液(含 25 mmol/L MgCl2)5 μ L、6 对引物(25 μ mol/L)各 1 μ L 、dNTP(2.5 μ mol/L)4 μ L 、Taq酶(5 U/μ L)1 μ L 、双蒸水 28 μ L,用灭菌枪头挑取平板上的单个菌落,悬浮于各PCR反应液中。PCR反应条件为:95℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸3 min,30个循环;最后72℃延伸10 min。PCR产物经20 g/L琼脂糖凝胶电泳检测。
1.2.4 特异性检测 利用以上方法分别对支气管败血波氏杆菌、多杀性巴氏杆菌和大肠埃希菌进行多重PCR,以检测其特异性。
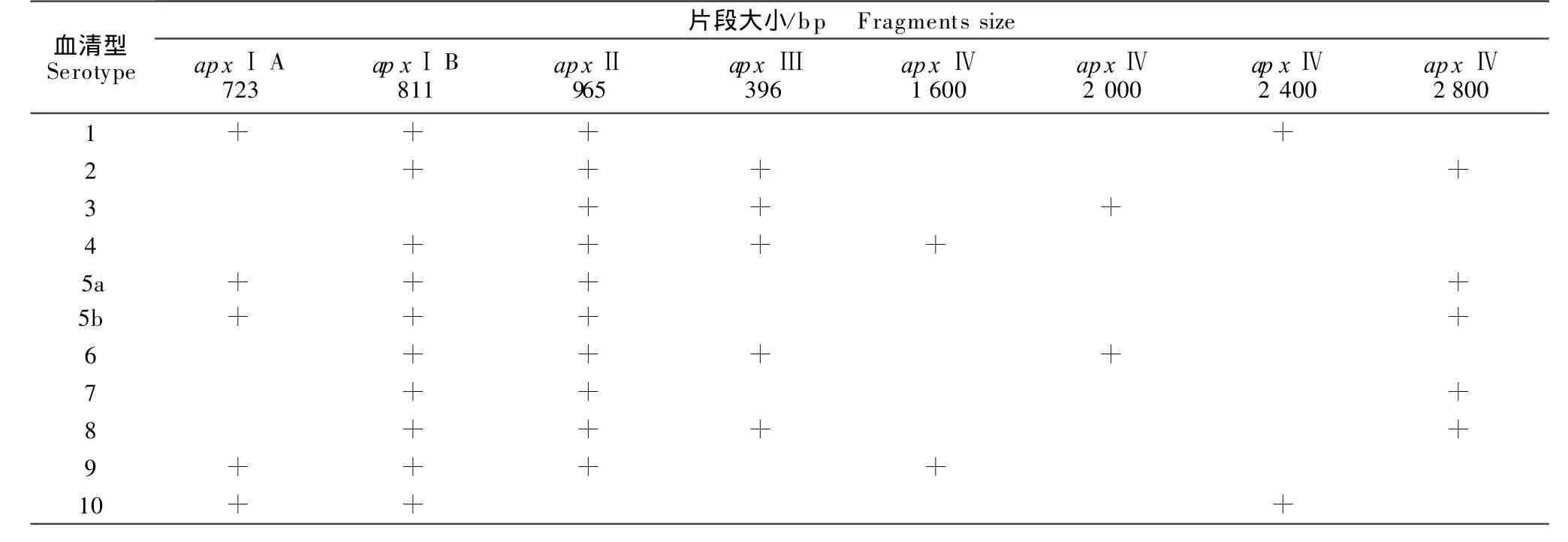
表2 1型~10型菌株PCR扩增片段大小Table 2 The PCR results of 1-10 serotype of Actinobacillus pleuropneumoniae strains
1.2.5 多重PCR的初步应用 将本所保存的41株传染性胸膜肺炎放线杆菌分离菌株进行菌落多重PCR。
2 结果
2.1 传染性胸膜肺炎放线杆菌的菌体形态和培养特性
51株传染性胸膜肺炎放线杆菌分离株与参考菌株在添加NAD和血清的TSA平板上生长良好,菌落为圆润、光滑、边缘整齐的小菌落;在添加NAD和绵羊鲜血的TSA平板上可产生明显的β溶血;在麦康凯琼脂平板和普通琼脂平板上不生长。显微镜下可见各菌株均为革兰阴性球杆菌,具多形性。
2.2 定型参考菌株多重PCR结果
结果见图1、表3。10株定型参考菌株均扩增出了预期的片段,而用此方法对支气管败血波氏杆菌、胸膜肺炎放线杆菌、大肠埃希菌进行多重PCR,结果均未扩增出相应的目的片段。
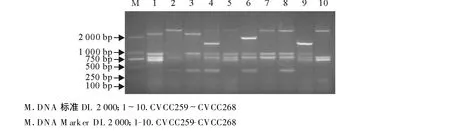
图1 定型参考菌株多重PCR结果Fig.1 The PCR results of Actinobacillus pleuropneumoniae references strains
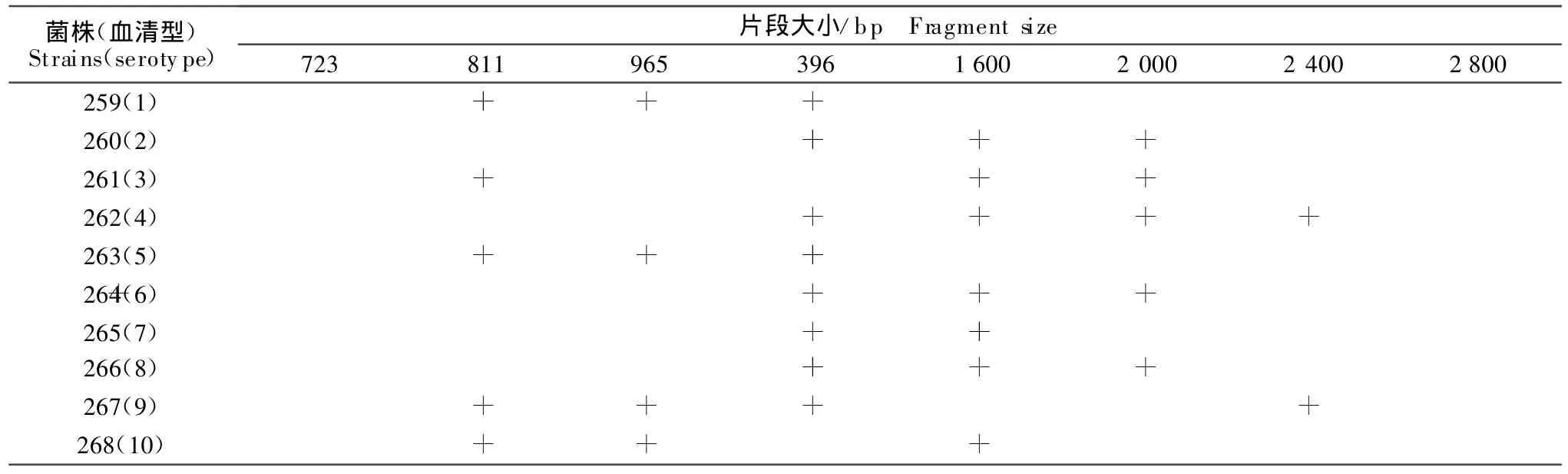
表3 10株定型参考菌株多重PCR片段大小结果Table 3 The PCR results of 10 Actinobacillus pleuropneumoniae references strains
2.3 多重PCR的初步应用
利用此多重PCR方法对41株传染性胸膜肺炎放线杆菌分离菌株进行扩增,结果所有菌株均扩增出了相应的特异片段,其中6株为1型,5株为7型,1株为5型,29株为9型。
3 讨论
传染性胸膜肺炎放线杆菌有多个血清型,且不同血清型之间存在着交叉反应,这给传染性胸膜肺炎的血清学检测造成了极大的困难。自20世纪80年代末期我国出现传染性胸膜肺炎,近年来对本病的报道逐年增多,现已成为危害我国养猪业发展的重要传染病之一,给我国养猪业造成了巨大的经济损失,因此快速准确地检测不同血清型胸膜肺炎放线杆菌对预防和控制本病有着极其重要的意义。
本研究中10株定型参考菌株为本所保存菌株,其血清型是通过凝集试验所得,而利用多重PCR的结果与其完全一致,说明这两种方法具有较高的符合率。同时用此多重PCR方法对常见的猪呼吸道疾病有关的病原体如支气管波氏杆菌、多杀性巴氏杆菌、大肠埃希菌等均不能扩增出特异性片段,具有良好的特异性。用此方法对41株分离株进行鉴定,结果6株为1型,5株为7型,1株为5型,29株为9型。
目前已建立了多个用于传染性胸膜肺炎放线杆菌诊断的PCR方法,分别进行传染性胸膜肺炎放线杆菌的定性诊断[5]、某个血清型或几个血清型进行诊断[6-9],或者所建立的方法要分几步进行[11-12],本研究通过多重PCR对猪传染性胸膜肺炎放线杆菌的外毒素apxⅠ、apxⅡ、apxⅢ、apxⅣ基因进行一步扩增,除血清 2型(CVCC260)和 8型(CVCC266)外,其他8种不同血清型的菌株均可区分开,该结论与文献报道一致[7]。目前已知可以根据血清2型荚膜多糖基因差异设计引物区分2型和8型[9]。传染性胸膜肺炎放线杆菌有15个血清型,本研究中仅涉及到1~10血清型,是否适用于11~15血清型尚有待于进一步验证。
[1]斯劳特,阿莱尔,蒙加林,等.猪病学[M].赵德明,张中秋,沈建忠,译.8版.北京:中国农业科技出版社,357-367:957-959.
[2]陈 凡,何启盖,程焕春,等.胸膜肺炎放线杆菌I型标准抗血清的制备和初步临床应用[J].中国预防兽医学报,2004,26(6):458-461
[3]Nabin R,Sung J S,Sang G K,et al.Development and use of a multiplex polymerse chain reation assay based on Apx toxin genes for genotyping ofActinobacillus pleuropneumoniaeisolates[J].J Vet Diagn Invest,2005,17:359-362.
[4]罗如松,郭爱珍,林荔雯,等.猪胸膜肺炎放线杆菌浊度与细菌计数的关系[J].畜牧与兽医,2005,37(10):10-12.
[5]Gram T,Ahrens P,Nielsen J P.Evaluation of a PCR detection ofActinobacillus pleuropneumoniaein mixed bacterial cultures from tonsils[J].Vet Microbiol,1996,51:95-104.
[6]Terry M L O,Ward C K.Detection and identification ofActinobacillus pleuropneumoniaeserotype 5 by multiplex PCR[J].J Clin Microbiol,1998,36(6):1704-1710.
[7]Jessing S G,Angen O,Inzana T G.Evaluation of a multiplex PCR test for simultaneous identification and seroty ping ofActinobacillus pleuropneumoniaeserotypes 2,5,and 6[J].J Clin Microbiol,2003,41(9):4095-4100.
[8]Schucher J A,Inzana T J,Angen O,et al.Detection and Identification ofActinobacillus pleuropneumoniaeserotypes 1,2 and 8 by multiplex PCR[J].J Clin Microbiol,2004,42(9):4344-4348.
[9]Zhou L,Jones S C P,Angen O,et al.Multiplex PCR that can distinguish between immunologically crossreactive serovar 3,6 and 8Actinobacillus pleuropneumoniaestrains[J].J Clin Microbiol,2008,46(2):800-803.
[10]Sthitmatee N,Sirinarumitr T,Makonkey oon L,et al.Identification of theActinobacillus pleuropneumoniaeserotype using PCR based-apx genes[J].Mol Cell Probes,2003,17:301-305.
[11]夏炉明,史一博,李树清,等.复合PCR进行胸膜肺炎放线杆菌血清型快速分型[J].中国兽医学报,2007,27(4):497-502.
[12]朱良全,薛青红,蒋玉文,等.胸膜肺炎放线杆菌血清学分型多重PCR方法的建立[J].中国预防兽医学报,2006,28(5):585-588.
Identification and Seroptyping ofActinobacillus pleuropneumoniaeby the Colony Multiplex PCR
ZHAO Yun,DU Xin-bo,LI Wei-jie,CHEN Min,KANG Kai
(China Institute of Veterinary Drug Control,Beijing,100081,China)
Five pairs of primers against specific gene were designed and the colony multiplex PCR of identification and serogrouping ofActinobacilluspleuropneumoniaewere developed.10Actinobacillus pleuropneumoniae
trains including serotype 1-10 were identified using the colony multiplex PCR assay.The expected sequences were obtained successfully by the colony multiplex PCR assay.But the sequenceswere notobtained fromE.coli,B.bronchisepticaandP.multocida.41Actinobacillus pleuropneumoniaestrains were identified using the colony multiplex PCR assay.The result showed that all of these strains were obtained the expected sequences by the colony multiplex PCR assay,and 6 strains were serotyps 1,5 strains were serotype 7,1 strain was serotype 5,29 strains were serotype 9.
Actinobacillus pleuropneumoniae;colony multiplex PCR;serotype;serotyping
S852.619;Q789
A
1007-5038(2010)01-0009-04
2009-07-09
国家科技支撑计划(2006BAD06A11)
赵 耘(1968-),女,陕西西安人,副研究员,博士,主要从事兽医微生物鉴定及相关研究。
