肾癌患者外周血和肿瘤组织内Treg细胞比例与预后的关系
2010-05-31张朝华赵春利
张朝华 ,赵春利
(1.河北大学医学部2007级硕士研究生,河北 保定 071000;2.河北省保定市第一医院,河北 保定 071000;3.河北大学附属医院泌尿外科,河北 保定 071000)
Treg细胞(CD4+CD25+Foxp3+调节性T细胞)是一类可抑制免疫反应、维持机体免疫状态稳定的T淋巴细胞亚群[1-2]。Treg细胞可抑制CD4+和CD8+T淋巴细胞介导的免疫反应,已有大量研究显示,Treg细胞在抑制同种异体器官移植的排斥反应、移植物抗宿主病及自身免疫性疾病的发病机制中起着重要作用[3]。在肿瘤患者及肿瘤动物模型中,均发现Treg细胞可负性调节机体抗肿瘤免疫反应,引起荷瘤机体T淋巴细胞功能障碍[4]。近年来,在结直肠癌、胆囊癌、胰腺癌、卵巢癌、肺癌等实体肿瘤患者体内均发现了Treg细胞百分率显著增多[5-8]。目前,关于Treg细胞诱导机体产生肿瘤免疫耐受状态的具体机制仍未明确,且有关其在泌尿系肿瘤发生、发展中的作用及其与临床分期、预后等相关性的研究较其他肿瘤明显偏少。为此,本研究综合分析了Treg细胞与肾癌患者临床预后间的关系。
1 材料与方法
1.1 材料
病例资料与标本:实验组为河北大学附属医院和保定市第一医院2007年7月至9月收治的30例肾癌患者,均接受根治性手术,肿瘤标本直接从手术切除标本上获取。其中男14例,女16例,年龄19~70岁,中位年龄54岁;因健康体检发现者9例,以血尿为主要症状者8例,腰酸8例,腹痛5例;Robson分期为Ⅰ期9例,Ⅱ期12例,Ⅲ期5例,Ⅳ期4例;术后病理检查示透明细胞癌9例,颗粒细胞癌2例,混合细胞癌6例,嫌色细胞癌7例,其他病理类型6例。
仪器与试药:EPLCS2 XL型流式细胞仪(美国Beckman Coulter Cytomics公司)。三色荧光标记的T淋巴细胞亚群检测试剂盒及anti-CD4-异硫氰酸荧光素(FITC)/anti-CD25-异藻青蛋白(APC)/anti-Foxp3-藻红蛋白(PE),同型阴性对照为 IgG1-FITC/IgG1-APC/IgG1-PE,甲酸溶血剂(美国 Beckman Coulter公司);真空采血管,内加EDTA-K2抗凝剂。
1.2 方法
组织细胞处理方法:术中切取肿瘤中心部位组织,将其剪碎,制成直径约1 mm的组织块。经400目筛网研磨后以磷酸盐缓冲液(PBS)冲洗、悬浮,以2 000 r/min转速离心5 min后弃去上清液,重复操作两次后以显微镜计数。以PBS充分洗涤后重悬,制成每100 μL悬液中含106个细胞的单细胞悬液。加入FITC标记的鼠抗人CD4抗体、APC标记的鼠抗人CD25抗体,4℃避光孵育30 min后以PBS洗涤2次,加入1 mL红细胞裂解液裂解2 min,充分洗涤后加入新鲜配制的破膜液1 mL,4℃避光孵育60 min后加破膜缓冲液洗涤,加入正常鼠血清封闭抗体15 min,再加入PE标记的Foxp3抗体,4℃避光孵育30 min后上流式细胞仪检测。测定每份标本的10 000个淋巴细胞中Treg细胞的百分率。
外周血细胞处理方法:分别于手术前及免疫治疗前后无菌采血2 mL。用等量PBS混匀后,按1∶1的体积比将外周血稀释液沿试管壁缓缓加入淋巴细胞分离液上层,常温离心(2 000 r/min)30 min。用移液管缓慢均匀吸出红细胞层与血清分离液层中间的单个核细胞(PBMC)层,轻轻地将吸出灰白色的PBMC分别置离心管,再次用PBS洗涤两次,离心弃去上清液。于离心管中加入FITC标记的鼠抗人CD4/异藻青蛋白(APC)标记的鼠抗人CD25抗体,4℃避光30 min后PBS洗涤,加入新鲜配制的专用破膜剂1 mL,4℃避光60 min后破膜剂缓冲液洗涤,加入正常鼠血清封闭抗体15 min,加入藻红蛋白(PE)标记的Foxp3单克隆抗体,4℃避光30 min后破膜剂缓冲液洗涤,制成标准样品上机检测,观察Treg细胞水平。
随访:手术前与患者充分沟通,确定术后随访方案。所有患者均从出院后开始随访,主要采用门诊随访、电话随访及网络随访相结合的方式。术后第1年随访间隔时间为3个月,复查项目包括腹部CT及B型超声、肿瘤标志物等。术后第2年、第3年随访间隔时间为6个月。随访终点设定为患者死亡或生存期满36个月。
1.3 统计学方法
应用SPSS13.0软件,两组比较采用Wilcoxon秩和检验,单因素生存分析采用Kaplan-Meier法,组间比较采用Log-rank检验。以36个月为截尾时间,非肿瘤相关性死亡为散失。P<0.05为差异有统计学意义。
2 结果
30例患者随访至2010年7月,随访时间16~41月,失访2人,失访率为6.67%。患者总生存时间平均29.0月(95%可信区间为 24.5-33.5),无复发生存时间平均 23.7月(95%可信区间为 19.9 -27.2)。
30例患者外周血Treg细胞百分率平均值为(2.24±0.35)%,故以2.24%为标准将患者分为Treg细胞高水平组(>2.24%)和低水平组(≤2.24%);患者肿瘤组织内Treg细胞百分率平均值为0.091%,故以0.091%为标准将患者分为Treg细胞高水平组(>0.091%)和低水平组(≤0.091%)。患者生存时间与外周血及肿瘤组织内Treg细胞百分率、肿瘤分期的相关性分析见表1。可见,患者生存时间与外周血Treg细胞百分率显著相关,与肿瘤组织内Treg细胞百分率不相关,与肿瘤Robson分期密切相关,与病理类型则无显著相关性。
3 讨论
TNM分期标准中,仅通过肿瘤原发灶直径和肿瘤浸润深度、淋巴结转移数目等来判断局限性肾癌与进展期肾癌的预后。从最终的临床效果来看,单纯凭影像学检查及现有病理学分级标准无法准确判断患者预后,使部分患者失去了早期干预治疗的机会。因此,期望能找到更加合理有效的临床预后指标,用以早期提示高危患者,甚至预测术后相关治疗的临床疗效。
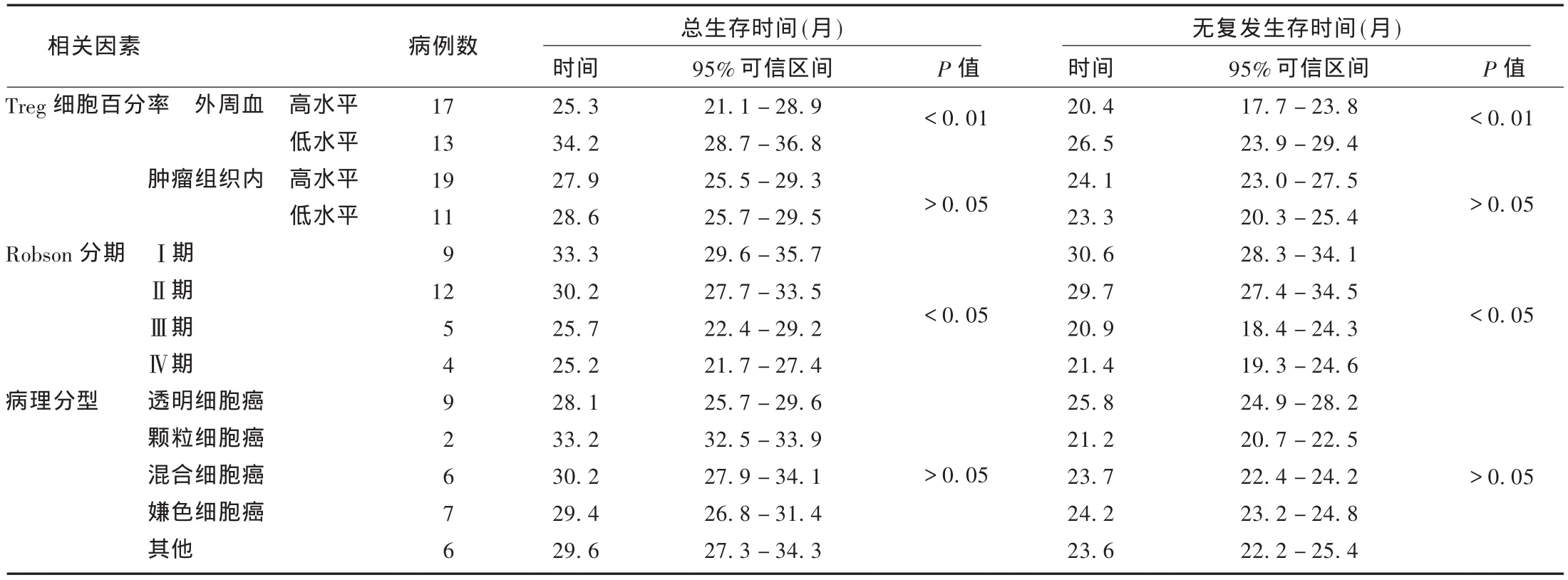
表1 患者生存时间的相关因素分析
Treg细胞在肿瘤免疫中的作用是目前的研究热点之一,现已在肺癌、胰腺癌、胃癌、结肠癌、卵巢癌等肿瘤患者全身以及肿瘤微环境进行了大量研究。Sasada等[9]检测了局限性进展期胃癌患者及远处转移的胃癌患者外周血中Treg细胞的百分率及表型,与健康志愿者相比,胃癌患者外周血中Treg细胞百分率较高,已发生远处转移患者更高;Treg细胞百分率与肿瘤预后明显相关,随着Treg细胞百分率的升高,患者预后越差。Ormandy等[10]则发现,肝癌患者外周血及肿瘤组织内Treg细胞百分率较正常人均明显升高,且慢性病毒性肝炎患者处于疾病活动期时外周血中的Treg细胞水平也较恢复期时明显升高。近年来积累的大量研究结果显示,机体是通过Treg细胞的主动免疫抑制作用来维持自身免疫耐受,包括下调效应性T细胞对自身抗原和外来抗原的应答反应等机制,从而起到负性免疫调节作用;但与此同时,这也减弱了机体对肿瘤细胞的免疫监视功能,增加了肿瘤细胞的免疫逃逸概率,使肿瘤细胞不仅不易被早期识别、杀灭,而且更易发生早期转移。这一理论可以部分解释机体对肿瘤抗原弱反应性的原因。
本研究在测定了肾癌患者外周血及肿瘤组织中Treg细胞百分率的基础上,进一步研究了其与肾癌患者预后的关系。单因素分析结果显示,肾癌患者总生存时间和无复发生存时间与外周血中Treg细胞百分率显著相关,水平较高者术后复发时间较早,总生存时间也较短,说明外周血中Treg细胞百分率可以作为提示肾癌患者预后的指标之一;肿瘤组织内的Treg细胞百分率与总生存时间和无复发生存时间都无显著相关性,说明这一指标对肾癌预后的影响仍不明确,尚需进一步研究。
由于肾癌的手术治疗效果目前仍不理想,因此近年来医学界更加重视术前筛选预后较差的高危患者,术后早期进行有效的抗肿瘤免疫治疗,而如何筛选及预测哪些患者对何种抗肿瘤免疫治疗方案更加敏感是目前肾癌研究的重要内容。本研究证实,外周血中Treg细胞水平可作为预测肾癌预后的指标之一,而肿瘤组织内的Treg细胞百分率水平则无法肾癌预后。因此,术前检测肾癌患者外周血中Treg细胞百分率,有助于筛选高危患者亚群,从而在术后早期给予适当的抗肿瘤免疫治疗,改善肾癌的综合治疗效果。
[1]Joneleit H,Schmitt E,Stassen M,et al.Identification and functional characterization of human CD4(+)CD25(+)T cells with regulatory properties isolated from peripheralblood[J].JExpMed,2001,193:1285.
[2]Ng WF,Duggan PJ,Ponchel F,et al.Human CD4(+)CD25(+)cells:A naturally occurring population of regulatory T cells[J].Blood,2001,98:2 736.
[3]Sakaguchi S,Sakaguchi N,Shimizu J,et al.Immunologic tolerance maintained by CD4(+)CD25(+)regulatory T cells:Their common role in controlling autoimmunity,tumor immunity,and transplantation tolerance[J].Immunol Rev ,2001,182:18.
[4]Somasundaram R,Jacob L,Swoboda R,et al.Inhibition of cytolytic T lymphocyte proliferation by autologous CD4(+)CD25(+)regulatory T cells in a colorectal carcinoma patient is mediated by transforming growth factorbeta[J].Cancer Res,2002,62:5 267.
[5]Sasada T,Kimura M,Yoshida Y,et al.CD4(+)CD25(+)regulatory T cells in patients with gastrointestinal malignancies:Possible involvement of regulatory T cells in disease progression[J].Cancer,2003,98:1 089.
[6]Liyanage UK,Moore TT,Joo HG,et al.Prevalence of regulatory T cells is increased in peripheral blood and tumor microenvironment of patients with pancreas or breast adenocarcinoma[J].J Immunol,2002,169:2 756.
[7]Woo EY,Chu CS,Goletz TJ,et al.Regulatory CD4(+)CD25(+)T cells in tumors from patients with early-stage non-small cell lung cancer and late - stage ovarian cancer[J].Cancer Res,2001,61:4 766.
[8]Woo EY,Yeh H,Chu CS,et al.Cutting edge:Regulatory T cells from lung cancer patients directly inhibit autologous T cell proliferation[J].J Immunol,2002,168:4 272.
[9]Sasada T,Kimura M,Yoshida Y,et al.CD4+CD25+regulatory T cells in patients with gastrointestinal malignancies:possible involvement of regulatory T cells in disease progression[J].Cancer,2003,98(5):1 089 - 1 099.
[10]Ormandy LA,Hillemann T,Wedemeyer H,er al.Increased populations of regulatory T cells in peripheral blood of patients with hepatocellular carcinoma[J].Cancer Res,2005,65(6):2 457 - 2 464.