铬铝基柱撑蒙脱石的制备与孔道结构
2010-05-31刘晓文钟钢刘庄毛小西
刘晓文,钟钢,刘庄,毛小西
(中南大学 资源加工与生物工程学院,湖南 长沙,410083)
层状硅酸盐矿物是制备多孔材料的优良原料[1]。以天然蒙脱石为原料合成的柱撑蒙脱石材料具有孔径均匀、可调的特点,在许多工业领域特别是石油化工、环境保护等行业有着潜在的应用前景[2]。近年来,研究方向主要集中在催化剂及催化载体和环保材料2大领域[3]。目前,人们重视对复合离子柱化剂柱撑蒙脱石的研究,其中涉及的柱化剂溶液主要是由Al离子与另外一种金属离子组成的混合溶液[4],如 Ga-Al,Ln-Al,Si-Al,Fe-Al,Cr-Al和 Zr-Al等复合离子柱化剂柱撑蒙脱石[5-10],可以进一步增强柱撑蒙脱石的热力学稳定性,扩大其应用范围。Benito等[6]的研究表明:镓铝基柱撑蒙脱石在200 ℃时比铝基柱撑蒙脱石具有较高的布朗斯特酸性,对1, 2, 4-三甲苯的歧化选择性较高,表明布朗斯特酸性与催化活性存在一定的相关性;赵东源等[11-12]的研究结果表明:羟基镍铝交联柱撑蒙脱石和羟基硅铝交联蒙脱石的热稳定性好,对异丙苯的裂解活性较高,Ni和Si的引入增加了布朗斯特酸性,从而加强了其反应性能,因而在重油及大分子裂解过程中显示了广阔的发展前景。CAO等[13-14]研究表明:将铬铝基柱撑蒙脱石对水溶液中Cr6+的吸附明显优于未经改性的蒙脱石,溶液在室温和pH为4.0的条件下,柱撑蒙脱石投加量4 mg/L,柱撑蒙脱石投入量0.5 g,振荡时间为80 min,铬铝基柱撑蒙脱石对Cr6+的去除率可达50%,可将其用于废水溶液中Cr6+的吸附。Zielke等[15]使用羟基铝离子聚合羟基铬离子制成的柱撑黏土,对一氯苯酚、三氯苯酚、五氯苯酚进行吸附、脱附和分解。吴平霄等[16]在羟基金属柱撑金属柱撑蒙脱石吸附苯酚的实验中发现,羟基金属柱撑蒙脱石对苯酚的吸附能力不仅取决于面网间距和表面积,还取决于吸附剂的微孔结构和表面组分,这表明羟基金属柱撑蒙脱石对有机物有不同的机理吸附。本文作者以钠基蒙脱石作为原料,采用取代法合成铬铝柱化剂,并用湿法工艺制备铬铝基柱撑蒙脱石,研究不同Cr离子与Al离子物质的量比和pH对铬铝基柱撑蒙脱石制备工艺的影响,并对柱撑前后蒙脱石的比表面积、层间距、孔径分布进行表征。
1 实验
1.1 原料和化学试剂
本实验以钠基蒙脱石作为实验原料,其化学分析结果(质量分数)见表1。
化学试剂为氢氧化钠、氯化铝和氯化铬试剂,均为分析纯。
1.2 实验方法
1.2.1 柱化剂的制备
在60 ℃水浴锅中,将浓度为0.4 mol/L的NaOH溶液滴加入到100 mL浓度为0.2 mol/L的CrCl3和浓度为0.2 mol/L的AlCl3的混合溶液后,搅拌2 h,然后,老化48 h。
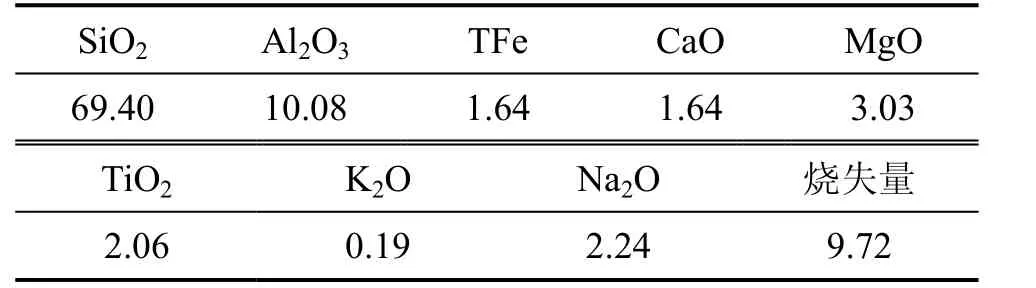
表1 钠基蒙脱石的化学成分Table 1 Chemical compositions of Na-montmorillonite %
1.2.2 柱撑蒙脱石的制备
将钠化蒙脱石配成质量分数为1%的悬浮液,再按n(Cr3++Al3+)/m(蒙脱石)=10 mmol/g取相应体积的柱化液,将柱化液滴加到钠化蒙脱石悬浮液中并不断搅拌,反应温度控制在60 ℃,滴加完毕后继续搅拌2 h,然后,在60 ℃老化48 h,将混合液离心洗涤至清液中无Cl-(用0.1 mol/L的AgNO3检验),再在60 ℃烘干,即得Cr-Al基柱撑蒙脱石。
1.3 性能表征
采用日本理学Rigaku D/MAX-rA型X线衍射仪对制备的柱撑蒙脱石(001)面网层间距(d(001))进行测定,采用Cu Kα靶,步宽为0.02°,工作电压为40 kV,工作电流为300 mA,扫描范围为2.5°~80°。采用美国Nicolet公司Nexus 670红外光谱仪表征柱撑前后的蒙脱石,将样品与KBr混合压片,于室温下扫描,扫描范围为400~4 000 cm-1,分辨率为4 cm-1。 采用美国康塔公司的Autosorb-1型BET比表面及孔径分布分析仪对柱撑前后蒙脱石进行表征,使用氮气吸附,静态容量法测定。测定条件为:压力为标准大气压,样品测定前在260 ℃脱附8 h。
2 结果与讨论
2.1 Cr离子与Al离子物质的量比对柱撑蒙脱石的影响
在60 ℃、柱撑溶液老化时间为48 h的条件下,采用不同Cr离子与Al离子物质的量比合成的柱化剂来制备铬铝基柱撑蒙脱石,对其进行了X线衍射分析,结果见图1。由图1可知:不同Cr离子与Al离子物质的量比合成的柱化剂均能置换钠基蒙脱石中的钠离子,从而进入蒙脱石的层间,生成的(001)面网层间距(d(001))比钠基柱撑蒙脱石大;当Cr离子与Al离子物质的量比为1∶5和5∶1时,d(001)略有减小,其峰型变宽;当Cr离子与Al离子物质的量比为2∶1时,层间距d(001)最大,即柱撑效果最佳。这是由于铬离子的离子半径(0.069 nm)大于铝离子半径(0.051 nm),且在铝聚合中铬离子取代部分铝离子后,进入蒙脱石层间,导致蒙脱石(001)面网层间距(d(001))变大,而且当 Cr离子与Al离子物质的量比为2∶1时,取代聚合铝离子的铬离子数量较多,柱撑效果较佳。
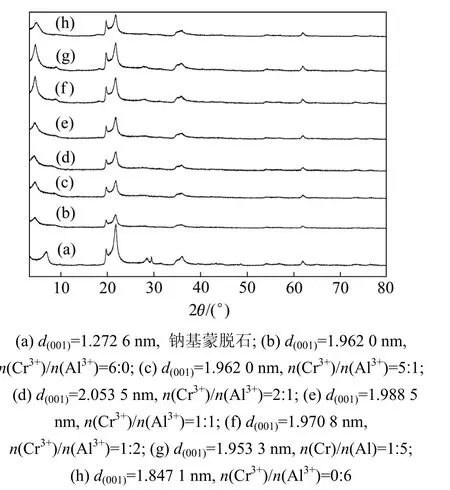
图1 不同铬铝物质的量比合成柱化剂制备的柱撑蒙脱石的X线衍射谱Fig.1 XRD patterns of pillared montmorillonite with different molar ratios of Cr ion to Al ion
2.2 OH-与(Cr+Al)离子物质的量比对柱撑蒙脱石的影响
在温度为 60 ℃,Cr离子与 Al离子物质的量比n(Cr3+)/n(Al3+)=2∶1的条件下,用0.4 mol/L NaOH滴定100 mL浓度为 0.2 mol/L CrCl3和浓度为 0.2 mol/L AlCl3混合组成的柱化剂溶液,其pH随NaOH的加入而发生变化,见图2。由图2可知:当NaOH的体积比较小时,只有部分的Cr3+和Al3+单体化合物进入硅酸盐的层与层之间。当加入NaOH的体积较大时,产生了类似Keggin离子Al13低聚物结构,导致了黏土层间的柱撑;当NaOH的体积为130 mL时,溶液的pH发生较大变化且出现混浊,这主要是由于 NaOH与CrCl3和AlCl3溶液开始反应形成了Cr(OH)3和Al(OH)3沉淀,当NaOH的体积为140 mL时,溶液大部分生成了沉淀;因此,NaOH的体积过多或过少都对柱撑不利。
图3所示为不同OH-与(Al+Cr)离子物质的量比时制备铬铝基柱撑蒙脱石的X线衍射谱。在60 ℃,Cr离子与Al离子物质的量比为2∶1条件下,用0.4 mol/L NaOH滴定100 mL 0.2 mol/L CrCl3和0.2 mol/L AlCl3混合组成的柱化剂溶液,生成的柱撑蒙脱石(001)面网层间距(d(001))随着 OH-与(Al+Cr)离子物质的量比的变化见图3。
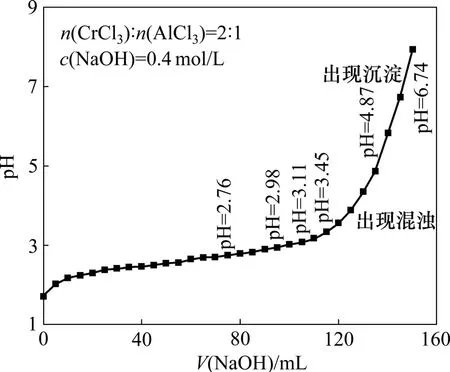
图2 铬铝柱化剂制备过程中pH与V(NaOH)的关系Fig.2 Relationship between pH and V(NaOH) of pillaring solution
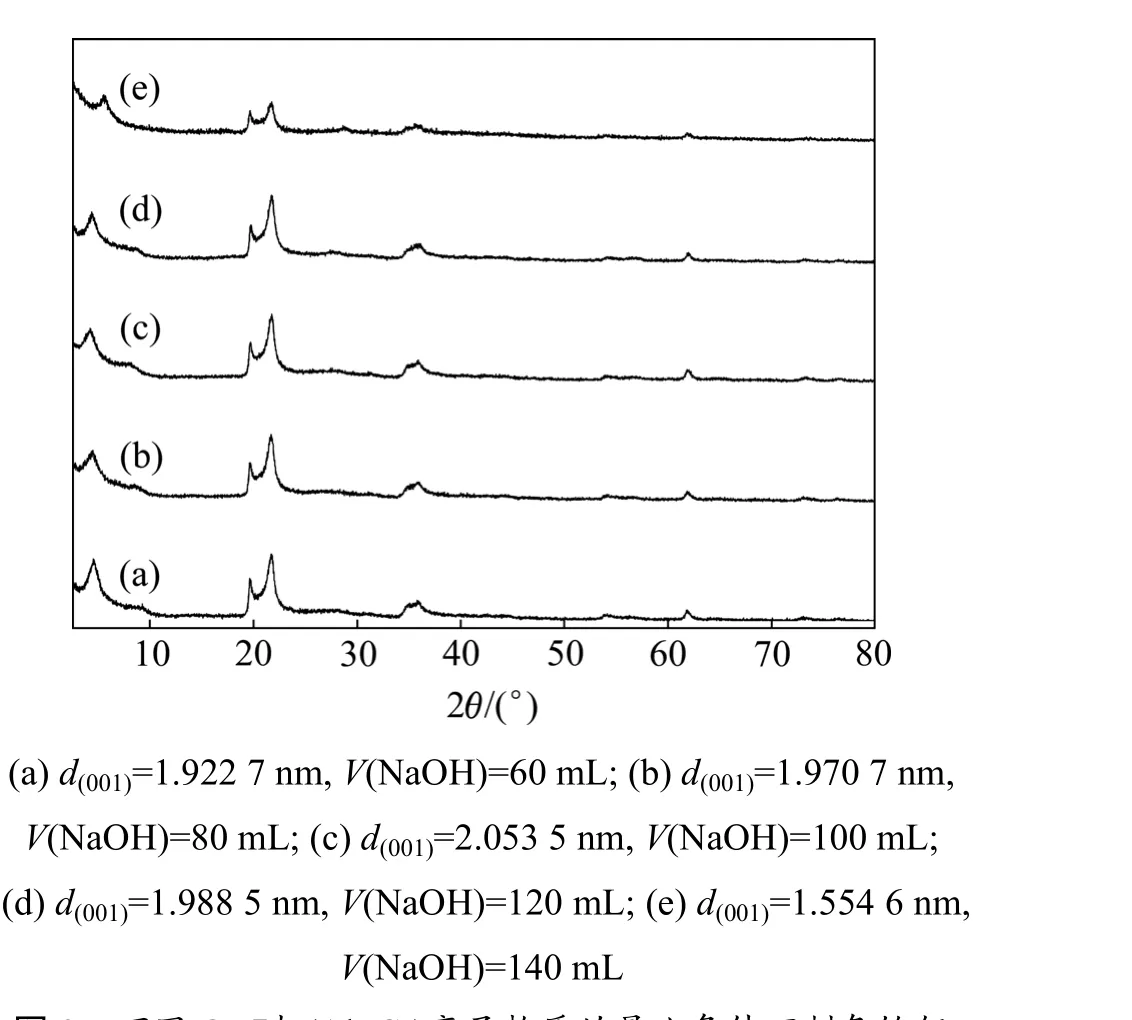
图3 不同OH-与(Al+Cr)离子物质的量比条件下制备铬铝基柱撑蒙脱石的X线衍射谱Fig.3 XRD patterns of Cr-Al-pillared montmorillonite with different molar ratios of OH- to (Al+Cr) ion
图3 表明:当Cr离子与Al离子物质的量比为2∶1,滴入的NaOH体积为100 mL时,柱撑的蒙脱石层间距较大,即具有较佳的柱撑效果。柱撑蒙脱石(001)面网层间距(d(001))变大,峰值较大且尖锐,说明聚羟基铬-铝已进入蒙脱石层间,使层间被撑开,层面间距增大,柱撑蒙脱石结晶程度良好。
2.3 铬-铝柱撑蒙脱石的红外吸收光谱分析
对柱撑前后蒙脱石样品进行红外光谱测试,结果见图4。由图4可知:铬基蒙脱石、铝基蒙脱石、铬铝基蒙脱石与钠基蒙脱石的红外光谱相似,柱撑蒙脱石的基本骨架没有变化;在3 638 cm-1处有较强的吸收带,为硅酸盐晶体中O—H的伸缩振动;而1 088 cm-1处的峰为垂直层的Si—O伸缩振动峰;在1 636 cm-1附近形成一个很强的吸收带,峰较尖锐,为O—H的弯曲振动峰;916 cm-1和468 cm-1附近的吸附峰分别为Al—(OH)—Al(Mg)中 Al2—OH 的摆动和 Si—O—Al的Si—O弯曲振动[17];841 cm-1附近吸收峰对应的是Mg替代Al(Mg—Al—OH)所出现的伸缩振动。
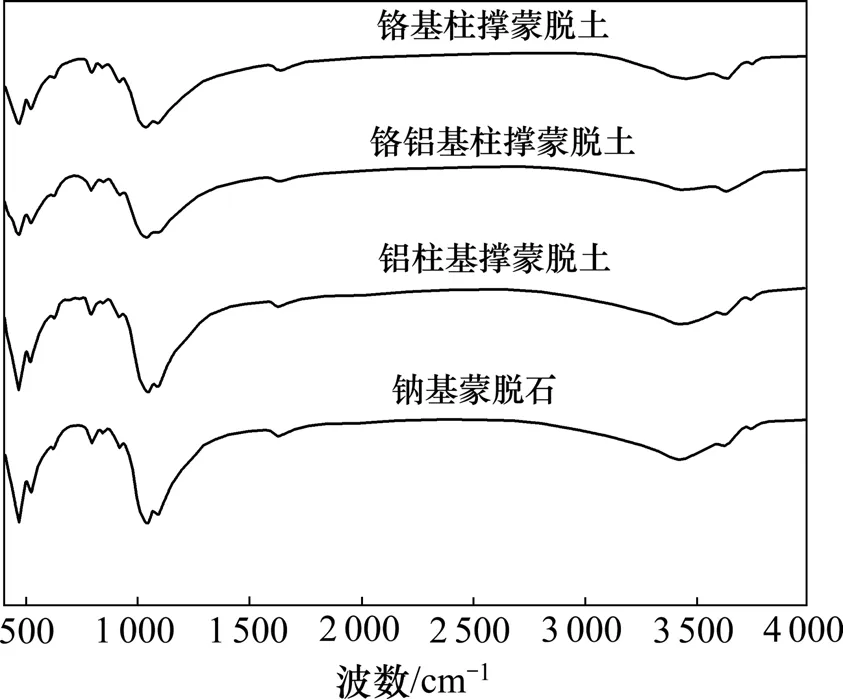
图4 钠基蒙脱石与柱撑蒙脱石的红外光谱Fig.4 IR of Na-montmorillonite and pillared montmorillonite
图4 表明:在794 cm-1和521 cm-1附近存在较强的吸附峰,分别代表着柱撑蒙脱石中的铝氧四面体Al—O和铝氧八面体Al—O的伸缩振动峰,且铬铝基柱撑蒙脱石和铬基柱撑蒙脱石在764 cm-1处有一系列的杂峰出现,是因为铬酸盐属于空间群阴离子占据 C3v位置,红外光谱在 764 cm-1吸附峰对应的是v3(A1+E)谱带[18],证明了在铬基柱撑蒙脱石和铬铝基柱撑蒙脱石层间,有铬离子以铬氧八面体的形式存在。图4中并未发现铬氧四面体,因此,一般认为,铬离子以铬氧八面体的形式进入铬铝基柱撑蒙脱石层间和铬基柱撑蒙脱石层间,这与 Palinko等[10]的研究结果是一致的。与钠基蒙脱石中在3 638 cm-1和1 636 cm-1附近的吸附峰相比,铬基柱撑蒙脱石和铬铝基柱呈蒙脱石的吸收强度发生变化,弱化为3 618 cm-1和1 626 cm-1处的峰。这2个峰分别代表着柱撑前后蒙脱石中O—H的伸缩振动和弯曲振动,主要是柱撑蒙脱石层间羟基与金属离子的耦合振动所致。
2.4 孔径分布
钠基蒙脱石、铝基柱撑蒙脱石、铬铝基柱撑蒙脱石、铬基柱撑蒙脱石在氮气吸附条件下的等温吸附-脱附曲线见图5。柱撑前后蒙脱石的层间距、比表面积、孔容见表2。
根据 Gil等[19]的研究结果,N2吸附-脱附曲线形状的不同表示平均直径不同,吸脱附回环形状则反映蒙脱石样品形成了多孔材料,因此,蒙脱石柱撑前后的平均直径不同。铬铝柱撑在0<p/p0<0.4(p0为标准大气压,p为压力)具有比钠基柱撑蒙脱石、铬基柱撑蒙脱石、铝基柱撑蒙脱石更大的孔容,随着 p/p0的增加,柱撑前后蒙脱石的蒙脱石开始重叠,孔容开始趋于一致,且铝柱撑蒙脱石中的介孔平均孔径da为3.854 nm。
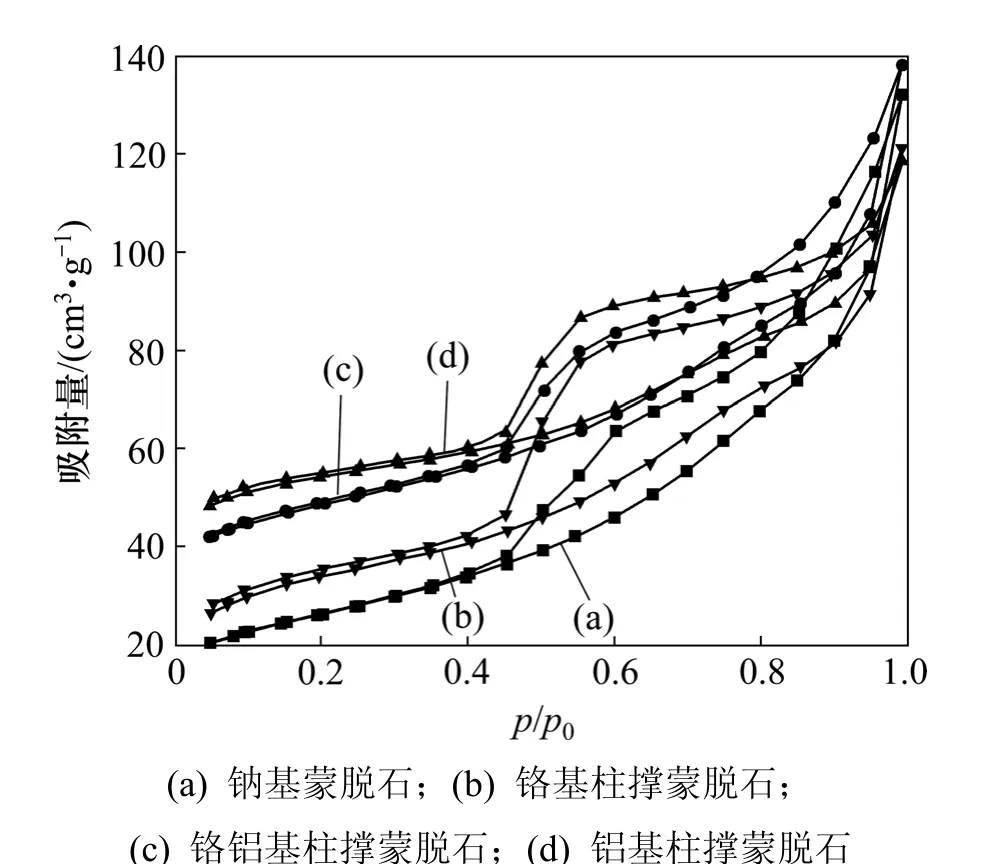
图5 柱撑前后蒙脱石的吸附-脱附曲线Fig.5 Nitrogen adsorption-desorption isotherm of montmorillonite and pillared montmorillonite
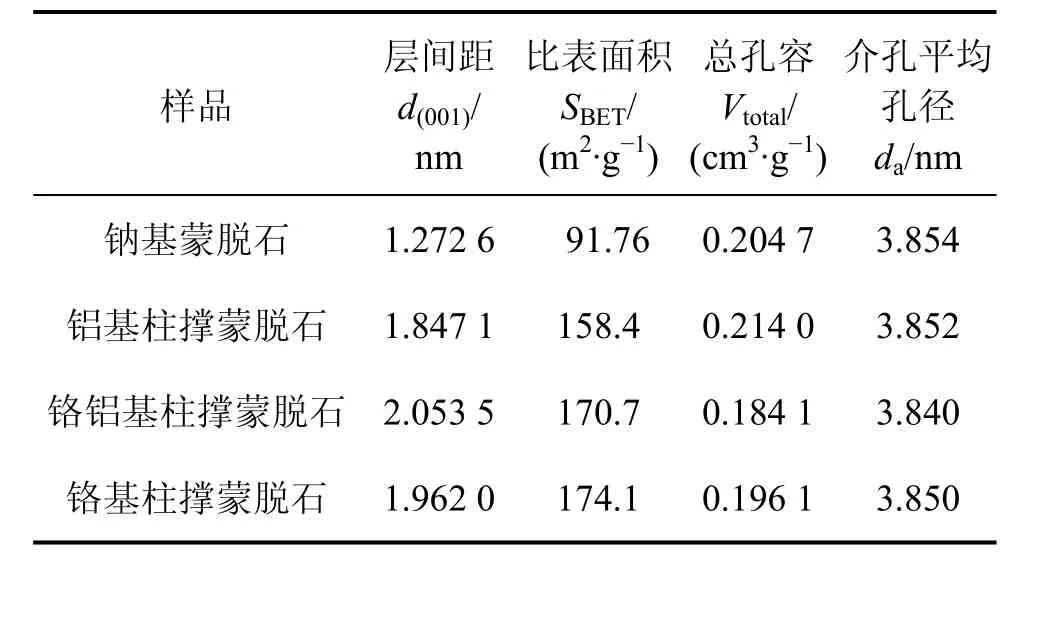
表2 蒙脱石柱撑前后孔的分布状态和结构特性Table 2 Textural properties and mean platinum crystallite diameters of samples indicated
图5和表2说明不同类型的蒙脱石有不同的比表面积和孔径。一方面,柱撑蒙脱石具有较大的层间距,层空间得到加强,比表面积也由钠基蒙脱石的91 m2/g提高到柱撑后的158~175 m2/g;另一方面,柱撑蒙脱石的孔道包括2种类型[20-21]:一是由柱撑引起的二维孔,主要是微孔(一般直径为0.2~1 nm),其孔径由层间距决定;二是介孔(一般直径为2~50 nm),来源于铬铝基柱撑蒙脱石片层与片层之间和片层与铬铝离子聚合物之间堆垛和搭建而形成的孔,其孔径与制备条件有关。由表2可知:铬铝柱撑蒙脱石具有比钠基柱撑蒙脱石、铝基柱撑蒙脱石和铬基柱撑蒙脱石更大的d(001);随着蒙脱石d(001)变大,蒙脱石层间形成更多不均匀分布的微孔隙,微孔孔径也变大[20]。因此,相同质量的铬铝基柱撑蒙脱石比钠基柱撑蒙脱石、铝基柱撑蒙脱石和铬基柱撑蒙脱石具有较大的微孔平均孔径。由于相同质量的铬铝基柱撑蒙脱石比钠基柱撑蒙脱石、铝基柱撑蒙脱石和铬基柱撑蒙脱石具有更小的孔容,因此,相同质量的铬铝基柱撑蒙脱石具有较小的介孔平均孔径。表明铬铝基柱撑蒙脱石孔道结构分布较为均匀,是一种合适的催化和吸附材料。
3 结论
(1) 在水浴温度为60 ℃、搅拌时间为2 h、老化时间为48 h的工艺条件下,当柱化剂溶液中Cr离子与 Al离子物质的量比为 2∶1时,制备的柱撑蒙脱的(001)面网层间距比钠基蒙脱石的(001)面网层间距大。
(2) 在水浴温度为60 ℃、搅拌时间为2 h、老化时间为48 h的工艺条件下,柱化剂溶液中的Cr离子与Al离子物质的量比为2∶1,滴入的浓度为0.4 mol/L NaOH的体积为100 mL时,制得的铬铝基柱撑蒙脱石的 (001)面网层间距(d(001))最大,结晶程度较好,柱撑效果最好。
(3) 铬铝柱撑蒙脱石中,铝离子以铝氧八面体和铝氧四面体2种存在形式,铬离子倾向于以铬氧八面体形式存在,且柱撑蒙脱石层间羟基与金属离子的耦合振动对 O—H的伸缩振动和弯曲振动有较大的影响。
(4) 不同类型的蒙脱石有不同的比表面积和孔容。铬铝基柱撑蒙脱石的比表面积为 170.4 m2/g,孔容为0.184 1 cm3/g,介孔平均孔径为3.840 nm;相同质量条件下的铬铝基柱撑蒙脱石比钠基柱撑蒙脱石、铝基柱撑蒙脱石和铬基柱撑蒙脱石具有较大的比表面积、较大的微孔(一般直径为0.2~1.0 nm)和较小的介孔(一般直径为2~50 nm),这表明铬铝基柱撑蒙脱石孔道结构分布较为均匀,是一种合适的催化和吸附材料。
[1] 冯其明, 杨艳霞, 刘琨, 等. 采用纤蛇纹石制备纳米纤维状多孔氧化硅[J]. 中南大学学报: 自然科学版, 2007, 38(6):1087-1092.FENG Qi-ming, YANG Yan-xia, LIU Kun, et al. Preparation of porous silica with nanofibrous morphology from chrysotile[J].Journal of Central South University: Science and Technology,2007, 38(6): 1087-1092.
[2] Maes N, Heylen I, Cool P, et al. The relation between the synthesis of pillared clays and their resulting porosity[J]. Applied Clay Science, 1997, 12(1/2): 43-60.
[3] LIU Xiao-wen, HU Min, HU Yue-hua. Chemical composition and surface property of montmorillonite[J]. Journal of Central South University of Technology, 2008, 15(2): 193-197.
[4] 曹明礼, 于阳辉, 袁继祖, 等. Al-Mn柱撑蒙脱石的制备与微结构变化研究[J]. 硅酸盐学报, 2002, 30(1): 86-90.CAO Ming-li, YU Yang-hui, YUAN Ji-zu, et al. Preparation and microstructure of Al-Mn- pillared interlayer montmorillonite[J].Journal of the Chinese Ceramic Society, 2002, 30(1): 86-90.
[5] Molina M F, Molina R, Moreno S. Hydroconversion of heptane over a Colombian montmorillonite modified with mixed pillars of Al-Zr and Al-Si[J].Catalysis Today, 2005, 107/108: 426-430.[6] Benito I, Riego A D, Martinez M, et al. Toluene methylation on Al13- and GaAl12-pillared clay catalysts[J]. Applied Catalysis,1999, 180(1/2): 175-182.
[7] Maciasa O, Largoa J, Pesquera C. Characterization and catalytic properties of montmorillonite pillared with aluminum/lanthanum[J]. Applied Catalysis, 2006, 314(1): 23-31.
[8] Gil A, Vicente M A, Korili S A. Effect of the Si/Al ratio on the structure and surface properties of silica-alumina-pillared clays[J]. Journal of Catalysis, 2005, 229(1): 119-126.
[9] Stathopoulos V N, Ladavos A K, Kolonia K M, et al.Preparation,characterization and surface acid catalytic activity of microporous clays pillared with Al1-xFexOy(x=0.00 to 1.00)oxidic species[J]. Microporous and Mesoporous Materials, 1999,31(1/2): 111-121.
[10] Palinko I, Lazar K, Kiricsi I. Cationic mixed pillared layer clays:infrared and Mossbauer characteristics of the pillaring agents and pillared structures in Fe,Al and Cr,Al pillared montmorillonites[J]. Journal of Molecular Structure, 1997,410/411(1): 547-550.
[11] 赵东源, 王国甲, 杨亚书, 等. 高层间距的羟基硅铝交联蒙脱石的合成与表征[J]. 高等学校化学学报, 1992, 13(3):295-299.ZHAO Dong-yuan, WANG Guo-jia, YANG Ya-shu, et al. Synthesis and characterization of hydroxyaluminosilicate cross-linked montmorillonites with high basal spacings[J].Chemical Research In Chinese Universities, 1992, 13(3):295-299.
[12] 赵东源, 杨亚书, 辛勤, 等. 混合金属络合物羟基镍铝交联蒙脱石的表面酸性与催化性能[J]. 催化学报, 1993, 13(3):287-293.ZHAO Dong-yuan, YANG Ya-shu, XIN Qin, et al. Surface acidity and catalytic properties of cross-linked montmorillonites containing mixed-metal hydroxyl-Ni-Al complexes[J]. Chinese Journal of Catalysis, 1993, 13(3): 287-293.
[13] CAO Ming-li, ZHU Ying-bo, YU Yong-fu. Synthesis and characterization of Al/Cr pillared montmorillonite with high thermal stability and adsorption capacity[J]. Journal of Wuhan University of Technology: Mater Sci Ed, 2004, 19(1): 51-53.
[14] CAO Ming-li, ZHU Ying-bo, YU Yong-fu. Preparation and microstructure of Al-pillared interlayered montmorillonite[J].Journal of Wuhan University of Technology-Mater Sci Ed, 2002,17(4): 13-16.
[15] Zielke, Richard C, Pinnavaia, et al. Modified clays for the adsorption of environmental toxicants: Binding of chlorophenols to pillared, delaminated, and hydroxyl-interlayered smectites[J].Clays and Clay Minerals, 1998, 36(5): 403-408.
[16] 吴平霄, 张惠芬, 郭九皋, 等. 无机-有机柱撑蒙脱石对苯酚的吸附[J]. 地球化学, 1999, 28(1): 58-69.WU Ping-xiao, ZHANG Hui-fen, GUO Jiu-gao, et al.Adsorption of phenol on inorganic-organic pillared montmorillonite[J]. Geochimica, 1999, 28(1): 58-69.
[17] Lee S R, Park M, Han Y S, et al. Solid-solid transformation route to nanocrystaline sodalite from Al-PILC at room temperature[J].Journal of Physics and Chemistry of Solids, 2004, 65(2/3):421-424.
[18] Farmer V C. 矿物的红外光谱[M]. 北京: 科学出版社, 1982:337-338.Farmer V C. The infrared spectra of minerals[M]. Beijing:Science Press, 1982: 337-338.
[19] Gil A, Montes M. Analysis of the microporosity in pillared clays[J]. Langmuir, 1994, 10(1): 291-297.
[20] 刘荣添, 李湘祁, 汤德平. 含钛蒙脱石多孔材料的研究进展[J]. 矿物学报, 2001, 21(3): 355-358.LIU Rong-tian, LI Xiang-qi, TANG De-ping. Recent advances in research on Ti-pillared montmorillonite as porous materials[J].Acta Mineralogica Sinica, 2001, 21(3): 355-358.
[21] 宋晓岚, 江楠, 曲鹏, 等. 介孔 CeO2的化学沉淀法合成及表征[J]. 中国有色金属学报, 2006, 16(12): 2126-2131.SONG Xiao-lan, J IANG Nan, QU Peng, et al. Synthesis and characterization of mesoporous CeO2via chemical precipitation method[J]. The Chinese Journal of Nonferrous Metals, 2006,16(12): 2126-2131.
