药物警戒快讯
2010-05-30
美国FDA警告质子泵抑制剂可能引起骨折风险
2010年5月25日,美国食品药品监督管理局(FDA)发布信息称,美国正在修订质子泵抑制剂类药品的标签和说明书,包括处方药和非处方药,加入有关该类产品可能引起髋骨、腕骨、脊骨骨折风险的警示。
质子泵抑制剂可减少胃酸的分泌,作为处方药治疗胃-食管反流、胃和小肠溃疡以及食管炎等疾病,作为非处方药治疗频发性胃灼热。FDA发布此安全性信息是基于对多项流行病学的调查分析。这些流行病学研究提示了与使用质子泵抑制剂相关的髋骨、腕骨、脊骨骨折的风险。一些研究发现骨折风险较高的患者使用了高剂量的质子泵抑制剂。大多数的研究都评估了50岁以上患者的骨折风险,且升高的骨折风险主要也是在这个年龄段中观察到的。
由于升高的骨折风险主要出现在使用质子泵抑制剂至少一年或使用高剂量质子泵抑制剂的患者中,因此,作为警告,非处方类质子泵抑制剂的药品标签(明确可连续使用14天)也被进行了相应修订。
FDA建议医疗专业人员在处方质子泵抑制剂时,应考虑能达到治疗目标的低剂量、短疗程应用,建议患者不要随意停止使用该类药品,除非有医生的要求。
数据摘要:
迄今,有关质子泵抑制剂的随机临床研究未发现质子泵抑制剂有升高的骨折风险。这些研究的用药时间一般都在6个月,且高剂量用药的信息很有限。
FDA修订质子泵抑制剂说明书的决定是基于FDA对多项公开发表的流行病学研究的调查分析。这些流行病学研究对使用和未使用质子泵抑制剂的患者进行了比较,发现:6项研究报告了使用质子泵抑制剂后骨折风险升高;暴露于质子泵抑制剂的时间范围为1~12年;发生骨折的时间在不同研究中并不一致;升高的风险主要是在老年患者中发现的;两项研究报告了使用高剂量质子泵抑制剂后风险升高;一项研究未发现质子泵抑制剂与骨折之间有关联性,该研究将研究对象限制在本身无严重骨折风险的人群中。
FDA未被允许查看这些研究的原始数据或记录,因此无法证实这些研究是否如其公开发表文章中所描述的那样开展的。根据FDA对这些文章的审查,这些研究都设计良好,考虑了质子泵抑制剂的剂量和使用时间对骨折的影响,并使用了恰当的统计学方法来减少诸如年龄、性别、潜在疾病、合并用药等带来的偏倚。然而,一些研究的限制性因素使质子泵抑制剂与骨折的关联性评价产生了困难。对这些数据的分析不能包含所有可能影响关联性判断的潜在风险因素信息,如家族史、吸烟史、体重和身高、饮酒史、节食和钙及维生素D等的补充情况、OTC药的使用情况、消化性疾病的影响等。有关质子泵抑制剂导致骨折风险升高的机制尚不清楚。三项流行病学研究在长期使用质子泵抑制剂与骨密度改变关联性方面结果不一致。
基于所有已获得的数据,FDA认为目前在流行病学研究中还不清楚使用质子泵抑制剂是否会导致骨折风险升高。为进一步弄清此问题,FDA计划分析几项有关二膦酸盐(用于预防骨折)的大型、长期、安慰剂对照临床试验,以评估使用了质子泵抑制剂和未使用该类产品的骨质疏松症妇女的骨折风险。
FDA正在与药品生产商一起研究有关质子泵抑制剂的骨折风险。如作为药品批准程序的一部分,dexlansoprazole(商品名:Dexilant)的制药商已被要求开展上市后临床研究,以评估dexlansoprazole和埃索美拉唑对骨稳态的影响,研究结果希望在2011年末得出。
总之,目前已获得的数据提示使用质子泵抑制剂可能导致髋骨、腕骨、脊骨骨折的风险升高,并提示升高的风险可能与剂量、用药时间相关,但风险的强度尚无法确定。FDA要求医生在处方质子泵抑制剂时应考虑低剂量、短疗程的治疗。
参考信息:
1.Vestergaard P,Rejnmark L,Mosekilde L.Proton pump inhibitors,histamine H2 receptor antagonists,and other antacid medications and the risk of fracture[J].Calcif Tissue Int,2006,79(2):76-83.
2.Yang YX,Lewis JD,Epstein S,et al.Long-term proton pump inhibitor therapy and risk of hip fracture[J].JAMA,2006,296(24):2947-2953.
3.Targownik LE,Lix LM,Metge CJ,et al.Use of proton pump inhibitors and risk of osteoporosis-related fractures[J].CMAJ 2008,179(4):319-326.
4.Kaye JA,Jick H.Proton pump inhibitor use and risk of hip fractures in patients without major risk factors[J].Pharmacotherapy,2008,28(8):951-959.
5.Corley DA,Kubo A,Zhao W,et al.Proton pump inhibitors and histamine-2 receptor antagonists are associated with hip fractures among at-risk patients[J].Gastroenterology,2010,139(1):93-101.
6.Gray SL,LaCroix AZ,Larson J,et al.Proton Pump Inhibitor Use,Hip Fracture,and Change in Bone Mineral Density in Postmenopausal Women[J].Arch Intern Med.2010.170(9):765-771.
7.Yu EW,Blackwell T,Ensrud KE,et al.Acid-Suppressive Medications and Risk of Bone Loss and Fracture in Older Adults[J].Calcif Tissue Int,2008,83(4):251-259.
8.Targownik LE,Lix LM,Leung S,et al.Proton-pump inhibitor use is not associated with osteoporosis or accelerated bone mineral density loss[J].Gastroenterology,2010,138(3):896-904.
(美国FDA网站)
美国FDA发布奥美沙坦相关安全性信息
2010年6月11日,美国食品药品监督管理局(FDA)发布信息称,正在对两项有关奥美沙坦(olmesartan,商品名Benicar)的临床试验进行评估。两项试验均发现,2型糖尿病患者使用抗高血压药奥美沙坦后出现心血管事件而死亡的发生率高于使用安慰剂的患者。FDA的评估正在继续,目前尚未得出奥美沙坦可增加死亡风险的结论,高血压患者使用奥美沙坦的利益仍大于潜在风险。
FDA评估的两项临床试验为ROADMAP和ORIENT研究,均为长期临床试验,受试者均患有2型糖尿病,给予奥美沙坦或安慰剂,以观察奥美沙坦的治疗是否可以减缓肾脏疾病的发生。两项研究均有预料之外的发现,即奥美沙坦组因心血管事件(心脏病、猝死或中风)死亡的数量较安慰剂组高。
奥美沙坦是血管紧张素Ⅱ拮抗剂类药物(ARBs),另一类作用相似的药物称为血管紧张素转化酶抑制剂(ACEIs),这两类药已经在许多项研究中被进行了评估,涉及数千名有心血管疾患风险的患者,如有心脏病史或心衰史的患者。这些试验中均未有心血管相关死亡风险升高的报道。实际上,一些研究表明ARBs和ACEIs在治疗某些心血管疾患高危风险的患者方面是非常有效的。
FDA建议患者不应随意停止奥美沙坦的治疗,除非有医生的要求。建议医疗专业人员按照说明书的指导处方该药品,并报告出现的不良事件。
数据摘要:
ROADMAP(奥美沙坦与预防糖尿病微量蛋白尿随机试验)是一项在欧洲开展的随机、双盲、安慰剂对照的多中心临床试验。试验包括了4 447名患有2型糖尿病且至少有一种其他心血管疾病风险因素的患者,但这些患者没有明确的肾病诊断。患者被随机给予奥美沙坦(40mg/天)或安慰剂,并被允许使用ACEIs或ARBs以外的其他抗高血压药。
ROADMAP的研究目的是评估奥美沙坦是否能延缓微量蛋白尿的产生。绝大多数患者都有3~5种心血管疾病的风险因素,80%的患者使用了其他抗高血压药。奥美沙坦的中位暴露时间为39个月。
ORIENT(奥美沙坦降低糖尿病性肾病患者终末期肾病发病率试验)是一项在日本和香港开展的随机、双盲、安慰剂对照的多中心临床试验。2型糖尿病的患者(n=566)和有明确诊断的肾病患者被随机给予奥美沙坦(10~40 mg/d)或安慰剂,并被允许使用包括ACEIs在内的其他抗高血压药,但不能使用ARBs。主要复合终点是患者的血清肌酐水平首次加倍、肾病终末期、所有原因导致的死亡。
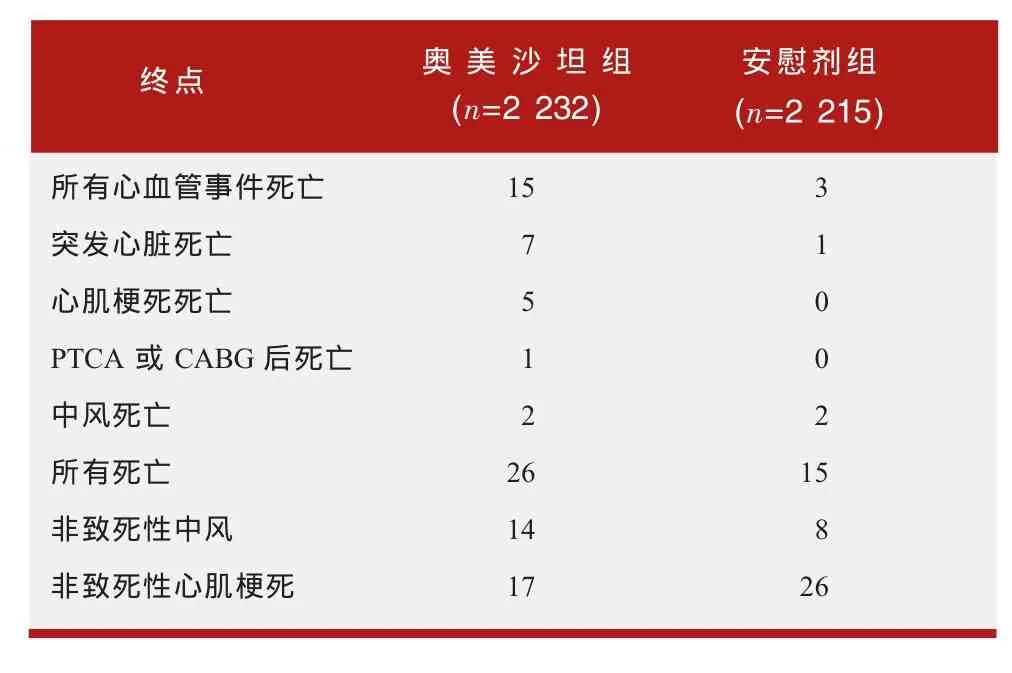
表1 ROADMAP试验的心血管事件发生情况
两项研究均有意外的发现,即接受奥美沙坦组患者因心血管事件死亡的数量高于安慰剂组。主要心血管事件发生情况如下表1、表2所示。
在考虑这些试验结果时,应注意到其他有关奥美沙坦及其他ARBs的试验未发现心血管相关死亡的风险升高,这一点很重要。
为评估与奥美沙坦相关的心血管死亡风险,FDA计划审查两项研究的主要数据和所有奥美沙坦的临床数据,以及通过其他方法更好地理解在ROADMAP和ORIENT研究中的发现。
(FDA网站)
英国警告贝伐珠单抗的过敏反应和注射部位反应
英国药品和健康产品管理局(MHRA)在2010年6月的《药物安全更新》上报道了贝伐珠单抗引起的过敏反应和注射部位反应。
贝伐珠单抗(Bevacizumab,商品名Avastin)是一种单克隆抗体,可抑制血管内皮生长因子,用于治疗各类转移性癌症。
根据罗氏公司致医疗专业人员的信,Avastin至今已被50万癌症患者使用。从罗氏公司的安全数据库中检索到273例相关报告,包括来自临床试验的报告和来自发报告系统的报告。大多数病例的因果关系都因合并的化学治疗而变得难以判断,然而发现了7例再激发阳性病例和2例皮肤试验阳性病例。

表2 ORIENT试验的心血管事件发生情况
在临床试验中,接受Avastin合并化疗的患者报告的过敏反应和过敏样反应多于接受Avastin单一化疗者。这些反应的发生较为常见,在贝伐珠单抗治疗患者中最高达到5%。临床试验中迄今未收到因贝伐珠单抗治疗导致死亡的因果关系明确的病例报告。上市后不良事件报告系统中也收到了包括免疫系统疾病(如过敏反应和注射部位反应)在内的不良事件报告,但发生率不详。
许多静脉内注射的单克隆抗体都有过敏反应、过敏样反应和注射部位反应的报告,但发生率不一样。相关的临床表现包括:呼吸困难、潮红、皮疹、低血压、高血压、胸痛、寒战、恶心、呕吐等。
一般来说,使用Avastin的患者经历了轻到中度过敏反应、注射部位反应后(尤其是在第一次暴露后),在降低注射速度或在症状完全消退后使用抗组胺药或皮质类固醇的情况下,再次注射可能对该药耐受。不建议对出现严重不良反应的患者再次给药。
根据这些信息,罗氏公司认为有较充足的证据证明贝伐珠单抗与过敏反应、注射部位反应之间的因果关系。罗氏公司建议在Avastin治疗期间和治疗后密切监测患者,若发生了不良反应,应停止注射并采取适当的治疗措施。再激发用药应在考虑了个体治疗目的和在准确评估过敏反应/注射部位反应的严重程度后决定。
(英国MHRA网站)
加拿大发布有关伐尼克兰的重要安全性信息
2010年5月31日,加拿大卫生部与辉瑞公司共同发布了有关修订酒石酸伐尼克兰(varenicline tartrate,商品名:CHAMPIX)产品说明书的重要信息。
主要修订内容包括一个加框警告,突出了给医疗专业人员的有关神经/精神科不良事件的重要建议;一项有关罕见过敏反应的警告,如血管性水肿和严重皮肤反应,包括史蒂文斯-约翰逊综合征和多形性红斑;在“警告和注意事项”项下添加“给患者的信息”,提供了伐尼克兰治疗前及治疗期间患者应了解的关键性信息及建议;说明伐尼克兰有两种剂量可供选择。
伐尼克兰用于成人的戒烟治疗。加拿大卫生部不断收到来自国内外有关使用伐尼克兰后出现严重神经/精神症状的报告,如抑郁、激越、攻击行为、敌意、行为改变、自杀以及精神疾病恶化等。
这些事件在曾经或未曾患有精神障碍的患者中都有发生。一些病例因患者停止吸烟后出现尼古丁戒断症状而变得复杂。酒精摄取可能增加患者发生精神事件的风险。如果患者出现神经/精神症状或行为异常改变,应停止伐尼克兰治疗并立即咨询医生。
伐尼克兰的上市后报告包括嗜睡、头晕、意识丧失、癫痫发作、注意力不集中,因此,患者应被建议不得从事有潜在危险的活动,如驾车、操作危险机器,直到他们了解伐尼克兰对他们的影响。
上市后报告还包括过敏反应,如罕见、致命的血管性水肿事件和罕见的严重皮肤反应,包括史蒂文斯-约翰逊综合征和多形性红斑。患者如果出现任何过敏反应/严重皮肤反应的症状或体征,应立即停止使用伐尼克兰并就诊。
伐尼克兰有两种剂量选择,即在一周给药后,剂量可增加至最高1天2次1.0 mg,或保持1天2次0.5 mg。剂量的选择应根据医生的诊断或病人的耐受性来确定。如果需要,给药剂量可在两种方案中临时调整或永久改变。
(加拿大卫生部网站)
