掺硼金刚石薄膜电极用于污水处理研究进展
2010-05-24满卫东吴宇琼陈高峰
陈 朋,满卫东,吴宇琼,陈高峰,董 维
(1.武汉工程大学 湖北省等离子体化学与新材料重点实验室,湖北 武汉 430073 2.江汉大学 化学与环境工程学院,湖北 武汉 430056)
1 引言
我国是世界制造大国,但不是制造强国。除制造技术基础薄弱,创新能力不强,产品以低端为主外,制造过程资源、能源消耗大,引起的严重污染是制约制造业可持续发展的瓶颈。以能耗为例,我国万元GDP的能耗水平约是美国的3倍、日本的5倍,行之有效的污染控制技术研究已成为打造我国先进制造业的一个重要课题,工业污水是我们亟需面对和解决的首要问题。
就我国工业所排放的废水来说,根据所含污染物的主要成分,可将这些废水分为:酸性废水、碱性废水、含氰废水、含铬废水、含镉废水、含汞废水、含酚废水、含醛废水、含油废水、含硫废水、含有机磷废水和放射性废水等。这些被污染的水源无处不给人们带来危害,从合理利用和节约资源的角度考虑,我们都急需找到一种行之有效的方法来处理这些被污染的水源。而一种工业往往可以排出几种不同性质的废水,而一种废水又会有不同的污染物和不同的污染效应。例如染料工厂既排出酸性废水,又排出碱性废水。纺织印染废水,由于织物和染料的不同,其中的污染物和污染效应就会有很大差别。即便是一套生产装置排出的废水,也可能同时含有几种污染物。如炼油厂的蒸馏、裂化、焦化、叠合等装置的塔顶油品蒸气凝结水中,含有酚、油、硫化物。在不同的工业企业,虽然产品、原料和加工过程截然不同,也可能排出性质类似的废水。如炼油厂、化工厂和炼焦煤气厂等,可能均有含油、含酚废水排出。
随着石油化工、医药、农药和燃料工业的迅速发展,工业废水中难降解有机化合物的数量与种类与日俱增。特别是含有高浓度的芳香族化合物,如酚类,属“三致”物质,毒性很大,用一般生物降解方法难以直接去除。在当今社会,“节能减排”已成为时代的主题,废水处理是重要的措施之一。生化法对有机污染物难以去除,因此需要辅助以电化学催化,而电极是电催化过程的核心,决定着电催化能力,电流效率以及装置的使用寿命[1]。目前使用的一些电极材料有很多不足之处,如石墨电极,对有机物的催化氧化能力很差,电流效率低下[2];贵金属材料如Pt、Au等电极成本高且易被含硫有机物等物质毒化而丧失其电催化性能,导致氧化电流效率下降,难以应用在实际工作中[3]。另外,随着人们生活水平的提高,人们对水质的要求也越来越高,但是工业生产中的废水以及水体污染却日趋严重,这势必要我们尽快找到更好的方法来解决这些问题。电解水处理技术作为一项先进的污水及饮用水处理技术,受到了国际学术界及工业界广泛的关注。而在电解水处理技术中,电极是电化学反应的核心部位。金刚石具有低的背景电流,高的信号背景比和信号噪音比;抗腐蚀性强,几乎能耐所有的强酸强碱的腐蚀;表面不易产生吸附,是一种清洁的电极材料[4,5]。基于这些特性,金刚石完全可以成为新一代高效节能环保的电极材料。近年来,BDD薄膜电极在电化学分析领域以及电化学合成领域有了突飞猛进的进展。但是在水处理的应用中也碰到了瓶颈,比如制备的成本高,金刚石与基底结合力差以及导电性不同的衬底对BDD薄膜用于电极方面的影响。因此很有必要对金刚石电极进行系统的研究,对金刚石掺杂工艺,电极电化学性能以及根据使用情况调节制备工艺要有一个新的认识。
2 BDD薄膜电极的制备
近年来,随着热丝法(hot filemant chemical vapor deposition,HFCVD)和微波等离子体(microwave plasma chemical vapor deposition,MPCVD)沉积复合多晶金刚石薄膜的方法与工艺的不断提高和完善,各种材料表面生长金刚石膜后表现出的物理、化学、机械等性能也越来越清楚,并得到了广泛地应用[6~8]。热丝法是利用高温金属丝激发等离子体,装置简单,使用比较方便,并可大面积制备。但由于金属丝的高温蒸发会将杂质引入到金刚石薄膜中,因此该方法不适合制备高品质的金刚石薄膜。微波法是利用微波的能量激发等离子体,具有能量利用效率高的优点,同时由于没有电极放电的影响,等离子体纯净,是目前高质量、高速率制备金刚石薄膜的首选方法。文献[9]使用5 kW级别的MPCVD装置,大约10 h左右,在0.050 8 m(2 inch)大小的硅基板上,可得到数十微米左右的复合多晶金刚石薄膜。一般使用甲烷气体作为碳素来源,把氢气、丙酮、醇等导入到反应腔内即可得到所需品质的多晶金刚石薄膜。此外,为了赋予金刚石薄膜导电性,薄膜形成过程中,需掺杂硼元素。一般使用的方法是气相中导入B(CH3)3等含硼类气体,但是这些含硼气体不仅具有毒性、引火及爆炸性等危险,同时还需要双重配管等特别的装置。因此,研究人员发明了一种比较简单安全的方法,即:反应腔内配置一个B2O3反应盘,在反应釜内的等离子体蚀刻作用下,使硼元素不断地导入到气相。另外,藤屿等[10]发明了一种既简单安全,又可以有效地控制掺杂硼元素浓度的制备复合多晶金刚石薄膜的反应系统,他们利用丙酮/甲醇为碳素源,在其中溶解B2O3作为硼元素的来源,通过氢气的鼓泡作用将碳/硼导入到反应腔内。该方法既避免了使用含硼的有毒有害气体,又可以通过调整反应溶液中掺入硼的量,有效地控制掺杂硼的浓度,从而改善BDD的电导率。
综上所述,可以通过BDD的质量和电导率等指标来选择相应BDD的制备方式和掺杂方式,以满足不同的要求,表1列出了2种不同方法制备的金刚石膜的性能指标。

表1 金刚石膜不同制备方法的性能指标
3 BDD薄膜电极的电化学特性
高掺硼量的金刚石电极与传统的电极相比,表现出很多重要的优异性能[13]:
1)在水介质或非水介质中,都有较宽的电势窗口,高品质的金刚石膜电极析氢电位大约是-1.25 V(对标准H电极),析氧电位可达到+2.3 V(对标准H电极),它的电势窗口就超过了3 V,电势窗口的宽度随薄膜质量的降低和非金刚石碳的存在而减小。
2)在苛刻介质溶液中强的腐蚀稳定性:在强腐蚀的氟化物溶液中,进行长期电化学(如:析氢到析氧的循环反应)实验后,金刚石膜仍然保持很好的化学稳定性。另外金刚石膜表面是惰性的,具有低的吸附特性并且在其表面不易发生钝化反应:在铁/亚铁氰化盐溶液中连续的做循环伏安测试长达两周后,BDD电极上所测得的循环伏安特性仍然比较稳定。
3)低的双电层电容和背景电流:金刚石与电解液的接触界面易被极化,在-1 000到+1 000 mV对SCE范围内,电流小于50 μA/cm2,其双电层电容与玻碳相比,低一个数量级。
4 BDD薄膜电极在污水处理方面的研究
近年来,BDD薄膜电极在电化学分析领域以及电化学合成领域有了突飞猛进的进展,其研究已趋于完善[14,15]。尽管在水处理中的应用仍处于探索阶段,但却涵盖了很多方面,从难降解有机污染物到无机氮的脱除,其应用范围之广,取决于它本身的特性。目前一些工业废水中存在大量难降解物质,通过活性污泥法、生物膜法等生物水处理方法已无法完全去除,BDD薄膜电极由于其优良的电化学特性(宽的电化学窗口和低的背景电流)已经引起研究者极大的兴趣,并且被广泛应用于有机污染物的降解过程,据报道许多抗生物降解的污染物都能在BDD电极上被完全的矿化降解掉[16],一些文献还不断报道了BDD电极对染料废水中(naphthalenesulfonates)磺酸萘[17],十二烷基苯磺酸钠[18]和(hexadecyltrimethyl ammonium chloride)十六烷基三甲基氯化铵[19],茜索红,羊毛铬黑T[20,21]等物质的降解,并且证明了BDD薄膜电极能将这些物质完全的矿化,其COD(Chemical Oxygen Demand)去除率高达95%。
4.1 难降解焦化水的处理
文献[22,23]中用所制备的掺硼金刚石厚膜电极分别与IrO2/Ta2O5钛涂层电极、SnO2和PbO2电极对比处理高浓度难降解污水(石油焦化水和焦化废水)实验中分别以掺硼金刚石厚膜电极和IrO2/Ta2O5钛涂层、SnO2和PbO2电极为阳极,不锈钢为阴极处理焦化废水。文中通过测定污水处理过程中COD的变化和扫描电镜观察处理污水前后金刚石厚膜电极和钛涂层电极、SnO2和PbO2电极的微观表面形貌的变化。得出结论:掺硼金刚石厚膜电极比IrO2/Ta2O5钛涂层电极、SnO2和PbO2电极处理污水效率更高、处理难降解污染物能力更强,电极稳定性更好、耐腐蚀性更强,同时也证明了,难降解的石油焦化水能被BDD电极成功的净化处理。
4.2 难降解酚类物质的处理
文献[24]讨论了不同pH、温度以及不同阳极电极材料对它们的电化学氧化作用的影响;难降解有毒有害污染物4—氯酚,电解过程中生成的主要中间产物为1,4—苯醌、顺丁烯二酸和蚁酸[25,26]。文中对这些酚类物质的电化学氧化过程建立数学模型,并计算了处理过程中的电流效率、COD去除率、能耗以及电化学氧化有机废水所需的电极面积,对简单的酚类物质的研究表明,BDD薄膜电极均能表现出优于普通贵金属、金属氧化物、玻碳(GC)和石墨等类型电极的电化学响应,达到较满意的去除效果。
4.3 农药污水的处理
农药易在土壤或沉积物中向下迁移而进入地下水,从而造成地下水污染。M.Polcaro等[27]使用BDD电极处理含敌草隆(diuron)3,4-氯苯胺(DCA)的模拟废水,当分别加人0.05 mol/L的磷酸盐缓冲液与0.05 mol/L的H2SO4时,污染物被完全矿化,并且阳极没有产生钝化现象,在较低的污染物浓度下(敌草隆为0.17 mmol/L、DCA为2 mmol/L)CE值也超过了20%,该降解过程容易受到高浓度还原性阴离子(如SO24-)的干扰。后来,他们又发现BDD电极可将氰尿酸(CA)及阿特拉津等某些三嗪化合物完全矿化[28]。
4.4 大分子聚合物的处理
BELLAGAMBA等人[29]首次研究了可溶有机高分子聚丙烯在BDD薄膜电极上的电化学氧化,电解液为1 mol/L HClO4。实验表明,聚丙烯的电解速度由传质过程控制。
4.5 NO-3的处理
一些文献已经报道了金刚石电极,在污水处理中可用作阳极材料,用于还原废水中高浓度的硝酸根离子[30~33],
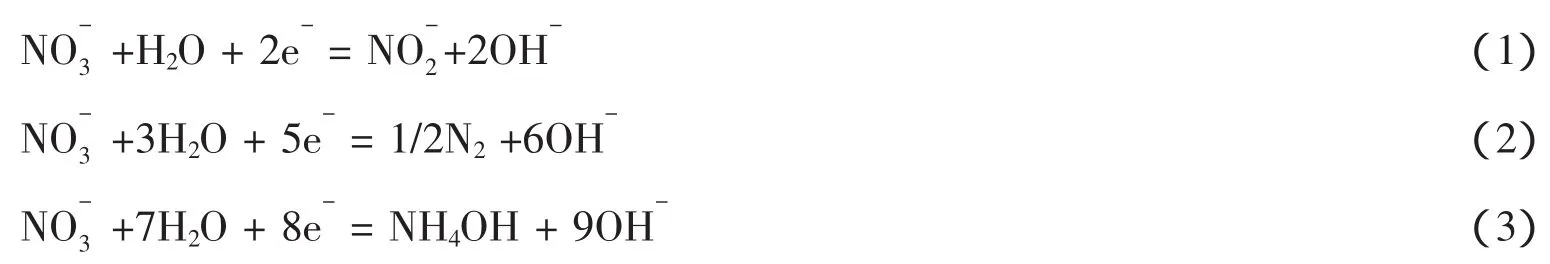
Levy-Clement等[27]发现,所用电势在-1.5~-1.7 V之间,被还原的硝酸根数量是10%,生成的产物也是气体形式,当所用电势达到-2 V时,被还原的硝酸根数量增加到29%,并且生成亚硝酸根和氮气,没有氨气生成,从而真正达到净化处理污水而不带来新的污染物的目的。
5 掺硼金刚石膜电化学处理有机污水机理的研究
据报道,一些芳香类有机污染物的电化学处理过程中,在低的电解电压下,在阳极上生成了一些不完全氧化的沉积物,使其发生钝化。图1所示的是在含有2.5 mmol/L的苯酚电解溶液中,所记录的循环伏安特性曲线[34]。图1曲线a对应的是在苯酚的氧化中,在约1.67 V处观察到阳极电流峰。图1曲线b是随着循环扫描次数的增加,这种阳极氧化峰逐渐降低,在5次循环后,氧化峰逐渐降低至 0,这说明电极表面发生了钝化。与之相反,在高的阳极电势,接近于析氧电位,没有发生任何的电极钝化的迹象,而且在析氧反应过程中,电极表面形成高分子薄膜也被去除,从而电极活性重新获得。例如,我们返回到图1对苯酚的氧化中,曲线c和d所示的是,在固定阳极电势2.84 V分别以RHE为10 s和20 s激活后所得到的循环伏安特性曲线。曲线e所示,当极化时间超过40 s,苯酚的氧化峰回到原来的位置,这表明,电极的表面发生了完全的激活。这种随极化时间的变化的电流峰恢复的趋势在图1中被说明。
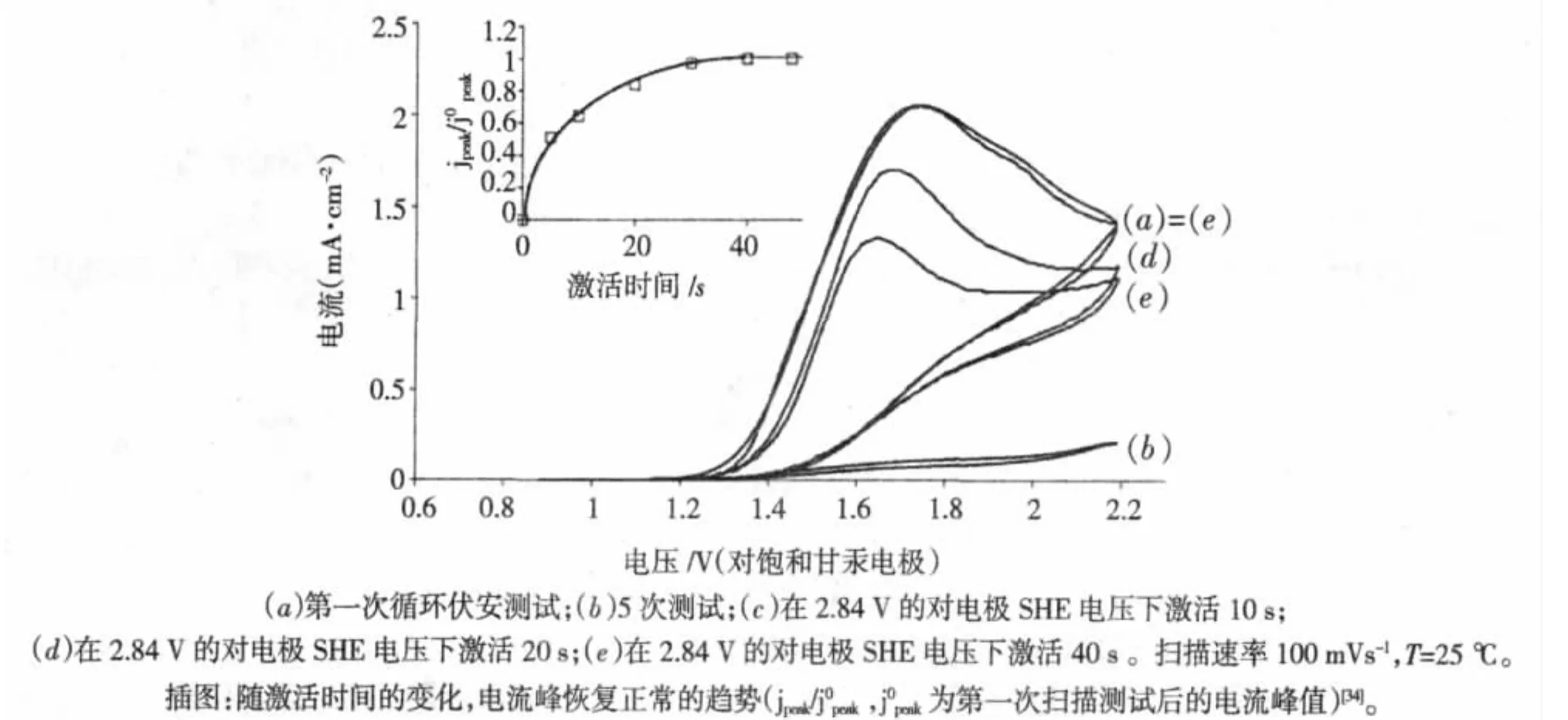
图1 在1 mol/LHClO4介质中加入2.5 mmol/L的苯酚的电解液中所测试的BDD电极的循环伏安特性
BDD电极在电解过程中会发生2种氧化机制:直接氧化和间接氧化。
在对有机物进行电催化过程中,BDD电极要发生2种氧化反应,在未达到析氧电位前,但是已经达到有机物的氧化电位时,电极所提供能量已经足够使有机物失去电子而被氧化,此时发生氧化反应被称为直接氧化,然而这种直接的氧化会导致电极表面发生钝化。M.Panizza等[17]曾这样提到。
间接氧化机制是利用电解水产生的羟基自由基而进行的一系列的电化学催化氧化过程。有机物要得到完全的催化氧化还得借助于这种间接氧化机制。John H.T.Luong等[35]曾报道BDD电极的间接氧化机制原理。
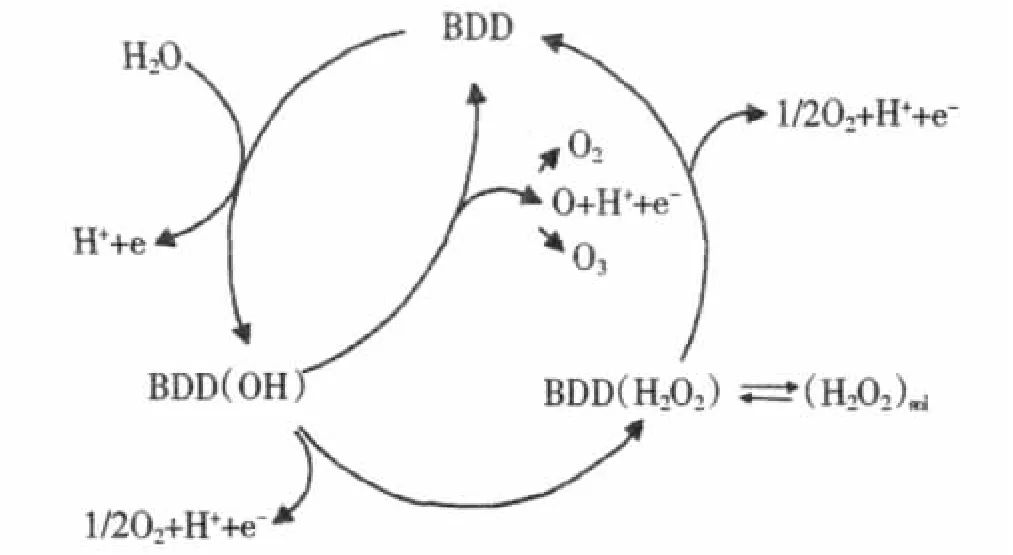
图2 BDD电极的间接氧化机制原理
根据如图2所示氧化模型,可知,BDD电极上发生的第一步就是水电解生成羟基自由基(方程1)

电解生成的羟基自由基又可发生以下4个反应:
(1)电介质的氧化,如H2SO4介质中,发生的反应如下(方程2)

(2)在电介质HClO4中羟基自由基生成H2O2,以及H2O2析出O2等反应

(3)O3的生成:OH·可能进一步生成O原子(方程6)生成的O原子可能生成O2,也可能生成O3(方程 7,8)

(4)BDD电极的腐蚀:在高的电流密度下,电极表面生成的OH·还可能将BDD电极氧化成CO2

从上面的间接氧化中,可以看出,有机物在被直接催化氧化的同时,也在被间接氧化过程中所提供的H2S2O8,H2O2,O3等强化剂所氧化,同时电极还会在高的电流密度下,慢慢的被氧化损耗掉。
COMNINELLIS[36]和FOTI等[37]在上述实验结果的基础上,提出了BDD薄膜电极降解有机污染物的机理
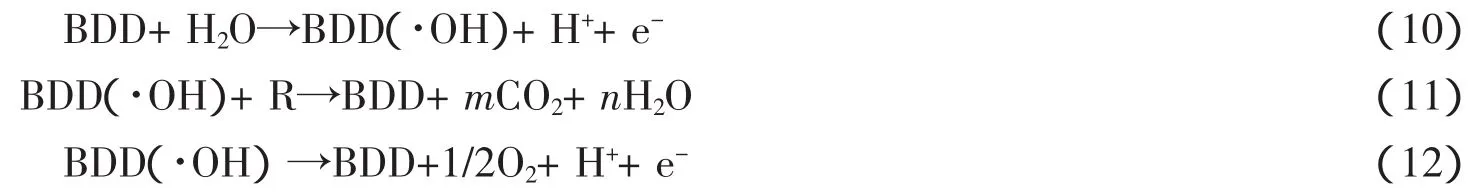
BDD薄膜电极与水反应,在电极表面生成具有活性的·OH(式10);·OH再与溶液中的有机物R燃烧矿化生成CO2和H2O(式11);同时在电极表面还存在一个与燃烧有机物的竞争反应——析氧反应(式12)。研究表明,在高电解电压下,使用BDD薄膜电极,可以将有机污染物完全矿化生成CO2。
表2列出了近年来BDD电极用于处理各种污水和废水的实例。
污水中大量的难降解有机物和一些有毒无机物,都可以通过电化学或辅助于电化学催化的方法来进行处理,而在电解处理过程中,有着核心作用的电极成为关键,综合各种电极材料的价格、使用寿命等因素以及基于金刚石具有低的背景电流,高的信号背景比和信号噪音比;抗腐蚀性强,几乎能耐所有的强酸强碱的腐蚀;表面不易产生吸附等特性,BDD电极将成为新一代高效节能环保的电极材料。

表2 金刚石膜电极对一些有机物的氧化实例
6 结束语
新型电化学电极材料BDD薄膜在污水处理方面的优越性能得到广泛的承认,但是,由于BDD电极高的制造成本和为沉积金刚石薄膜选择基底方面难度以及电流密度仍不能得到很大的提高,使得BDD电极在实际的污水处理过程中遇到了瓶颈,今后的研究,可侧重于以下几方面来进行:
1)提高电流密度,BDD薄膜电极的面积小会引起电流密度小的问题。通过某种方法增加BDD电极的比表面积,以提高BDD电极表面的电流密度,理论上可使BDD电极处理污水的速度大大提高。
2)对BDD电极进行表面改性,以进一步提高BDD电极的电催化性能与寿命,例如提高掺硼量,掺入纳米粒子Pt、Au、Ni或Cu等,或者进行热处理。目前稀土金属已表现出良好的电催化性能,制作掺入稀土金属的BDD膜有可能会进一步提高BDD电极的性能。
3)目前BDD电极的价格仍较高,只是小规模应用于实际有机废水的处理,应针对实际废水开发新的联合技术。
[1]魏俊俊,贺琦,高旭辉,等.硼掺杂金刚石薄膜研究[J].人工晶体学报,2007,36(3):569~572.
[2]YORAMOREN.Capacitivedeionization(CDI)fordesalination and watertreatment-past,presentand future(a review)[J].Desalination,2008,228(1-3):10~29.
[3]RAOTN,FUJISHIMAA.Recentadvancesin electrochemistryofdiamond[J].Diamond and Related Materials,2000,9(3-6):384~389.
[4]TRIBIDASARI A.IVANDINI,RIKASATO,YOSHIHIROMAKIDE,et.al.Electroanalytical application ofmodified diamond electrodes[J].Diamond and Related Materials,2004,13(11-12):2003~2008.
[5]LIMP.Y.,LINF.Y.,SHIH H.C.,et.al.Improved stabilityoftitaniumbased boron-doped chemical vapor deposited diamond thin-film electrode bymodifyingtitaniumsubstrate surface[J].Thin Solid Films,2008,516(18):6125~6132.
[6]PLESKOVYUV.ElectrochemistryofDiamond:ARenew[J].Russ.J.Electrochem.,2002,3(12):1275~1291.
[7]TSUBOTAA T,FUKUIA T,SAITOA T,et al.Surface morphology and electrical properties of boron doped diamond films synthesized bymicrowave-assisted chemical vapor deposition usingtrimethyl boron on diamond 100substrate[J].Diamond and Re1ated Materials,2000,(9):1362~1368.
[8]FOX N A,MARY S,DAVIS T J,et al.Field.emission studies of boron-doped CVD diamond films following surface treatments[J].Diamond and Related Materials,1997,(6):1135~1142.
[9]只金芳,田如海。金刚石薄膜电化学[J].化学进展,2005,17:55~63.
[10]ALEHASHEMS,CBOMRS F,STROJEK J W,et al.Cyclic voltammetric studies of charge transfer reactions at highly boron-doped polycrystalline diamond thin-filmelectrodes[J],Anal.Chem.,l995.67:28l2~282l.
[11]满卫东,汪建华,马志斌,等,微波等离子体化学气相沉积——一种制备金刚石膜的理想方法[J].真空与低温,2003,9(1):50~56.
[12]陈琦,常明,曲长庆,等,大面积金刚石薄膜沉积系统的研究[J].天津理工大学学报,2008,24(1):21~24.
[13]PANIZZA M,CERISOLA G.Application of diamond electrodes to electrochemical processes[J].Electrochimica Acta 2005,51:191~199.
[14]COLI EY A L,WILLIAMsCG,DHAENENSJ U,et al.Examination of the spatially heterogeneous electroactivity of boron-doped diamond microarrayelectrodes[J].Ana1 Chem,2006,78:2539~2548.
[15]BAUMER US,SCHAFER H J.Cleavage ofalkenes byanodicoxidation[J].J.ofAppli.Electrochem.,2005,35(12):1283~l292.
[16]WEISS E,GROENEN-SERRANO K,SAVALL A.Electrochemical mineralization of sodium dodecylbenzenesulfonate at boron doped diamond anodes[J],J.ofAppli.Electrochem.,2007,37:1337~1344.
[17]PANIZZAM,ZOLEZZI M,NICOLELLAC.Biological and electrochemical oxidation ofnaphthalenesulfonates[J],J.Chem.Technol.Biotechnol.2006,81:225~232.
[18]LISSENS G,PIETERS J,VERHAEGE M PINOY L,et al.Electrochemical degradation of surfactants by intermediates of water discharge at carbon-based electrodes[J].ElectrochimActa,2003,48:1655~1663.
[19]SAEZ C,PANIZZA M,RODRIGO M.A,et al.Electrochemical incineration of dyes using a boron-doped diamond anode[J].J.Chem.Technol.Biotechnol.2007,82:575~581.
[20]KOPARAL A S,YAVUZ Y,GUREL C,et al.Electrochemical degradation and toxicity reduction of C.I.Basic Red 29 solution and textile wastewater byusingdiamond anode[J].J Hazard Mater,2007,145:100~108.
[21]BUTRON E,JUAREZ ME,SOLIS M,et al.Electrochemical incineration of indigo textile dye in filter-press-type FM01-LC electrochemical cell usingBDDelectrodes[J].Electrochim.Acta 2007,52:6888~6894.
[22]陈兴峰,戴军之,黄铭敏,等,掺硼金刚石厚膜电极污水处理实验研究[J].机械制造与研究,2008,37(4):12~14.
[23]XIUPING ZHU,JINREN NI,PENG LAI.Advanced treatment of biologically pretreated coking wastewater by electrochemical oxidation usingboron-doped diamond electrodes[J].water research,2009,43:4347~4355.
[24]PANIZZA M,CERISOIA G.Influence of anode material on the electrochemical oxidation of 2-naphthol Part 1.Cyclic voltammetry and potential step experiments[J].Electrochimica Acta,2003,48:3491~3497.
[25]GHERARDINI I,MICHAUD P A,PANIZZA M ,et al.Electrochemical oxidation of 4-chlorophenol for wastewater treatment[J].Journal ofthe Electrochemical Society,2001,148(6):D78~D82.
[26]RODRIGO M A,MICHAUD P A,DUO I,et al.oxidation of 4-chlorophenol at boron-doped diamond electrode for wastewater treatment[J].Journal ofthe Electrochemical Society,2001,148(5):D60~D64.
[27]POLCARO A M,MASCIA M,PALMAS S,et al.Electrochemical degradation of diuron and dichloroaniline at BDD electrode[J].Electrochimi Acta,2004,49(4):649~656.
[28]POLCARO A M,VACCA A,MASCIA M,et al.Oxidation at boron doped diamond electrodes:an effective method tomineralise triazines[J].Electrochimi Acta,2005,50(9):l841~1847.
[29]BELLAGAMBA R,MICHAUD P A,COMNINELLIS C,et al.Electro-combustion of polyacrylates with boron-doped diamond anodes[J].ElectrochemCommuni,2002,4(2):171~176.
[30]CARLOSA,MARTINEZ-HUITLE,MARCOA.et al,Recent environmental applications ofdiamond electrode:critical review[J].J Environ EngManage,2008,18(3):155~172
[31]LEVY-CLEMENT C,NDAO N A,KATTY A,et al.Boron doped diamond electrodes for nitrate elimination in concentrated wastewater[J].Diam.Relat.Mater.2003,12(3-7):606~612.
[32]NDAO A N,ZENIA F,DENEUVILLE A,et al.Effect of boron concentration on the electrochemical reduction of nitrates on polycrystalline diamond electrodes[J].DiamRelat Mater,2000,9:1175~1180.
[33]SINE G,OUATTARAL,PANIZZAM,et al.Electrochems[J].Solid State,2003,6:D9~D11.
[34]INIESTA J,MICHAUD P A,PANIZZA M,et al.Electrochemical oxidation of phenol at boron-doped diamond electrode[J].ElectrochimActa ,2001,46(23):3573~3578.
[35]JOHN H T,LUONG,KEITH B MALE ,et.al.Boron-doped diamond electrode:synthesis,characterization,functionalization and analytical applications[J].The Royal SocietyofChemistry,2009,134:1965~1979.
[36]COMNINELLIS C.Electrocatalysis in the electrochemical conversion/combustion of organic pollutants for wastewater treatment[J].Electrochimica Acta,1994,39:1857~1862.
[37]FOTI G,GANDINI D,COM NINELLIS C,et al.Oxidation of organics by intermediates of water discharge on IrO2 and synthetic diamond anodes[J].Electrochemical and Solid-StateLetters.1999,2(5):228~230.
[38]GANDINI D,MAHE E,MICHAUD P A,et al.Oxidation of carboxylic acids at boron-doped diamond electrodes for wastewater treatment,[J].Appl Electrochem,2000,30:1345~1350.
[39]GANDINI D,MICHAUD P A,DUO I,et al.Electrochemical behavior of synthetic boron-doped diamond thin film anodes[J].New DiamFront C Tec,1999,9:303~316.
[40]CANIZARES P,GARCIA-GOMEZ J,LOBATO J,et a1.Electrochemical Oxidation of Aqueous Carboxylic Acid Wastes Using Diamond Thin-FilmElectrodes[J].Ind EngChem Res,2003,42(5):956~962.
[41]BELLAGAMBA R,MICHAUD P A,COMNINELLIS CH,et al.Electro-combustion of polyacrylates with boron-doped diamond anodes[J].ElectrochemCommun,2002,4:171~176.
[42]PERRET A,HAENNI W,SKINNER N,et al.Electrochemical behaviour of synthetic diamond thin film electrodes[J].Diam Relat Mater,1999,8:820~823.
[43]BOYE B,MICHAUD P A,MARSELLI B,et al.Anodic oxidation of4-chlorophenoxyacetic acid on synthetic boron-doped diamond electrodes[J].NewDiamFront CTec,2002,12(2):63~72.
[44]BRILLAS E,BOYE B,SIRES I,et al.Electrochemical destruction of chlorophenoxy herbicides by anodic oxidation and electro-Fenton's usinga boron-doped diamond electrode[J].ElectrochimActa,2004,49:4487~4496.
[45]TROSTER I,FRYDA M,HERRMANN D,et al.Electrochemical advanced oxidation process for water treatment using Diachem electrodes[J].DiamRelat Mater,2002,11:640~645.
[46]LISSENS G,PIETERS J,VERHAEGE M,et al.Electrochemical degradation of surfactants by intermediates of water discharge at carbon-based electrodes[J].ElectrochimActa,2003,48:1655~1663.
[47]KRAFT A,STADELNN M,BLASCHKE M.Anodic oxidation with doped diamond electrodes:a new advanced oxidation process[J].Hazard Mater,2003,103:247~261.
[48]PANIZZA M,CERISOLA G,Influence of anode material on the electrochemical oxidation of 2-naphthol Part 2.Bulk electrolysis experiments[J].ElectrochimActa,2004,49:3221~3226.
[49]CANIZARES P,SAEZ C,LOBATO J,et al.Electrochemical Treatment of 4-Nitrophenol-Containing Aqueous Wastes using Boron-Doped Diamond Anodes[J].Ind EngChemRes,2004,43:1944~1949.
[50]CANIZARES P,SAEZ C,LOBATO J,et al.Electrochemical Treatment of 2,4-Dinitrophenol Aqueous Wastes Using Boron-Doped Diamond Electrodes[J].ElectrochimActa,2004,49:4641~4650.
[51]高成耀,常明.Ta/BDD薄膜电极电化学催化氧化硝基酚[J].物理化学学报,2008,24(11):1988~1994.
[52]POLCARO A M,VACCA A,MASCIA M,et al.Oxidation at boron doped diamond electrodes:An effective method to mineralize triazines[J].ElectrochimActa,2005,50:1841~1847.
[53]HATTORI S,DOI M,TAKAHASHI E,et al.Electrolytic decomposition of amaranth dyestuff using diamond electrodes[J].Appl Electrochem,2003,33:85~90.
[54]MORAO A,LOPES A,AMORIM M T P D,et al.Degradation of mixtures of phenols using boron doped diamond electrodes for wastewater treatment[J].ElectrochimActa,2004,49:1587~1595.
[55]CANIZARESP,GARCIA-GOMEZJ,SAEZC,et al.Electrochemical Oxidation ofSeveral Chlorophenols on Diamond Electrodes.Part I.Reaction Mechanism[J].Appl Electrochem,2003,33:917~927.
[56]CANIZARES P,GARCIA-GOMEZJ,SAEZ C,et al.Electrochemical Oxidation of Several Chlorophenols on Diamond Electrodes.Part II.Influence ofWaste Characteristics and OperatingConditions.[J].Appl Electrochem,2004,34:87~94.
[57]GHERARDINI L,MICHAUD P A,PANIZZA M,et al.Electrochemical Oxidation of 4-Chlorophenol for Wastewater Treatment.Definition ofNormalized Current Efficiency[J].ElectrochemSoc,2001,148:D78~D82.
[58]PANIZZA M,DELUCCHI M,CERISOLA G.Electrochemical degradation of anionic surfactants[J].Appl Electrochem,2005,35:357~361.
[59]王领,常明,高成耀,等.Ta/BDD电极电化学处理超高浓度有机废水的研究[J].天津理工大学学报,2009,25(1):49~52.
