胃癌腹膜转移相关基因的动物实验研究
2010-05-24王殿栋段建中张克实韩熙渊
王殿栋, 段建中, 张克实, 韩熙渊
胃癌是我国常见的恶性肿瘤之一,位居消化道肿瘤第一位。根治性手术后的5年生存率仍然很低,其主要原因是术后复发转移,其中腹膜种植转移约占50%。现在认为胃癌的腹膜种植转移与基因有密切关系[1]。目前,关于胃癌腹膜种植转移的基因研究主要集中于一些粘附分子、降解酶、细胞因子和某些转移相关基因。然而众多的研究集中于某单个基因在某一个过程中的作用。比如,目前研究的转移基因中CD44是最重要的粘附分子[2],其参与瘤细胞与宿主细胞和宿主基质的粘附,这种异质型粘附,在癌细胞侵袭和转移过程中起促进作用;MMP是目前研究的最重要的降解酶,通过对细胞外基质中不同成份的降解,在肿瘤侵袭转移中起关键性作用。但在其他转移环节中,以上基因似乎无任何作用[3]。所以促进胃癌腹膜种植转移的基因可能不是某些单个基因的结果,而是诸多基因的协同作用,进而有必要去探索所有与胃癌腹膜种植转移有关的可疑基因。而要去同时检查出所有的可疑基因,就需要一个高通量的技术手段来进行研究。基因芯片就是目前较好的方法[4]。基因表达谱芯片的应用,提供了相关基因的基因组学的证据,打破了以往单个基因孤立研究的局限,是从整体上全面了解整个基因组多个基因的变化,为在全基因组范围内寻找与肿瘤发生、发展相关的基因变化提供了一个有效手段。基因芯片技术可以通过一次性实验检测到数百至数千个基因,并能进行平行分析,具有快速、准确、敏感的特点,目前已被广泛应用于肿瘤研究中[5]。
1 材料和方法
1.1 主要材料 人胃癌细胞株SGC-7901由包头医学院侯培珍教授恵赠;5周龄的BALB/c雄性裸鼠购于上海斯莱克实验动物有限责任公司[动物质量合格证号:SCXK(沪)2007-0005],共30只,体重20~22 g;芯片杂交的所有试剂、设备以及技术均由中科院上海芯超公司提供。
1.2 细胞培养 人胃癌细胞株SGC-7901用含有10%小牛血清的1640培养液在37℃、5%CO2条件下培养,反复传代到细胞生长至对数生长期。用0.25% 胰蛋白酶消化,用灭菌PBS将细胞密度调到1×107个/mL用于建立动物模型。
1.3 动物模型的建立及标本收集 将备用的单细胞悬液0.2 mL注入裸鼠腋窝皮下;SPF级条件下饲养裸鼠,每天观察肿瘤生长情况。待肿瘤长到直径约1 cm后处死裸鼠,无菌下完整取出肿瘤,选鱼肉样周围肿瘤组织将其切成直径约2 mm大小的瘤块;将瘤块再置于另一只裸鼠腋窝皮下;如此方法反复传代肿瘤3次,最后切成直径约2 mm大小的瘤块置于生理盐水中备用。取剩余裸鼠15只,用20 mg/mL浓度的水合氯醛注射液0.2~0.3 mL行腹膜腔麻醉;所有操作遵循无菌原则,手术野常规酒精消毒,取左侧肋弓下斜切口,逐层入腹腔,将胃轻轻拉出,用手术刀尖轻轻划开胃浆膜层,长度约2 mm;再用8-0丝线将上述备好的小瘤块穿透胃全层缝挂于浆膜破损的胃壁区;将胃还纳入原位,缝合腹膜及皮肤;术毕。术后继续SPF级下饲养裸鼠,并每天观察腹部生长情况;待裸鼠有腹水形成后脱颈处死,取出原发灶和转移灶;病理检查证明是肿瘤转移灶;将其置于无菌EP管中迅速液氮保存备用。
1.4 探针制备 取出备好的标本,每50~100 mg组织中加入1 mL的TRIzol,然后在匀浆器中将组织打碎;均质化的样本在15℃ ~30℃放置5 min,之后加入0.2倍体积的氯仿,盖紧后将其剧烈摇匀,然后再在15℃ ~30℃放 2~3 min,4℃、7 000 rpm 离心15 min;取上清液并将其置于新的离心管中,加入0.8倍体积的异丙醇揺匀,再4℃、7 000 rpm离心15 min,弃上清液;加入70%的酒精,洗去沉淀所含的盐分,再次4℃、7 000 rpm离 心10 min,弃上清液;以上步骤重复1次;15℃ ~30℃晾干,加入适量无RNA酶的水溶解;用分光光度仪测定RNA的浓度,A260/A280接近于2.0为纯RNA。经检测RNA质量完好。然后进行cRNA合成。取上述cRNA 4 μg 并浓缩至 6.6 μL,加 10 μL 的 DMSO 揺匀,加3.4 μL 的0.3 M NaHCO3并揺匀;将20 μL 的 cRNA混合物加入到荧光染料中并揺匀;水浴、25℃、1 h,再加9 μL的4M Hydroxylamine揺匀后 25℃保温15 min。进行荧光标记。
1.5 芯片杂交 取Cy3探针90 pmol,取Cy5探针60 pmol,浓缩至 7 μL,然后转到 0.2 mL PCR 管内;将溶解的探针置于PCR仪中94℃变性3 min,取出加入 CotIDNA 1 μg,A80lug放回PCR 仪中,70℃保温30 min;反应结束后,加入9 μL杂交缓冲液和18 μL甲酞胺,总体积达到36 μL,充分混匀;取杂交液滴加于芯片上,盖上盖玻片;将杂交芯片水平放入加有1×PBS的杂交盒,置42℃杂交箱中避光杂交16~18 h。杂交结束后,用镊子取出芯片,浸入经过50℃预热的洗液Ⅰ(1×SSC+0.2%SDS)中,使盖玻片从芯片上自然脱下,然后在50℃洗液Ⅰ中洗涤10 min;从洗液Ⅰ中取出芯片,浸入50℃预热的洗液Ⅱ(0.1 × SSC+0.2%SDS)中,洗涤 10 min,然后再转入新的洗液Ⅱ中,重复2次;从洗液Ⅱ中取出芯片,室温洗液Ⅲ(0.1×SSC洗涤5 min,重复2次);取出芯片于去离子水中室温洗涤2 min;用镊子小心将芯片取出,迅速转入50 mL空离心管中,1 500 rpm,5 min,干片;最后将芯片取出立即扫描或放入芯片盒,避光保存于干燥器中。
1.6 获取数据 芯片结果采用Alight Scanner来获取图像,再通过 Imagene转化为数据,最后应用Genespring分析软件来取差异倍数Ratio。将转移灶与原发灶的比值Ratio≥2或Ratio≤0.5的基因筛选出来作为差异基因。
2 结果
2.1 裸鼠人胃癌腹膜转移模型的建立 共建立了15只原位移植瘤模型,成功率为100%(15/15)。在胃癌组织块原位种植后3周左右,上腹部深压时可扪及一硬块,4~5周后裸鼠中上腹部可明显扪及肿块,直径约1 cm大小。之后,瘤体继续增大,腹部可见巨大瘤体突起,动物极度消瘦、倦怠,对周围刺激反应差,逐渐出现全身衰竭,有3只死亡。
在移植后8~10周,有6只出现明显腹部膨隆现象,表明已有腹水形成。裸鼠弓背、喜睡、纳差、食欲下降。约第11周,脱颈处死裸鼠,剖腹探查发现6只均有明显的腹膜转移灶,转移灶多分布于小肠与结肠的浆膜上,数量为每只裸鼠2~3枚,大小不一,最大直径可有3 mm,随机取出1枚转移灶做病理检查,显示为低分化腺癌。腹膜转移成功率为40%(6/15)。
2.2 芯片结果 一般认为Ratio(Cy3/Cy5)在0.5~2.0之间为无差别基因,Ratio≥2为上调基因,Ratio≤0.5为下调基因,我们发现了192个上调基因和139个下调基因。基因芯片分析散点图见图1。我们认为,Ratio在5~10的上调基因在腹膜转移过程中可能较有研究价值,而Ratio在0.3~0.4的下调基因也可能较有研究价值,具体见表1、2。
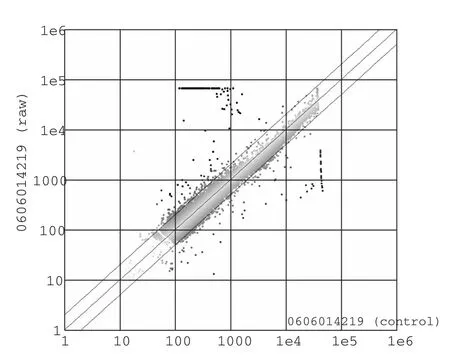
图1 基因芯片分析散点图

表1 Ratio位于5~10之间的基因
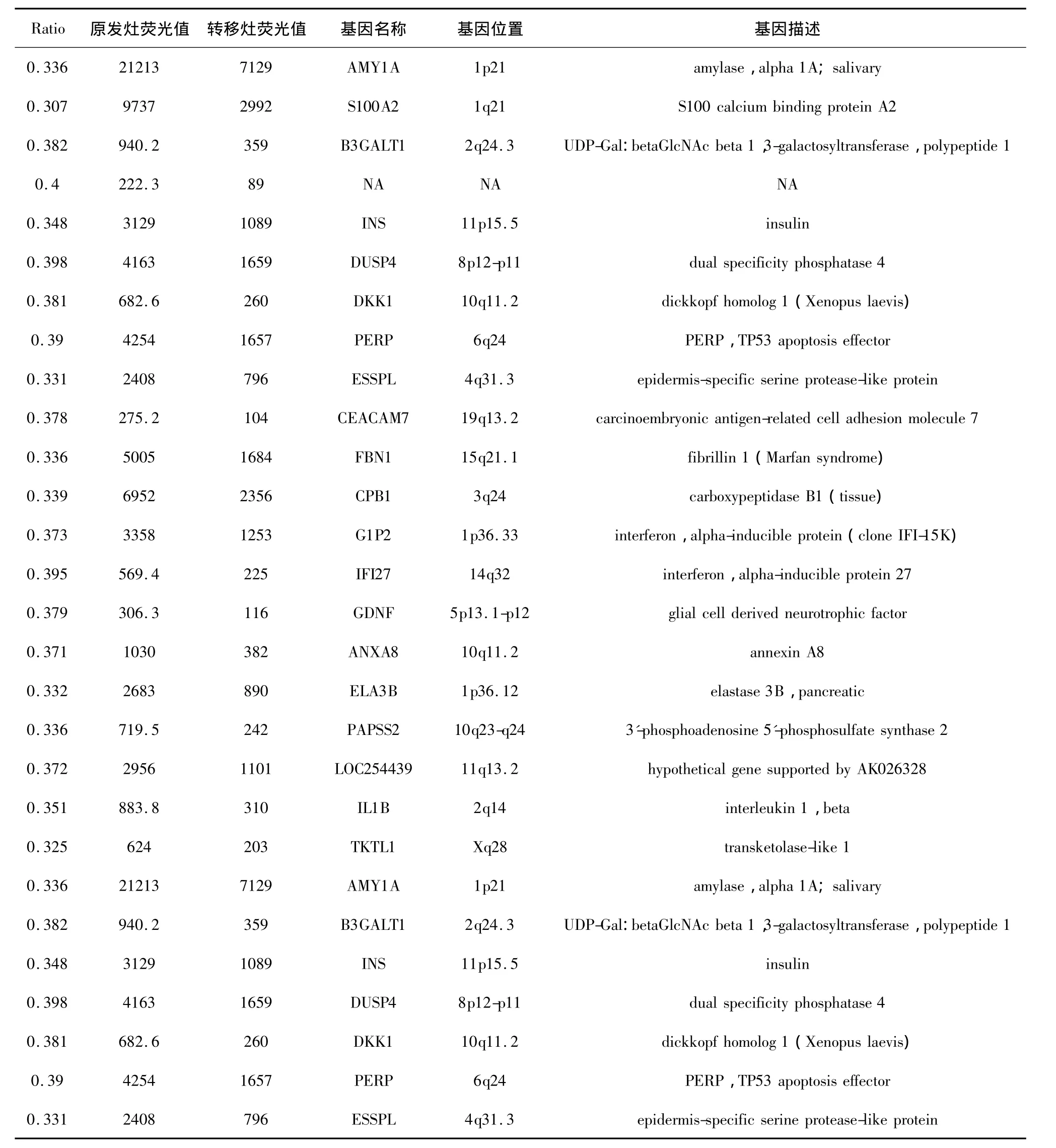
表2 Ratio位于0.3~0.4之间的基因
3 讨论
3.1 关于裸鼠人胃癌腹膜转移模型建立的讨论理想的人体肿瘤动物模型是研究肿瘤生长和转移生物学行为的重要工具。这些模型必须能够很好地模拟人体内肿瘤的生物学行为。一个很好的胃癌动物模型应该具备肿瘤在其局部呈浸润性生长、局部或远处转移的条件[6]。要建立能很好地模拟人体肿瘤恶性生物学行为的移植模型,必须使用有高转移潜能的瘤细胞,使其在相应的器官环境中生长。在人体恶性肿瘤的生物学特征中,浸润和转移为其最主要的两个特征,也是导致肿瘤患者死亡的主要原因。建立人体肿瘤原位移植动物模型的主要目的也是为此特征的研究,进而为临床治疗研究提供一个理想工具。原位移植就是将人体肿瘤接种到与肿瘤原发部位相对应的移植宿主器官组织内,使其获得与人体肿瘤相似的微环境。在此环境中不但有利于肿瘤生长,而且有利于肿瘤恶性行为的表达。因此,利用原位移植的方法建立人体肿瘤移植动物模型也是目前被广泛接受的肿瘤异种移植方法。目前常用的原位移植方法多是以细胞悬液的形式建立,但体外培养和悬液制备过程中可能会破坏肿瘤原有的组织结构,影响肿瘤生物学特性的进一步表达。新近研究发现,临床新鲜标本或移植性肿瘤组织保存了肿瘤的原有组织结构,其恶性行为的表达也更接近于临床,但临床新鲜标本中的肿瘤细胞系不确定性也会给实验带来诸多不便。而本课题采用原位移植方法,主要是考虑到课题最终要完成研究致胃癌腹膜转移的基因,期间不同的肿瘤细胞系可能会有不同的致转移情况,所以采用已知的、单一的肿瘤细胞系可能会给实验结果带来更高的准确性。
既往采用的方法是裸鼠皮下植入人肿瘤细胞,生长出来的肿瘤组织在形态、功能、生化特征等方面与人胃癌十分相似,但因其周围有结缔组织包裹,限制了肿瘤浸润及转移,即便是选用高转移性的肿瘤也仅能形成局部肿瘤。近年研究发现,移植瘤是否能够发生转移,不仅取决于瘤细胞本身的转移潜能,还决定于宿主器官对应的环境因素,裸鼠体内特定的解剖部位所提供的微环境对肿瘤细胞的生物学行为有重要的影响,而且肿瘤细胞和宿主微环境的相互影响对转移过程的完成起着举足轻重的作用。1889年Paget提出“种子与土壤”学说,认为只有种子(癌细胞)与土壤(患者器官微环境)相互作用才可能产生转移瘤。越来越多的学者认识到肿瘤生长和亲器官性转移位点的微环境对于转移链的各个环节均有不同程度的影响[7],因而提出建立人类肿瘤模型的原位移植瘤模型。本实验利用侵袭性很高的人胃癌细胞系SGC-7901建立裸鼠腹膜转移模型,取得了很好的结果。胃癌成瘤率达100%,腹膜转移率达40%。另外,裸鼠的免疫功能差,无排异反应是我们能够成功利用裸鼠建立异体移植瘤的关键。
3.2 关于芯片结果的分析和讨论 胃癌腹膜转移是一个复杂的生理过程。恶变的细胞会逐渐产生变异并具有腹膜转移的特征。这是由多种癌基因和抑癌基因协同作用的结果。通过对胃癌腹膜转移组织cDNA芯片的研究表明,在筛选出的差异基因中,无论192个上调基因(Ratio≥2)还是139个下调基因(Ratio≤0.5),基本上包括所有功能的基因,如上调基因中的 S100A4、EGR1、REGⅣ、OSR1、MYH2 等,下调基因RGS16、CES2、G1P2等。他们大多数属于抗氧化活性相关基因、细胞凋亡相关基因、细胞粘合相关基因、细胞代谢相关基因、细胞周期相关基因、酶调控活性相关基因、细胞信号转导活性相关的基因、细胞结构分子活性相关基因、转录调控活性相关基因、翻译调控活性相关基因、转运活性相关基因等[8]。我们将Ratio≤0.5的基因定为下调基因,即这些基因的表达下调可能会导致胃癌的腹膜转移。
总之,胃癌腹膜转移是一个多种基因共同作用的结果,各基因之间可能会有相互的促进或抑制关系。这些关系有待于继续研究。
[1]Fidler IL.Critical factors in the biology of human cancer metastasis:twenty-eighth G.H.A.Clowes memorial award lecture[J].Cancer Res,1990,50(19):6130-6138.
[2]Handorean AM,Yang K,Robbins EW,et al.Silibinin suppresses CD44 expression in prostate cancer cells[J].Am J Transl Res,2009,1(1):80-86.
[3]Frontczak-Baniewicz M,Walski M,Madejska G,et al.MMP2 and MMP9 in immature endothelial cells following surgical injury of rat cerebral cortex—a preliminary study[J].Folia Neuropathol,2009,47(4):338-346.
[4]Donato R.SlOO:a multigenic family of calcium-modulated proteins of the EF-hand type with intracellular and extracellular functional roles[J].Int J Biochem Cell Biol,2001,33(7):637-668.
[5]Yamaguchi K,Ura H,Yasoshima T,et al.Liver metastatic model for human gastric cancer established by orthotopic tumor cell implantation[J].World J Surg,2001,25(2):131-137.
[6]Kaufmann Y,Todorova VK,Luo S,et al.Glutamine affects glutathione recycling enzymes in a DMBA-induced breast cancer model[J].Nutr Cancer,2008,60(4):518-525.
[7]Marchenko MM,Shmarakov IA,Pasaǐliuk MV.Effect of vitamin A provision on antineoplastic resistance in rats[J].Vopr Pitan,2008,77(6):4-8.
[8]Dukhanina EA,Lukyanova TI,Romanova EA,et al.Comparative analysis of secretion of S100A4 metastatic marker by immune and tumor cells[J].Bull Exp Biol Med,2008,145(1):78-80.
