巨细胞病毒感染与冠心病患者的白细胞介素-10水平升高相关
2010-05-22王卫明,孙余华
研究显示,炎症参与了动脉粥样硬化病变的发生、发展以至最终血栓形成[1-2]。还有研究表明,细胞因子网络与缺血性心脏病有关,炎症标致物C-反应蛋白和其它细胞因子,如白介素(Interleukin,IL)-1和IL-6,被认为能增加动脉粥样硬化的炎症反应[1-2],而IL-10,则被认为是细胞因子网络中的负相调节细胞因子[3]。IL-10主要由Th2、巨噬细胞和活化B细胞产生,它抑制T细胞、单核-巨噬细胞产生炎症因子,如:IL-1、IL-6、γ-干扰素和肿瘤坏死因子-α,并抑制抗原提呈和免疫激活过程中细胞表面的分子表达,在抑制细胞免疫的同时,增强体液免疫[4-5]。体外和动物试验显示,IL-10在动脉粥样硬化病变的发生和发展中,有抗炎和抑制病变的作用[6-9],但临床上,有关冠心病患者IL-10水平的研究结果并不一致[10-13]。
巨细胞病毒(Cytomegalovirus,CMV)、单纯疱疹病毒-1型[14]、单纯疱疹病毒-2型[15]、肺炎衣原体[16-17]等微生物感染可能参与心血管病的发生[18],造成冠状动脉粥样斑块不稳定,加速动脉粥样硬化病变和增加心血管事件[18]。有研究表明,在冠心病患者,CMV感染参与上调局部和循环中的炎症细胞因子,如:IL-1,IL-6和C反应蛋白[19], 但CMV感染对IL-10水平的影响知之甚少,因此,本研究意欲探讨CMV感染对冠心病患者血清IL-10水平的影响。
1 对象与方法
1.1 研究对象
选择水利医院住院患者188例,其中冠心病患者106例,对照组患者82例。所有10例冠心病患者均行冠状动脉造影,证实有1支或1支以上的主要冠脉分支存在≥50% 的狭窄。对照组患者为或有不典型冠心病症状,或有冠心病传统危险因素,而怀疑患有冠心病,但经冠状动脉造影证实冠脉壁光滑,而在临床上排除患有冠心病。另外,57例冠状动脉造影显示有冠脉管壁有不规则病变者,被排除出本研究。
1.2 一般资料
188例患者的基本统计学资料见表1。在冠心病组,患者合并糖尿病、高血压的比例显著高于对照组(P<0.01)。 冠心病组与对照组相比,CMV IgG阳性率统计学差异无显著性(38.9% vs.37.6%,P>0.05 )。冠心病组IL-10水平显著高于对照组,7.3(3.0 -12.5) pg/ml vs. 5.9 (3.2 - 10.4) pg/ml(P= 0.043)。
1.3 方法
1.3.1 IL-10的相关因素 本研究分析了影响IL-10潜在的相关因素包括:年龄、性别、吸烟、糖尿病、血脂紊乱、高血压、体重指数、体力活动少和血清CMV- IgG阳性。吸烟状态分为目前吸烟、既往吸烟(停止吸烟>1个月至<40年)和不吸烟(从不吸烟或戒烟 ≥40年)。糖尿病患者指空腹血糖 ≥7.0 mmol/L (126 mg/dl) 或者已经使用口服降糖药物或胰岛素治疗者。高血压指收缩压 ≥140 mmHg和/或舒张压 ≥90 mmHg或已经应用降压药物治疗的患者。血脂紊乱指空腹总胆固醇 ≥220 mg/dl (5.72 mmol/L), 或甘油三脂 ≥200 mg/dl (2.26 mmol/L), 或HDL-C<40 mg/dl (1.04 mmol/L), 或经计算的LDL-C ≥140 mg/dl (3.64 mmol/L), 或者已接受调脂治疗。从事较多脑力劳动者被认为体力活动少。
1.3.2 试验技术 患者入院后,取过夜空腹血。标本采集后放置-80℃冰箱保存。使用美国BioSource International生产(双单抗夹心法)的高灵敏度人IL-10 ELISA试剂,定量测量IL-10,检测限度为 0.3 pg/ml,组间变异为 7.8%。CMV (AD 169)-IgG检测试剂盒购于中国预防医学科学院病毒研究所,其原理基于间接固相酶联免疫吸附试验,根据阴性和阳性对照,得出CMV IgG阳性界值,CMV IgG阳性表示既往CMV感染。
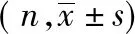
表1 研究对象的一般资料
注:括号内为百分数;290例患者(83.3%)的吸烟资料可用
1.3.3 统计分析 记数资料采用Pearson χ2检验或Fisher检验进行分析。体重指数以均值±标准差表示,用t检验分析。IL-10为非正态分布,用中位数及(25%和75%)百分位数表示,两组间比较采用非参数检验(Mann-Whitney U 检验)。所有个体(n=288),据计算出的IL-10中位数值(6.84 pg/ml),分高、低IL-10组[20],以高IL-10作为应变量,其它可能的相关因素作为因变量,以Logistic回归分析IL-10的影响因素,并用调整后的危险度比值比(OR)和95%的可信区间表示相关因素对IL-10的影响。P<0.05统计学差异具有显著性。SPSS 10统计软件进行分析。
2 结果
2.1 IL-10升高相关的单因素分析
如表2所示,高IL-10组的CMV IgG阳性率显著高于低IL-10组的CMV IgG阳性率(46.8% vs. 30.4%,P<0.001),而性别、年龄、吸烟、高血压、糖尿病和血脂紊乱在高、低IL-10组间的差异无统计学意义(P>0.05)。
2.2 在冠心病组,高IL-10 组中的CMV IgG阳性率显著高于低IL-10组的CMV IgG阳性率(48.1% vs. 28.6 %,P<0.001),但在对照组患者的高、低IL-10 组中,未见CMV IgG阳性率的显著差异(40.4% vs. 35.6%,P=0.588),见表3。
2.3 IL-10升高相关因素的多元Logistic回归分析
表4为高IL-10的每个相关因素调整后的OR值和95%的可信区间。在冠心病组,只有CMV IgG阳性与高IL-10独立相关,调整的OR值为2.3(1.6~3.4,P<0.001)。在对照组,CMV IgG阳性与高IL-10调整后的OR值为1.1(0.5~2.5,P=0.83)。调整变量包括年龄、性别、吸烟、高血压、血脂紊乱、糖尿病及较少体力活动。
3 讨论
本研究表明:在冠心病患者,CMV感染与血清IL-10水平升高独立相关。
CMV感染与冠心病患者血清IL-10水平升高相关的机制,可能与CMV感染刺激体内Th2细胞、巨噬细胞、B细胞产生IL-10有关[4-5]。尽管体外研究显示单核细胞被CMV感染后不能产生IL-10[21],但CMV感染后,肾移植患者血浆IL-10水平升高[22],肺组织和支气管肺泡灌洗出的细胞中IL-10mRNA 水平较高,支气管肺泡灌洗液中的IL-10升高[23]。本研究也表明CMV感染与冠心病患者高IL-10水平相关。因此,CMV体内感染可能与疾病相关因素协同作用于IL-10的产生。
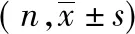
表2 高IL-10相关因子的单因素分析
注:高、低IL-10组据所有个体的IL-10水平的中位数(6.84 pg/ml)界定;括号内为百分数;290例患者(83.3%)的吸烟资料可用
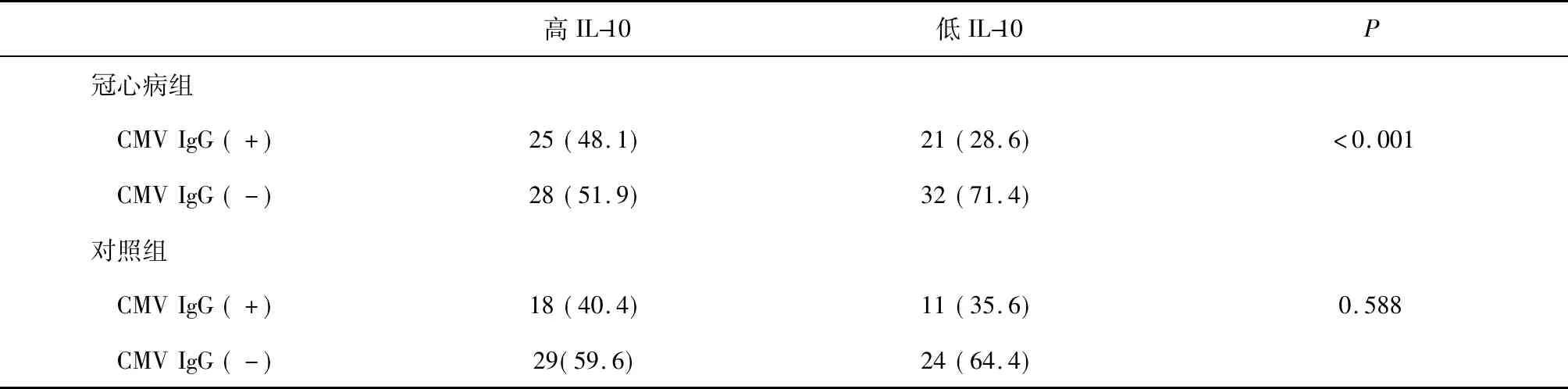
表3 高、低IL-10组中的CMV IgG阳性率比较
注:高、低IL-10组据所有个体的IL-10水平的中位数(6.84 pg/ml)界定;括号内为百分数
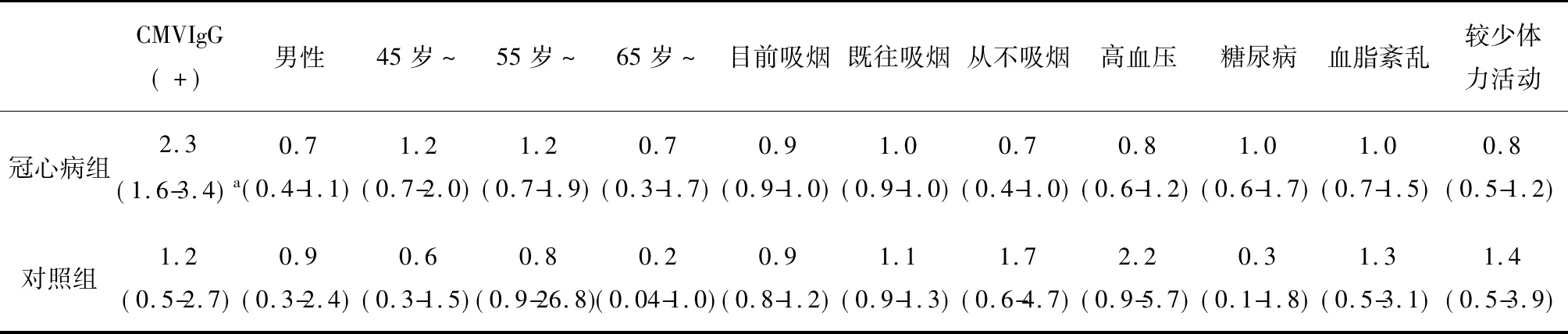
表4 高IL-10影响因素的多元Logistic回归分析 [调整后的OR值(95% 可信区间)]
注:aP<0.001
本研究资料虽然未显示冠心病和冠状动脉壁光滑的CMV感染率有显著差异,但CMV感染对IL-10水平的影响主要是在冠心病患者,而对冠状动脉壁光滑者的影响不显著。结合其它研究报道,有理由认为,在某些冠心病患者(IL-10产生与遗传相关[24-25]),CMV感染不仅参与上调局部和循环中的致炎细胞因子,如:IL-1,IL-6和C反应蛋白[19],也与抗炎细胞因子IL-10的水平增加有关。因此,冠心病时,体液循环中和动脉粥样病变的局部,细胞因子网络可能处于超敏状态,致炎和抗炎细胞因子水平都增加,而这种有个体差异的细胞因子超敏状态激活或维持,可能与CMV感染有关。换言之,冠心病与CMV感染使患者的细胞因子网络处于超敏状态有关,增高的细胞因子还可能参与免疫细胞的激活,由此产生炎症反应。基于此,将外源性IL-10用于CHD的治疗值得商榷,也许将冠心病患者血中的细胞因子超敏状态下调至正常,比给予患者外源性IL-10[20],更有益于冠心病的预后。因为本研究还表明,冠状动脉光滑者的IL-10水平比冠心病患者低。我们还认为,CMV感染诱导机体产生IL-10原因,也有可能使CMV更容易逃逸机体的免疫反应清除。无论如何,冠心病患者CMV感染与IL-10升高的意义,需要谨慎的解释和进一步研究。
有报道高胆固醇血症的IL-10水平较高[26],血管紧张素转换酶抑制剂[27]和β受体阻滞剂[28]可降低IL-10水平,而类固醇激素的应用则有上调IL-10水平的作用[29]。本研究中的所有个体均为住院患者,药物治疗对IL-10水平可能有一定的影响。尽管如此,本研究资料未显示传统的危险因素,如:高血压、血脂紊乱、糖尿病、吸烟和体重指数对冠心病患者的血清IL-10水平有显著影响。
本研究中有二方面局限性。首先,特异性的CMV IgG阳性或阴性,不是衡量CMV感染与否的金标准,但是,与CMV IgG阴性个体相比,CMV IgG阳性可认为是经常性的、近期的、或较严重的CMV慢性感染。其次,本研究设计为横断面病例对照研究,因此,我们只能据此提出假设,而非因果关系的证明。
总之,本研究表明CMV感染与冠心病患者的IL-10升高相关,CMV感染可能增加冠心病患者IL-10产生。因此,我们认为,在冠心病患者,CMV感染的免疫应答可能是一个影响细胞因子网络的复杂反应。
[1]Libby P, Ridker PM, Maseri A. Inflammation and Atherosclerosis[J]. Circulation, 2002, 105:1135-1143.
[2]Ross R. Atherosclerosis: an inflammatory disease[J]. N Eng J Med, 1999, 340:115-126.
[3]Moore KW, de Waal Malefgt, Coffman RL, et al. Interleukin-10 and the interleukin-10 receptor[J]. Annu Rev Immunol, 2001, 19:683-765.
[4]Moore KW, Vieira P, Fiorentino DF, et al. Homotology of cytokine synthesis inhibitory factor (IL-10) to the Epstein Barr Virus genes BCRFI[J]. Science, 1990, 248:1230.
[5]Fiorentino DF, Bond MW, Mosmann TR. Two types of mouse T helper cells iv. Th2 clones secret a factor that inhibits cytokine production by Th1 clones[J]. J Exp Med, 1989, 170:2081.
[6]Lacraz S, Nicod LP, Chicheportiche R, et al. IL-10 inhibits metalloproteinase and stimulants TIMP-1 production in human mononuclear phagocytes[J]. J Clin Invest, 1995, 95:2304-2310.
[7]Lindmark E, Tenno, T, Chen J, et al. IL-10 inhibits LPS-induced human monocyte tissue factor expression in whole blood[J]. Br J Haematol, 1998, 102:597-604.
[8]Geng Y, Shane RB, Berencsi K, et al. Chlamydia pneumoniae inhibits apoptosis in human peripheral blood mononuclear cells through induction of IL-10[J]. J Immunol, 2000, 164:5522-5529.
[9]Pinderski LJ, Fischbein MP, SubbanangounderG, et al. Overexpression of interleukin-10 by activated T lymphocyte and macrophage phenotypes[J]. Circ Res, 2002, 90:1064-1071.
[10]Smith DA, Irving SD, Sheldon A, et al. Serum levels of the antiinflammatory cytokine interleukin-10 are decreased in patients with unstable angina[J]. Circulation, 2001, 104:746-749.
[11]Mizia-Stec K, Gasior Z, Zahorska-Markiewicz B, et al. Serum tumor necrosis factor-alpha, interleukin-2 and interleukin-10 activation in stable angina and acute coronary syndromes[J]. Coron Artery Dis, 2003, 14(6):431-438.
[12]Yamashita H, Shimada K, Seki E, et al. Concentrations of interleukins, interferon, and C-reactive protein in stable and unstable angina pectoris[J]. Am J Cardiol, 2003, 91(2):133-136.
[13]Waehre T, Halvorsen B, Damas JK, et al. Inflammatory imbalance between IL-10 and TNFalpha in unstable angina potential plaque stabilizing effects of IL-10[J]. Eur J Clin Invest, 2002, 32(11):803-810.
[14]Sun Y, Pei W, Wu Y, et al. An association of herpes simplex virus type 1 infection with type 2 diabetes[J]. Diabetes Care,2005,28:435-436.
[15]Sun Y, Pei W, Wu Y, et al. Herpes simplex virus type 2 infection is a risk factor for hypertension[J]. Hypertens Res, 2004, 27,541-544.
[16]Sun YH, Pei WD, Wu YJ, et al. Smoking increases the risk of coronary artery disease in Chinese with Chlamydia pneumoniae infection[J]. Int J Cardiol, 2004, 97:199-203.
[17]孙余华,裴卫东,吴永健,等.肺炎衣原体感染增加血脂紊乱者患冠心病的危险性[J].中华医学杂志,2004,84(23):1990-1993.
[18]Espinola-Klein C, Rupprecht HJ, Blankenberg S, et al. Impact of infectious burden on extent and long-term prognosis of atherosclerosis[J]. Circulation, 2002, 105:15-21.
[19]Nieto FJ. Infection and atherosclerosis: new clues from an old hypothesis? [J]. Am J Epidemiol, 1998, 148:937-948.
[20]Hesschen C, Dimmeler S, Hamm CW, et al. Serum level of the antiinflammation cytokine interleukin-10 is an important prognostic determinant in patients with acute coronary syndromes[J].Circulation, 2003,107(16):2109-2114.
[21]Bouwman JJ, Visseren FL, Bosch MC, et al. Procoagulant and inflammatory response of virus-infected monocytes[J]. Eur J Clin Invest, 2002, 32(10):759-766.
[22]Nordoy I, Muller F, Nordal KP, et al. The role of the tumor necrosis factor system and interleukin-10 during cytomegalovirus infection in renal transplant recipients[J]. J Infect Dis, 2000, 181(1):51-57.
[23]Filice GA, Clabots CR, Riciputi PE, et al. Changes in cytokine levels during reactivation of Toxoplasma gondii infection in lungs[J]. Infect Immun, 1999, 67(5):2082-2089.
[24]Reuss E, Fimmers R, Kruger A, et al. Differential regulation of interleukin-10 production by genetic and environmental factors--a twin study[J]. Genes Immun, 2002, 3(7):407-413.
[25]Koss K, Satsangi J, Fanning GC, et al. Cytokine (TNF alpha, LT alpha and IL-10) polymorphisms in inflammatory bowel diseases and normal controls: differential effects on production and allele frequencies[J]. Genes Immun, 2000, 1(3):185-190.
[26]Mizia-Stec K, Zahorska-Markiewicz B, Mandecki T, et al. Hyperlipidaemia and serum cytokines in patients with coronary artery disease[J]. Acta Cardiol, 2003, 58(1):9-15.
[27]Lindmark E, Siegbahn A. Tissue factor regulation and cytokine expression in monocyte-endothelial cell co-cultures. Effects of a statin, an ACE-inhibitor and a low-molecular-weight heparin[J]. Thromb Res, 2002, 108(1):77-84.
[28]Ohtsuka T, Hamada M, Hiasa FG, et al. Effect of Beta-blockers on circulating levels on inflammatory and anti-inflammatory cytokines in patients with dilated cardiomyopathy[J]. J Am Coll Cardiol, 2001, 37:412-417.
[29]Harig F, Hohenstein B, von der Emde J, et al. Modulating IL-6 and IL-10 levels by pharmacologic strategies and the impact of different extracorporeal circulation parameters during cardiac surgery[J]. Shock, 2001, 16 Suppl 1:33-38.
