依达拉奉对脑出血大鼠血肿周围组织细胞凋亡及P38MAPK蛋白表达的影响
2010-05-22赵紫烨李建民张晋霞华北煤炭医学院附属医院神经内一科唐山市063000
刘 斌,赵紫烨,李建民,周 云,张晋霞(华北煤炭医学院附属医院神经内一科,唐山市 063000)
脑出血(Intracerebral hemorrhage,ICH)后脑损伤不仅是由于血肿的占位效应及血肿对周围脑组织的直接破坏,继发性脑损伤也是出血后脑损伤的主要原因。细胞凋亡在脑出血继发性脑损伤中起重要作用[1]。丝裂原活化蛋白激酶(Mitogen activated protein kinases,MAPK)是细胞内的一类丝氨酸/苏氨酸蛋白激酶,是一类重要信号转导通路。P38MAPK信号途径是MAPK家族中的重要组成部分:P38MAPK通过多级激酶的级联反应把细胞外信号向细胞内传递,传递至细胞核中,激活下游的激酶或多种转录因子从而介导细胞产生各种反应[2],在细胞凋亡中发挥重要作用[3]。依达拉奉是一种新型自由基清除剂,能够清除脑梗死周围缺血半暗带羟自由基,抑制脂质过氧化,从而抑制脑细胞的损伤和凋亡。依达拉奉对脑梗死的治疗有一定的疗效[4],但对脑出血后血肿周围组织细胞凋亡及P38MAPK蛋白表达变化的影响还未见文献报道。本实验通过建立大鼠脑出血模型,观察依达拉奉对脑出血大鼠血肿周围组织细胞凋亡及P38MAPK蛋白表达的影响,探讨依达拉奉对脑出血后脑细胞的保护作用,为临床治疗提供实验依据。
1 材料
1.1 动物
健康♂Wistar大鼠108只,体质量260~301 g,由北京维通利华实验动物技术有限公司提供,动物实验合格证号:SCXK(京)-2007-0001。
1.2 试药
Ⅶ型胶原酶(美国Sigma公司,规格:1.5 kIU);原位凋亡(TUNEL)试剂盒(福建迈新生物技术有限公司);SP试剂盒、P38MARK多克隆抗体(北京中杉金桥生物技术有限公司);依达拉奉注射液(南京先声药业公司提供,批号:040181,规格:10 mg·5 mL-1)。
2 方法
2.1 分组
取大鼠108只,随机分为脑出血组(48只)、依达拉奉治疗组(48只)、假手术组(6只)、正常对照组(6只)。脑出血组与依达拉奉治疗组再根据血肿制成后断头取脑的时间各分为3、6、12 h,1、2、3、5、7 d(时间点的选取依据脑出血的病理变化特点)共8个亚组,每组6只。
2.2 大鼠脑出血模型制作
术前大鼠12 h禁食,4 h禁水,以100 g·L-1水合氯醛(300 mg·kg-1)腹腔注射麻醉,保证手术期间大鼠有自主呼吸。然后参照Rosenberg等[4]的方法,根据《大鼠脑立体定位图谱》[5],将胶原酶(在生理pH和温度下,该化合物具有水解天然胶原蛋白的作用)注入到大鼠苍白球诱导脑出血模型。确定苍白球位置为前囟后1.4 mm,中线向右旁3.2 mm,深度为5.6 mm。脑出血组及依达拉奉治疗组向苍白球缓慢注入2 μL含0.4 IUⅦ型胶原酶的生理盐水,假手术组注入2 μL灭菌生理盐水,4 min注射完毕,留针5 min后缓慢将针退出,骨蜡封闭颅骨钻孔,缝合皮肤。正常对照组不作任何处理。
2.3 给药方法
依达拉奉治疗组于脑出血后2 h腹腔内注射依达拉奉3 mg·kg-1(取量依据:根据依达拉奉使用说明书及文献报道确定[6]),每天1次,用药到实验结束。假手术组和脑出血组给与等量生理盐水。
2.4 组织切片制备
在设定时间点麻醉大鼠,以生理盐水和4%多聚甲醛灌注固定后断头取脑,以血肿为中心按冠状位切取血肿周围2 mm的脑组织,置于上述灌注液中固定24 h以上。常规石蜡包埋脑组织,分别做5 μm连续切片备用。
2.5 细胞凋亡检测
采用TUNEL法。具体操作步骤按试剂盒说明书进行。阳性标准:光镜下细胞核呈棕黄色者为TUNEL阳性细胞。
2.6 P38MAPK蛋白检测
采用免疫组化SP法,具体操作步骤按试剂盒说明书进行。阳性标准:光镜下P38MAPK蛋白以细胞胞质呈棕黄色着色为阳性细胞。
2.7 图像分析
高倍镜下随机观察脑出血血肿周围脑组织不重叠的6个视野,采用高清晰度彩色病理图像分析系统计数TUNEL检测阳性细胞个数和P38MAPK免疫反应阳性细胞数,取其平均值为阳性细胞数。
2.8 统计学处理
所得数据均以均数±标准差表示,以Excel数据库整理后用SPSS11.0统计软件包进行统计分析,2组间同一时间点的比较采用成组设计的t检验,同一组内不同时间点的比较采用方差分析,两指标间相关性用简单相关及直线回归分析,以P<0.05为差异在统计学上有显著性意义。
3 结果
3.1 细胞凋亡检测结果
正常对照组未见凋亡阳性细胞,假手术组术后48 h仅于针道周围偶见凋亡阳性细胞,因数量极少故未进行统计学检验。脑出血组和依达拉奉治疗组不同时间点细胞凋亡数结果见表1。
表1 各时间点2组大鼠血肿周围组织细胞凋亡数比较(个,,n=6)Tab1 Comparison of amount of apoptotic cells in perihematoma region of rats between two groups at different time points(piece,,n=6)

表1 各时间点2组大鼠血肿周围组织细胞凋亡数比较(个,,n=6)Tab1 Comparison of amount of apoptotic cells in perihematoma region of rats between two groups at different time points(piece,,n=6)
注:方差分析,脑出血组F=486.928,P<0.01;依达拉奉治疗组F=312.908,P<0.01;同组内各个时间点与前一时间点比较:△P<0.01;依达拉奉治疗组与同时间点脑出血组比较:▲P<0.01note:variance analysis:in ICH group F=486.928,P<0.01;in edaravone treatment group F=312.908,P<0.01;the former time point vs.the later time point in the same group:△P<0.01;edaravone treatment group vs.ICH group at the same time point:▲P<0.01
由表1可见,脑出血组大鼠脑出血3 h后脑出血灶周已出现凋亡阳性细胞,出血后6 h开始明显增加,于出血后2~3 d达到高峰,到出血后3 d凋亡阳性细胞的数量开始下降。依达拉奉治疗组大鼠脑出血后3 h也可见凋亡阳性细胞,并随脑出血时间延长凋亡阳性细胞逐渐增加,于脑出血后2~3 d达到高峰,3 d后开始下降。与脑出血组相比,依达拉奉治疗组凋亡阳性细胞于脑出血后3 h未见明显降低(P>0.05),于脑出血后6 h、12 h、1 d、2 d、3 d、5 d、7 d 数量均有降低,且差异具有统计学意义(P<0.01)。
3.2 P38MAPK蛋白检测结果
正常对照组及假手术组均可见少量P38MAPK蛋白表达。脑出血组和依达拉奉治疗组不同时间点P38MAPK阳性细胞数比较结果见表2。
由表2可见,大鼠脑出血后3 h出血肿周围区P38MAPK蛋白阳性细胞开始增加,其分布区域与凋亡细胞相同,包括胶质细胞、神经元及部分血管内皮细胞。随脑出血时间延长,P38MAPK阳性细胞数量逐渐增加,脑出血后6 h开始明显增加,于脑出血后12 h~1 d达高峰,之后开始逐渐下降。依达拉奉治疗组大鼠脑出血后3 h也可见P38MAPK阳性细胞开始增加,并随出血时间延长P38MAPK阳性细胞逐渐增多,于出血后12 h~1 d达到高峰,之后开始逐渐下降。与脑出血组相比,依达拉奉治疗组P38MAPK阳性细胞于出血后3 h未见明显降低(P>0.05),于脑出血后6 h、12 h、1 d、2 d、3 d、5 d、7 d数量均有降低,且差别有统计学意义(P<0.05,P<0.01)。
表2 各时间点2组大鼠血肿周围组织P38MAPK阳性细胞数比较(个,,n=6)Tab 2 Comparison of amount of P38MAPK positive cells in perihematoma region of rats between two groups at different time points(piece,,n=6)
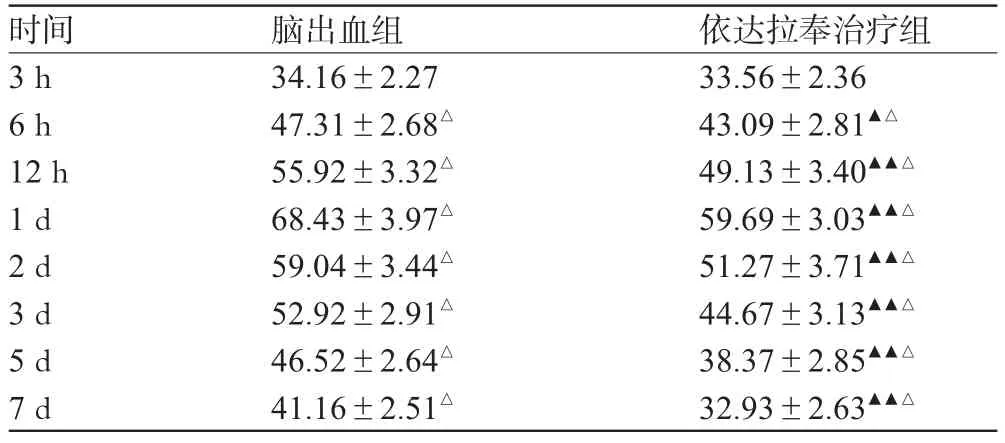
表2 各时间点2组大鼠血肿周围组织P38MAPK阳性细胞数比较(个,,n=6)Tab 2 Comparison of amount of P38MAPK positive cells in perihematoma region of rats between two groups at different time points(piece,,n=6)
注:方差分析,脑出血组F=367.194,P<0.01;依达拉奉治疗组F=246.744,P<0.01;同组内各个时间点与前一时间点比较:△P<0.01;依达拉奉治疗组与同时间点脑出血组比较:▲P<0.05,▲▲P<0.01note:variance analysis:in ICH group F=367.194,P<0.01;in edaravone treatment group F=246.744,P<0.01;the former time point vs.the later time point in the same group:△P<0.01;edaravone treatment group vs.ICH group at the same time point:▲P<0.05,▲▲P<0.01
时间3 h 6 h 12 h 1 d 2 d 3 d 5 d 7 d依达拉奉治疗组33.56±2.3643.09±2.81▲△49.13±3.40▲▲△59.69±3.03▲▲△51.27±3.71▲▲△44.67±3.13▲▲△38.37±2.85▲▲△32.93±2.63▲▲△脑出血组34.16±2.2747.31±2.68△55.92±3.32△68.43±3.97△59.04±3.44△52.92±2.91△46.52±2.64△41.16±2.51△
4 讨论
依达拉奉是目前临床试验证明唯一有效的自由基清除剂[7]。其化学结构为3-甲基-1-苯基-2-吡唑啉-5-酮,相对分子量为174.20,是一种具有亲脂性基团的化合物,在体内以阴离子形式存在,并可转移1个电子给自由基而产生依达拉奉基团,阻断脂质过氧化反应链,进而保护神经细胞[8]。笔者的研究结果显示,脑出血后血肿周围组织存在细胞凋亡;与脑出血组相比,依达拉奉治疗组于脑出血后6 h、12 h、1 d、2 d、3 d、5 d及7 d血肿周围组织细胞凋亡表达均减少。表明依达拉奉可抑制脑出血后血肿周围组织的细胞凋亡,对出血后脑组织起到神经保护作用。
研究[9]发现,P38MAPK信号通路参与了细胞的生长发育及细胞间功能同步等多种生理过程,并与炎症、应激反应的调控密切相关。笔者在本实验中观察到,大鼠脑出血后3 h即可见P38MAPK蛋白的表达,表达高峰出现在脑出血后1 d,于2 d后开始下降,而正常对照组和假手术组P38MAPK蛋白均为低表达。与脑出血组相比,依达拉奉治疗组p38MAPK阳性细胞于出血后6 h、12 h、1 d、2 d、3 d、5 d及7 d数量均有降低。说明依达拉奉治疗组与脑出血组之间在P38MAPK蛋白的表达上存在明显的变化差异,依达拉奉降低了P38MAPK蛋白的表达,说明依达拉奉能抑制P38MAPK蛋白的表达。
笔者还发现,P38MAPK阳性细胞主要分布于脑出血血肿周围受损伤的胶质细胞及神经元,与凋亡细胞分布区域一致,且依达拉奉能抑制P38MAPK蛋白的表达与抑制脑出血后血肿周围组织的细胞凋亡的表达结果是一致的。因此,本研究结果表明,依达拉奉抑制细胞凋亡可能通过下调促凋亡相关P38MAPK蛋白的表达而实现的,但其具体机制还有待于进一步探讨。
[1]张 云,刘 斌.脑出血后继发性脑损伤的细胞凋亡机制研究进展[J].中国康复医学杂志,2007,22(12):1130.
[2]Ferrer I,Friguls B,Dalfo E,et al.Early modification in the expression of mitogen-activated protein kinases(MAPKERK),stress-activeted kinases SAPKJNK and p38,and their phosphorylated substrates following focal cerebral ischemia[J].Acta Neuropathol(Berl),2003,105(5):425.
[3]Hans J S,Michael J W.Mitogen-activated protein kinases:specific messages from ubiguitious messsngers[J].Mol Cell Biol,1999,19(4):2435.
[4]Deinsberger W,Vogel J,Kuschinsky W,et al.Experimental intracerebral hemorrhage:description of a double injection model in rats[J].Neurol Res,1996,18(5):475.
[5]包新民,舒斯云.大鼠立体定位图谱[M].北京:人民卫生出版社,1991:35~36.
[6]Watanabe K,Hayase T.Radical scavenging mechanisms of MCI-186[J].Jpn Pharmacol Ther,1997,25(2):189.
[7]王拥军.脑卒中神经保护剂治疗的研究进展[J].中国医疗前沿,2007,2(3):85.
[8]Masahiro B,Tetsuya M,Hideki K,et al.The radical scavenger edaravone prevents oxidative neurotoxicity induced by peroxynitrite and activated microglia[J].Neuropharm,2005,4(3):283.
[9]Ma XL,Kumars,Gao F,et al.Inhibition of p38 mitogenactivated protein kinase decrease cardiomyocyte apoptosis and impresses cardiac function after myocardial ischemia and reperfusion[J].Circulation,1999,99(13):1685.
