巯甲丙脯酸生物黏附型缓释胶囊大鼠体内药动学研究Δ
2010-05-22宋益民范鸣浩张丽张学成青岛科技大学制药工程系青岛市6604中国海洋大学生命学院青岛市66003
宋益民,范鸣浩,张丽,张学成(.青岛科技大学制药工程系,青岛市 6604;.中国海洋大学生命学院,青岛市 66003)
目前临床常用的治疗高血压和充血性心力衰竭的第1代血管紧张素Ⅰ转化酶抑制剂是水溶性的巯甲丙脯酸(Captopril,Cap)的糖衣片或普通片[1,2],由于Cap生物半衰期仅为1.9 h,需要日服3~4次,当其摄入总量达到37.5~75.0 mg时作用仅可维持6~8 h[3];若单剂量口服50 mg,峰浓度可达600 μg·L-1以上[4],而其治疗浓度为50 μg·L-1。由于存在如此显著的峰-谷差异,使得Cap普通制剂使用后易引起眩晕、头疼、胃肠道紊乱等不良反应。此外,该药在胃内偏酸的环境中稳定而在肠道内偏碱的环境中易分解,且胃及小肠上部为其主要吸收部位[5,6]。考虑到胃肠道生物黏附型制剂(Gastrointestinal bioadhesion drug delivery system,GBDDS)具有延长药物在消化道释放时间,在胃及小肠上部定位释放药物,从而改善药物吸收,提高药物的生物利用度的特性,笔者以壳聚糖、明胶为载体材料,羟乙基甲基纤维素为生物黏附材料,制备了Cap生物黏附型缓释胶囊(Captopril bioadhesion sustained release capsules,CBSRCs)。研究结果表明,CBSRCs与Cap普通片相比具有良好的胃肠道黏附特性和明显延缓Cap释放作用[7]。在本文中,笔者进行了CBSRCs与市售Cap普通片在大鼠体内的药动学行为的比较,以期为CBSRCs的临床应用提供实验依据和理论基础。
1 材料
1.1 试药
Cap生物黏附型缓释胶囊(青岛科技大学制药工程系制备,规格:每粒30 mg);Cap对照品(潍坊制药有限公司,纯度:99.5%);Cap普通片(Captopril ordinary tablet,COT,青岛国风集团黄海制药有限责任公司,批号:020318,规格:每片25 mg);对溴苯乙酰基溴(p-Bromophenacyl bromide,p-BPB,美国Sigma公司,纯度:99%);硫代水杨酸(Thiosalicyclic acid,TA,瑞士Fluka公司,纯度:98%);内标:对溴苯乙酸邻羧基苯硫酸酯(TA-p-BPB,青岛科技大学制药工程系制备,纯度98.5%);乙腈为色谱级;乙二胺四乙酸(Ethylene diamine tetraacetic acid,EDTA)等均为分析纯。
1.2 动物
Wistar大鼠30只,♀♂各半,体质量(250±20)g,由青岛市立医院实验动物中心提供(鲁动质字20040627)。
1.3 仪器
LC-10Avp高效液相色谱(HPLC)系统,包括LC-6Ad高效输液泵、SPD-10Avp紫外检测器、SILvp-10ADvp全自动进样器、CTO-10Avp柱温箱、DGU-14A脱气机、SCL-10Avp系统控制器、CLASS_VP5.01色谱工作站(日本岛津公司);WH-3型旋涡混合器(上海沪西分析仪器厂)。
2 方法与结果
2.1 色谱条件
色谱柱:Waters Symmetry C18(150 mm×4.4 mm,5 μm);流动相:乙腈-水-冰乙酸(45∶55∶0.2,V/V/V);流速:1 mL·min-1;柱温:20 ℃ ;检测波长:258 nm,灵敏度:[Auxiliary:2;Range:1;Response:4];进样量:10 μL。
2.2 内标的制备
按文献[8]方法并经改良,精密称取TA 0.44 g,p-BPB 0.95 g,加入60 mL甲醇溶解,1 mol·L-1NaOH调节pH 至7.0,于72℃水浴回流1 h,蒸发至10 mL,磷酸盐缓冲液(pH 7.0,60 mL)溶解,乙醚(60 mL)洗涤2次,水层加入1 mol·L-1HCl(8 mL),调节pH 至2.0,再用乙醚(60 mL)萃取2次,有机层合并,氮气吹干,得透明油状物即内标TA-p-BPB。
2.3 给药及血样采集
采用2组制剂单周期试验设计方法。30只Wistar大鼠随机分为2组,第1组先灌胃CBSRCs 0.1 g·kg-1(含Cap 5 mg·kg-1),第2组灌胃COT 0.02 g·kg-1(含Cap 5 mg·kg-1)。实验前禁食12 h,灌胃给予CBSRCs或COT 2 h后投食,不限饮水,分别于给药前和给药后0.25、0.50、1.0、1.50、2.0、3.0、4.0、6.0、8.0、12、16 h于眼眶后静脉丛各采血约0.5 mL,肝素抗凝(125 IU,pH 7.0),加入0.1 mol·L-1抗坏血酸和0.1 mol·L-1EDTA各10 μL,以3000 r·min-1离心10 min,分离血浆。
2.4 血浆样品的处理与测定
取血浆0.2 mL 加入 p-BPB(1 mg·mL-1)4 μL漩涡混合后,避光室温放置30 min后,加入内标TA-p-BPB(1.6 mg·mL-1)溶液20 μL,震荡30 s,室温放置30 min,置于-24 ℃冷冻保存,待测。
取衍生化反应完成后的血浆,分别加入1 mol·L-1HCl溶液40 μL及乙酸乙酯0.6 mL震荡2 min,离心10 min,分离出上层,加入0.1 mL稀碳酸钠水溶液(饱和碳酸钠与水的比例为1∶25,V/V),震荡2 min,离心10 min,弃去上层,加入1 mol·L-1HCl溶液0.4 mL,乙酸乙酯0.6 mL,再震荡2 min,离心10 min,分离出上层,于40℃水浴中氮气吹干,残留物用50 μL流动相溶解后进样。
2.5 稳定性考察
Cap在血浆中不稳定,4℃下处理后的血浆样品放置40 min后血浆中Cap含量即明显下降,因此采集的血样应立即离心分离出血浆,并加入衍生化试剂。解冻循环以及血浆样品-20℃冷冻放置试验显示,血浆中衍生物在-20℃条件下,放置2 d内稳定,所以采血后应保存在-20℃条件,并应在2 d内测定。
2.6 HPLC方法验证
2.6.1 血浆中Cap标准曲线的制备。取空白血浆0.2 mL,分别加入Cap 对照品,使其浓度分别为12.5、25、50、100、200、400、800 μg·L-1,然后加入4 μL p-BPB(1 mg·mL-1),按“2.4”项所述方法操作,每一浓度进行5样本分析,进样10 μL,记录色谱,以样品峰面积(As)与内标峰面积(Ai)的比值(Y)与Cap浓度(X)进行直线回归,求得方程 Y=0.0065X-0.0382(r=0.9987,n=5)。根据标准曲线,确定Cap血浆浓度测定的线性范围为12.5~800 μg·L-1,最低检测限为12.5 μg·L-1。
2.6.2 回收率和精密度试验。取空白血浆3份分别加入Cap对照品,制备Cap 血浆使之浓度分别为 25、400 、800 μg·L-1,按“2.6.1”项下操作进样测定,计算回收率结果见表1。
表1 回收率试验结果(,n=5)Tab 1 Results of recovery test(,n=5)

表1 回收率试验结果(,n=5)Tab 1 Results of recovery test(,n=5)
相对回收率/%101.68±2.5298.30±2.0498.21±2.01浓度/μg·L-1 25400800测定值/μg·L-1 25.42±0.63393.2±8.17785.68±16.08
结果,平均回收率为99.40%。
在同日内于不同时间按“2.6.1”项下操作进样测定各7次,计算日内RSD;连续7d在同一时间测定每份样品,计算日间RSD,结果见表2。
表2 精密度试验结果(,n=7)Tab 2 Results of precision test(,n=7)
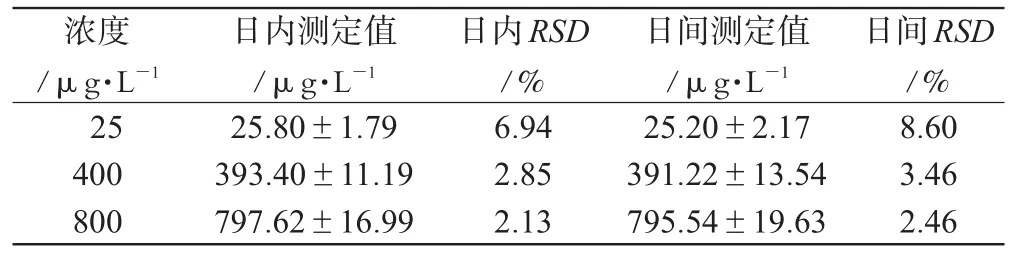
表2 精密度试验结果(,n=7)Tab 2 Results of precision test(,n=7)
日间RSD/%8.603.462.46浓度/μg·L-1 25400800日内测定值/μg·L-1 25.80±1.79393.40±11.19797.62±16.99日内RSD/%6.942.852.13日间测定值/μg·L-1 25.20±2.17391.22±13.54795.54±19.63
2.6.3 干扰试验。取大鼠空白血浆、空白血浆+Cap+内标和给予CBSRCs后血浆样品+内标进样分析,色谱结果见图1。
由图1可见,在选定的色谱条件下,Cap衍生物和内标分离效果良好,表明血浆中的内源物质对药物测定无干扰。内标衍生物的保留时间为(5.88±0.43)min,Cap衍生物的保留时间为(3.67±0.05)min,且样品峰与杂质峰的分离度大于1.5。
2.7 数据处理
所获得实验数据用DAS2.0药动学软件进行房室模型拟合,比较各房室模型的AIC值,按AIC最小值标准选择最佳房室模型,计算出相应的药动学参数,Cmax、tmax采用实测值,以非室模型统计矩计算AUC0~t、AUC0~∞、MRT,用配对比较t检验比较2种制剂的药动学参数。

图1 高效液相色谱图A.空白血浆;B.空白血浆+Cap+内标;C.给予CBSRCs后血浆样品;1.Cap衍生物;2.内标衍生物Fig 1 HPLC chromatogramA.blank plasma;B.blank plasma+Cap+internal standard;C.plasma sample after rats given CBSRCs+internal standard;1.Cap derivate;2.internal standard derivate
2.8 药动学结果
大鼠单剂量口服2种制剂后的血药浓度-时间曲线详见图2;各数据经DAS2.0程序处理,符合二室模型,主要药动学参数详见表3。
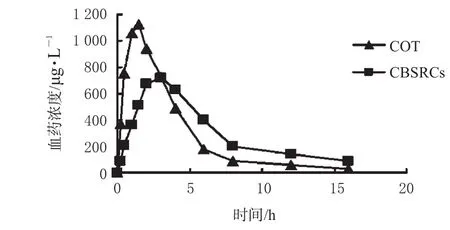
图2 2种制剂给药后血药浓度-时间变化情况Fig 2 Plasma concentration-time curve of two preparations
表3 2种制剂给药后药动学参数结果(,n=15)Tab 3 The pharmacokinetic parameters of two preparations after medication(,n=15)

表3 2种制剂给药后药动学参数结果(,n=15)Tab 3 The pharmacokinetic parameters of two preparations after medication(,n=15)
由表3可见,CBSRCs与COT 相比,t1/2β、AUC0~t、AUC0~∞、CL、Vd、tmax、Cmax差异具有显著性(P<0.05或P<0.01)。
参数CBSRCsCOT t1/2α/h1.88±0.381.15±0.21 t1/2β/h3.76±0.752.87±0.59 tmax/h3.12±0.671.53±0.27 Cmax/μg·L-1722.97±133.681114.47±208.36 CL/L·h-12.87±0.513.43±0.67 Ka0.53±0.091.99±0.37 Vd/L10.98±1.9013.21±2.57 AUC0~t/μg·h·L-14856.03±835.464616.29±915.49 AUC0~∞/μg·h·L-15218.39±1037.584705.83±894.56 MRT0~t/h5.53±1.033.71±0.66 MRT0~∞/h6.63±1.214.02±0.76
3 讨论
本文建立了HPLC-紫外检测器法作为口服CBSRCs后检测大鼠血液中Cap浓度的方法。由于Cap的化学结构中缺乏对紫外和可见光具特征吸收的基团,其本身的紫外吸收很弱,因此不能用HPLC-紫外检测器直接检测。而采用柱前衍生化使Cap与p-BPB生成具有较强紫外吸收的Cap-p-BPB后,可以明显提高测定Cap的灵敏度。经验证,该法具有良好的灵敏度和准确性,完全符合药动学研究的要求,并与文献[9]报道相一致。
本文采用随机分组单剂量给药的方案,测定了大鼠口服自制的CBSRCs和市售COT后的血药浓度,并计算了t1/2α、t1/2β、tmax、Cmax、CL、Vd、AUC0~t、AUC0~∞、MRT0~t、MRT0~∞等主要药动学参数。结果表明,CBSRCs与市售COT在大鼠体内的药动学特征差异具有显著性,CBSRCs的t1/2β、AUC0~t、AUC0~∞值明显高于COT,CL、Vd均显著低于COT,这与CBSRCs缓慢释放药物的性质有关,因而口服CBSRCs后在体内可维持较长时间有效血药浓度。CBSRCs达峰时间滞后于COT近2 h,峰浓度仅为COT的64.79%;CBSRCs的Ka值显著小于COT,体内MRT0~t、MRT0~∞显著延长,说明CBSRCs明显延长了制剂在大鼠体内的存在过程,具有较好的滞留和缓释作用。
与市售COT相比,大鼠口服CBSRCs后,显著改善了Cap原药的药动学性质,具有缓释和长效的作用。
[1]王希柱,宋月霞,张丽娜.贝那普利对高血压病患者血浆同型半胱氨酸水平和血管内皮功能的影响[J].中国药房,2006,17(17):1327.
[2]Ferrario CM,Richmond RS,Smith R,et al.Reninangiotensin system as a therapeutic target in managing atherosclerosis[J].Am J Ther,2004 ,11(1):44.
[3]Romankiewjcz JA,Brogden RN,Heel RC,et al.Captopril:an update review of its pharmacological properties and therapeutic efficacy in congestive heart failure[J].Drugs,1983,25(1):6.
[4]Tian WR,Gao Z,Wang SX.Pharmacokinetics of captopril in healthy volunteers[J].Chin J Hosp Pharm,1993,13(2):55.
[5]Seta Y,Higuchi F,Kawahara Y,et al.Design and preparation of captopril sustained-release dosage forms and their biopharmaceutical properties[J].Int J Pharm,1988,41(3):245.
[6]Anaizi NH,Swenson C.Instability of aqueous captopril solutions[J].Am J Hosp Pharm,1993,50(3):486.
[7]Song YM,Chen XG,Tang XX,et al.Preparation and evaluation in vitro for captopril/bioadhesive sustained-release capsules[J].J Ocean Univ China,2006,36(3):415.
[8]Kawahara Y,Hisaoka M,Yamazaki Y,et al.Determination of captopril in blood and urine by high-performance liquid chromatography[J].Chem Pharm Bull,1981,29(1):150.
[9]Jankowski A,Skorek A,K,et al.Captopril:determination in blood and pharmacokinetics after single oral dose[J].J Pharm Biomed Anal,1995,13(4~5):655.
