高蛋白饮食对犬体内司帕沙星药动学的影响
2010-05-22康纪平何海霞李秋波冯晓科四川省养麝研究所都江堰市6830重庆医科大学附属第一医院临床药理研究室重庆市40006
康纪平,何海霞,李秋波,冯晓科(.四川省养麝研究所,都江堰市 6830;2.重庆医科大学附属第一医院临床药理研究室,重庆市 40006)
司帕沙星(Sparfloxacin,SPFX)是第3代氟喹诺酮类广谱抗菌药,已在临床广泛应用,其具有口服吸收良好、组织分布广、血浆蛋白结合率低、消除t1/2长等药动学特点。文献[1]报道,进食几乎不影响其吸收,但高蛋白饮食是否对其吸收等有影响未见文献报道,为此,本研究将探讨高蛋白饮食是否影响SPFX在Beagle犬体内的药动学参数,以为该药的合理用药提供参考。
1 材料与方法
1.1 试药
SPFX片(河南帅克制药有限公司,批号:20081201,规格:每片0.1 g);SPFX对照品(重庆芸峰药业有限公司,批号:030612,纯度:99.1%;使用时精确称取SPFX 20 mg,置于50 mL容量瓶中,用适量甲醇溶解,加甲醇至刻度,即为400 μg·mL-1的SPFX标准贮备液,备用;再用双蒸水稀释为400 ng·mL-1的工作浓度备用);内标诺氟沙星(NF,山西博达制药有限公司,纯度:99.0%。使用时精密称取NF对照品10 mg,置于50 mL容量瓶中,用适量双蒸水溶解,加双蒸水至刻度,混匀,即为200 μg·mL-1的NF标准贮备液;再用双蒸水稀释为20 μg·mL-1的工作浓度);乙腈为色谱纯,其它试剂均为分析纯;高蛋白饮食为雀巢奶粉。
1.2 动物
健康合格Beagle犬8只,♀♂各半,体质量10 kg左右,由四川养麝研究所提供。实验动物合格证为:川实动管质第63号,环境设施合格证号为:川实动管第64号。
1.3 仪器
1100系列高效液相色谱(HPLC)仪,包括1100泵系统、可调波长紫外检测器和1100工作站(美国Agilent公司)。
1.4 分组及给药
选取犬8只,♀♂各半,随机分为SPFX空腹组和合用高蛋白饮食组,即分别为空腹组与高蛋白饮食组,每组4只。犬于实验前禁食12 h,实验开始时,高蛋白饮食组供给牛奶每只200 g,同时给予SPFX 10 mg·kg-1[2];空腹组仅给予SPFX 10 mg·kg-1和水(每只200 mL),然后送回笼中,8 h后统一进食。各组于给药后1、2、3、4、5、6、8、12、24、48 h经大隐静脉采血3 mL,分离血浆,-20℃保存,待测。2周后2组交叉实验,取血样时间等均同前。
1.5 血药浓度测定
1.5.1 色谱条件。色谱柱:Hypersil C18(200 mm×5.0 mm,5 μm);固定进样环:100 µL;流动相:甲醇-0.008 mol·L-1磷酸盐缓冲液-0.5 mol·L-1四丁基溴化铵=25∶75∶4;流速:1.0 mL·min-1;紫外检测波长:292 nm;柱温:室温;内标:NF。
1.5.2 样品处理。参照文献[2],取1.0 mL犬血浆样品,加入NF 0.1 mL(20 µg·mL-1)、0.05 mol·L-1NaOH 0.1 mL 和 4 mL CHCl2,旋摇1 min,3000 r·min-1离心2 min,去有机层,置于40℃水浴中,氮气吹干。取0.1 mL流动相复溶,进样50µL。
1.5.3 方法学研究。(1)色谱行为:在本实验所采用的色谱条件下,取SPFX+NF对照品溶液、空白血浆、空白血浆+SPFX+NF、犬服药后2 h血浆+NF进样分析,色谱见图1。
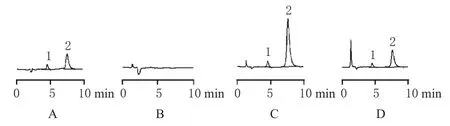
图1 高效液相色谱图A.SPFX+NF对照品;B.空白血浆;C.空白血浆+SPFX+NF;D.犬服药后2 h血浆+NF;1.NF;2.SPFXFig 1 HPLC chromatographyA.SPFX+NF control;B.blank plasma;C.blank plasma+SPFX+NF;D.plasma 2 h after administration+NF;1.NF;2.SPFX
由图1可见,血浆中SPFX的tR为7.6 min左右,内标NF的tR为4.5 min左右。SPFX和NF峰形良好,且不受血浆内源性物质的干扰。
(2)标准曲线、线性关系与最低定量浓度:在空白血浆中分别添加SPFX使血药浓度相当于4.0000、2.0000、1.0000、0.5000、0.2500、0.1250、0.0625、0.03125 µg·mL-1,按“样品处理”项下操作,将所得数据SPFX峰面积/NF峰面积比Y与SPFX浓度X进行回归,得标准曲线方程为Y=3.5307X-0.1346(r=0.9994,n=5)。结果,SPFX检测浓度线性范围为0.03125~4.0000 µg·mL-1,最低定量浓度为0.03125 µg·mL-1(RSD=15.66%,n=5)。
(3)精密度和重复性:取高、中、低3种质控样本(4.0000、0.5000、0.0625 µg·mL-1),每个浓度5份,考察批内和批间变异。批内误差(每个浓度同日内测定5次)、日内变异性结果及批间误差(每个浓度连续测5 d,每天测1次)、日间变异性结果见表1。
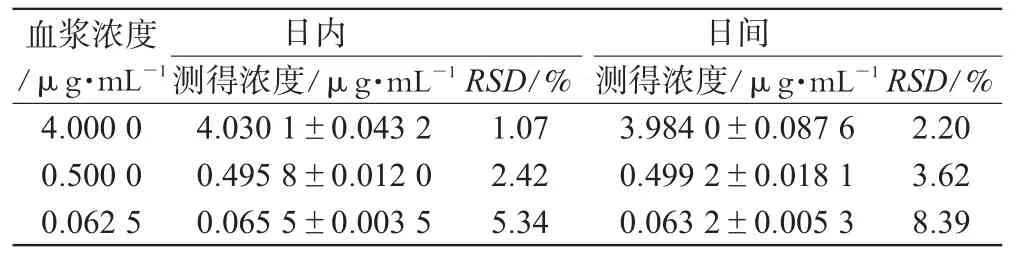
表1 精密度及重复性试验结果(n=5)Tab 1 Results of precision and repeatability(n=5)
(4)回收率:取高、中、低3种质控样本(4.0000、0.5000、0.0625 µg·mL-1),每个浓度5份,按规定方法评价本法的回收率。结果高、中、低浓度的回收率分别为(101.11±5.43)%、(99.34±3.58)%、(105.28±5.35)%。
(5)冻融稳定性考察:将含药血浆反复冷冻(-20℃)、融化,按“样品处理”项下方法处理及测定,5周内测定5次。结果表明,血浆样品在5周内经反复冻融,稳定性良好,RSD=6.15%。
1.6 数据处理
采用中国药理数理学会编制的3p97计算机软件,计算各个体的药动学参数。数据以表示,组间行t检验。
2 结果
2.1 药-时曲线
空腹组与高蛋白饮食组SPFX的平均血药浓度-时间曲线见图2。
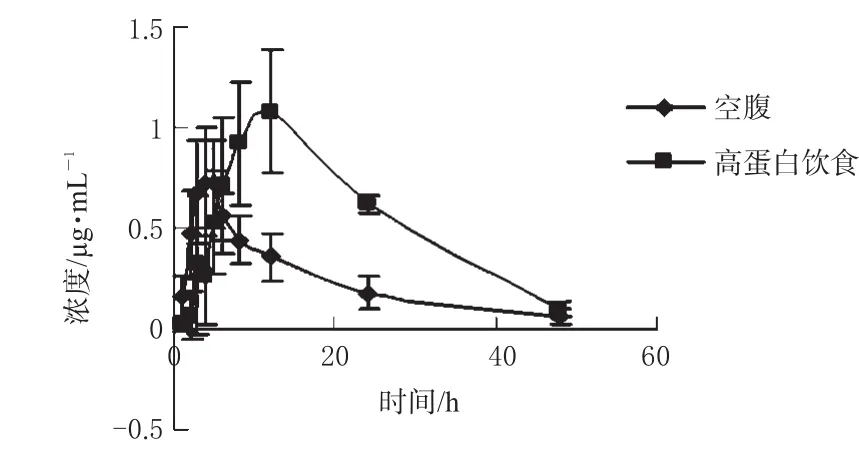
图2 2组平均血药浓度-时间曲线Fig 2 Mean plasma concentration-time curve of 2 groups
2.2 药动学参数
受试犬血药浓度-时间数据采用计算机3p97程序自动拟合,空腹组与高蛋白饮食组的口服吸收过程分别符合二室、一室模型。求得有关药动学参数见表2。
表2 2组药动学参数比较(,n=8)Tab 2 Comparison of pharmacokinetic parameters between 2 groups(,n=8)
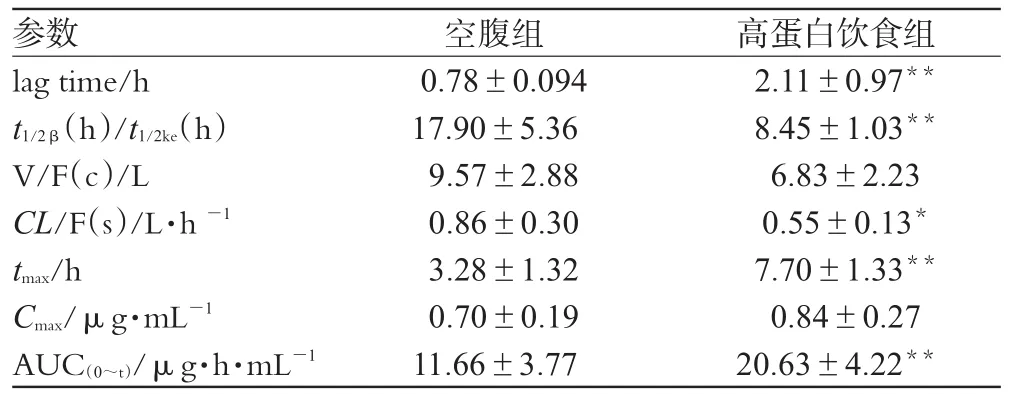
表2 2组药动学参数比较(,n=8)Tab 2 Comparison of pharmacokinetic parameters between 2 groups(,n=8)
与空腹组比较:*P<0.05,**P<0.01vs.fasting group:*P<0.05,**P<0.01
由表2可见,高蛋白饮食组与空腹组比较,lag time、tmax延长(P<0.01),t1/2β/t1/2ke降低,Cmax无显著性差异,AUC(0~t)增加。
3 讨论
目前对SPFX的血药浓度检测几乎均选HPLC法测定,但测定条件如流动相等各有不同。在本研究中,笔者选用甲醇和磷酸盐缓冲液,同时加入四丁基溴化铵作为流动相,结果表明检测结果较好、方法简单、重现性好、保留时间恰当。原因是SPFX结构中同时具有芳胺和芳酸结构,整体呈现酸性,如果采用三乙胺和磷酸盐组成缓冲液与甲醇混合可致SPFX的保留时间过短,不能使药物与有关杂质峰充分分离,而加入离子对四丁基溴化铵可使SPFX保留时间延长1倍以上,保证药物与杂质充分分离。
文献[1]报道,进食对SPFX的吸收几乎无影响。本研究结果表明,合用高蛋白饮食后,与空腹相比较lag time延长,导致吸收滞后,故tmax也延长。虽然高蛋白饮食可推迟药物的tmax,并可加速药物自体内的排出,提高了AUC(0~t)值,但Cmax间比较无显著性差异。
总的来说,高蛋白饮食可延缓SPFX的吸收速度,但可增加吸收量,加快其排出速度,可明显影响司帕沙星药动学。该作用是否因高蛋白与SPFX间形成一定的复合物而减慢吸收,促进其排泄引起,尚待进一步研究。
[1]杜黎明,卫洪清,郜 艳,等.反相高效液相色谱法测定人尿中的司帕沙星[J].分析化学,2001,29(9):1108.
[2]张 斌,汪华蓉,康纪平,等.脂质饮食对加替沙星药动学的影响[J].中国药房,2008,19(25):1952.
