移植肾的磁共振检查
2010-05-17陆媛媛何之彦
陆媛媛何之彦
慢性肾功能衰竭患者每年以百万人口约100人的发病率在递增,而同种肾移植可以降低费用、提高生活质量是治疗终末期慢性肾功能衰竭最为理想的方法。因此研究和评估移植肾术前和术后的影像学检查显得尤为重要。自MRI应用以来,以其分辨率高、多方位、多参数成像及无创伤性,可重复检查,较CT优越的软组织对比,可更好地显示肾脏的解剖等特点表现出其优势。功能性MRI是近l0余年来在常规磁共振成像基础上迅速发展起来的一种新的成像技术,以反映器官功能状态为成像目的[1],随着这种新技术的应用,使MRI的成像领域已从原来的观察大体形态改变向组织的病理、生理甚至分子水平方向拓展。本文汇集近年来MRI在移植肾的应用进展及我们的研究成果。
常规磁共振成像检查
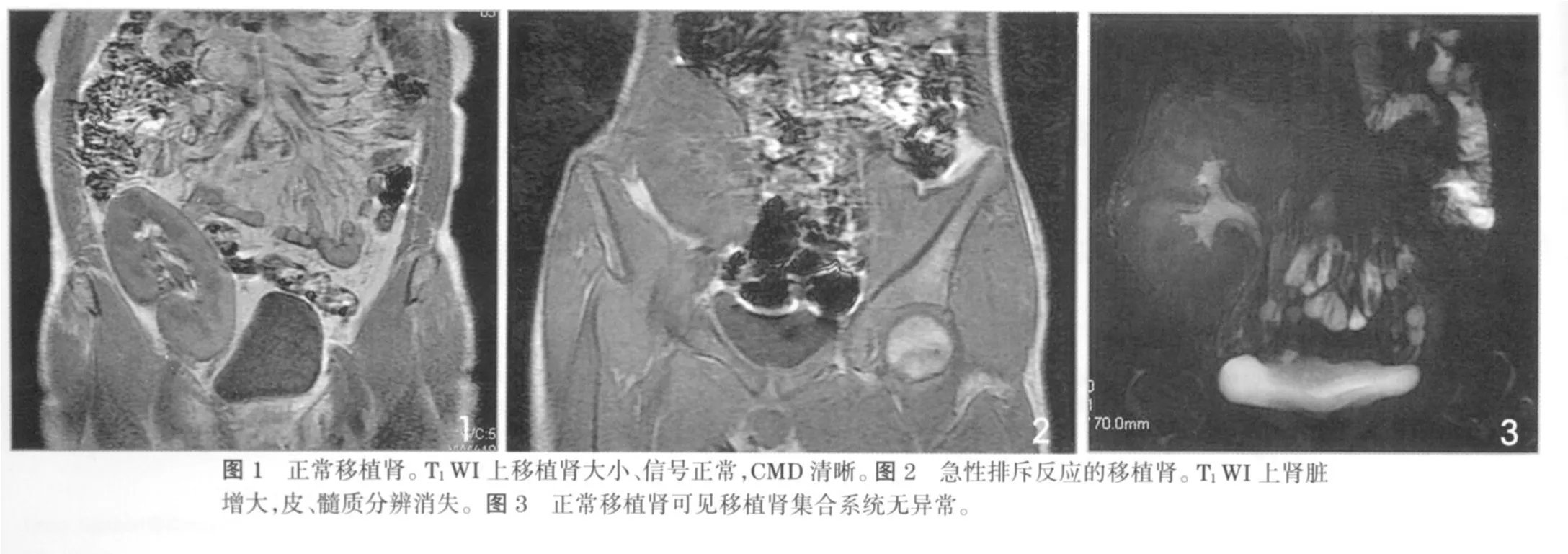
由于移植肾位于盆腔内,受呼吸运动的影响较小,因而更适合MRI检查。MRI可以清晰显示移植肾在盆腔的位置、形态及周围组织的情况。移植肾成活并且功能良好者,MRI表现为大小、形态、结构、信号均在正常范围内。T1WI上功能正常的肾脏因为髓质较皮质含有较多的自由水,因而髓质信号低于皮质,其信号差异形成良好的皮、髓质分辨 (corticomedullary differentiation,CMD),这是MRI在显示肾脏结构优于CT之所在(图1)。在T2WI上肾实质呈高信号,但不能区分肾皮、髓质。移植肾CMD不清是由于皮质水含量增加引起的信号相对减低所致,不具有特异性,但说明有肾功能异常存在,提示有排斥反应,重度积水和动脉狭窄可能,鉴别需结合临床。研究发现急性排斥反应表现为移植肾增大,CMD显示不清及肾实质内血管异常(图2)。慢性排斥反应也表现为移植肾CMD消失,肾实质内信号不均,肾包膜可增厚。而环孢霉素中毒在MRI上则表现不同,一般情况下移植肾大小信号正常,CMD清晰,然而移植肾增大并且CMD不清甚至消失也有报道。目前常规磁共振检查仍是肾移植临床应用最常见的磁共振检查方法,是其他检查方法的基础。
磁共振尿路成像
磁共振尿路成像(magnetic resonance urograpy,MRU)是Hennig等[2]在1986年提出,通过重 T2加权图像突出显示泌尿集合系统内液体(即尿液),同时抑制周围软组织的信号,在不使用对比剂的情况下显示尿路情况。它是一种安全无创的影像学方法,操作简便,扫描时间短,非常适合移植肾术后的检查,主要用于术后输尿管梗阻的显示。移植肾输尿管狭窄梗阻是肾移植术后常见的外科并发症之一,影响移植肾长期存活。M RU对于梗阻性病变的定位效果好,可以清楚显示肾盂、输尿管、膀胱及狭窄梗阻的部位、狭窄的程度以及梗阻点以上尿路扩张情况。另外,由于M RU主要是利用静态液体具有长T2弛豫时间,在重T2加权图像上呈高信号的原理成像,故对移植肾术后近期是否有尿漏及囊状淋巴管瘤的存在、存在位置及积液量非常敏感。对于无尿路梗阻的移植肾,可于检查前静脉注射塞米(速尿)以扩张尿路,从而使得整个尿路清楚显影(图3)。MRU还可对活体供肾者进行无创性检查,了解供肾者的尿路情况。但MRU也有其局限性,能定位但不能直接显示梗阻原因,尿路内小的充盈缺损可能被液体的高信号掩盖,仅反映尿路系统的形态学改变,并不反映肾功能。因此,在诊断时应结合原始的MRI影像及其他检查以保证诊断的客观与全面。
MR血管成像
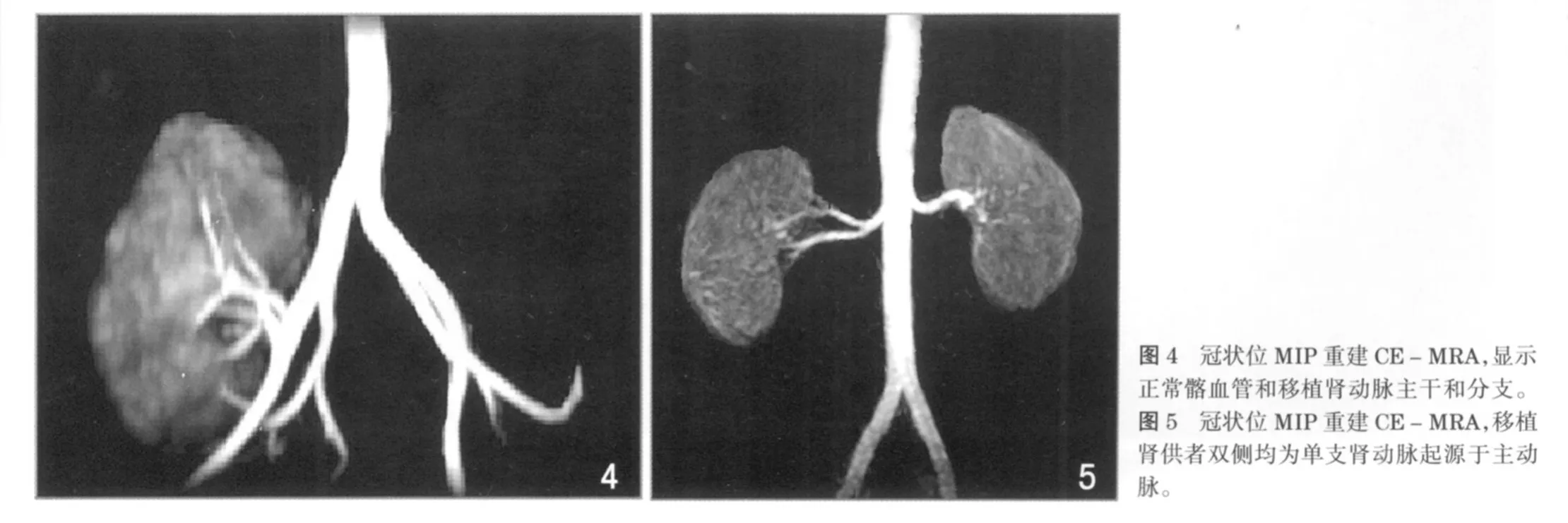
常规MR血管成像(MR angiography,MRA)是利用血液的流动效应来成像的,目前有两种方法:时间飞越法(time of flight,TOF)和相位对比法(phase contrast,PC)。TOF成像速度快,应用最广泛,但由于湍流引起的信号丢失可出现血管狭窄的假象。PC背景组织抑制好,利于小血管、血管狭窄显示,还可提供血流方向、速度、流量等定量信息,但成像时间长,图像处理复杂。近年来对比剂增强的MR血管成像应用于临床,利用Gd-DTPA这种顺磁性对比剂通过血液时T1值明显缩短,短于人体内其他组织,然后利用超快速且权重很重的T1WI序列来记录这种T1弛豫差别,它依赖于血液与组织之间的T1差,这就大大地减少了PC法MRA在狭窄的动脉边缘与流动有关的相位离散效应,以及TOF法MRA肾动脉层内流动的饱和效应造成的信号丢失。由于血管腔显示更可靠,已成为显示肾动脉最常用的方法。移植肾血管并发症是肾移植术后并发症中较为多见的一种,据统计流入动脉异常占引起同种异体肾功能不良的5%~10%。如果对移植肾动脉狭窄进行合适的血管内或外科血管再成形术,2年的同种异体肾存活可以显著提高,所以血管成像非常重要。传统DSA检查是诊断的金标准,但是创伤性检查且要用有肾毒性的碘对比剂,故不适合移植肾随访检查。而MRA由于其准确、安全、快速、无创,能发现移植肾血管血栓形成、血管狭窄、动脉瘤形成和移植肾静脉等疾病,基本已替代了DSA(图4)。三维重建技术提供了任意方向的同种异体肾动脉供应显影,更有利于评估有否移植肾血管狭窄。其次,CE-MRA还被广泛应用于移植肾供体的术前评估(图5)。由于正常人群肾血管变异率为40%,故在术前了解供肾的血管数目和肾动脉主干的长度对手术是至关重要的。研究发现MRA对诊断肾脏血管数目的敏感性为90%左右[3]。而用CE-MRA与DSA和术中结果比较发现,MRA对肾脏动脉诊断准确率与DSA相似,而对静脉的诊断准确率还要高于DSA[4]。由此可见CE-MRA的诊断准确性高,对于肾移植前后的应用均有广泛的临床前景。
磁共振灌注加权成像
肾脏磁共振灌注加权成像(PWI)是观察对比剂经过肾脏组织血管网的磁共振信号变化,通过测量一些血流动力学参数来无创地评价肾的灌注和肾功能。相对于常规增强MRI(CE-MRI)更侧重于强化的时间过程。随着MR快速成像技术的发展,时间分辨率明显提高,极大地加快了肾脏灌注成像的基础研究和临床应用。
1.Gd-DTPA
Gd-DTPA为非特异性细胞外间隙对比剂,在体内的生物特性与99Tc-DTPA类似,只经过肾小球滤过,不被肾小管分泌及重吸收,无明显肾毒性,适合作为测量肾功能的标记物。对比剂通过肾单位的时间约为3~6min,每一次经过肾脏,大约有20%的Gd-DTPA被排出。MRI序列可以监测肾脏内Gd-DTPA浓度随时间的变化,选择肾脏不同区域测量其信号强度,绘出时间-信号强度曲线,即MR肾图(MR renography,MRR),用于肾功能的半定量分析,类似核医学同位素肾图,两者有很好的相关性并且肾脏信号强度的改变与血清肌酐浓度水平间密切相关,可以较好地反映单侧肾功能。同时根据皮质、髓质信号强度变化曲线可得出许多肾功能参数,包括肾小球滤过率、肾单位浓缩系数、肾皮质血容量等。
正常移植肾团注给药后10~20s即可见肾皮质信号增高,20~50s后信号达最高值,然后信号强度缓慢下降。肾髓质在皮质增强后10~20s后开始强化,在20~30s后达峰值。根据信号变化大致可分为4期:皮质期、皮髓质、分辨期、髓质期和肾盂期。MRR上急性排斥移植肾皮、髓质信号上升缓慢,峰值均明显降低;髓质信号不能达到皮质信号水平(图6)。急性肾小管坏死移植肾皮、髓质峰值降低和峰时延长均较轻微,髓质增强曲线无明显“双期增强”表现。环孢霉素中毒移植肾信号强度低,没有明确峰值,皮质、髓质信号曲线平行。
2.超顺磁性氧化铁粒子和超小超顺磁性氧化铁粒
超顺磁性氧化铁粒子 (superpara magnetic iron oxide particle,SPIO)和超小超顺磁性氧化铁粒子(ultrasmall superparamagnetic iron oxide particle,USPIO)是网状内皮系统对比剂,以缩短组织T2*为主,磁敏感性强。其主要成分为氧化铁晶体核心,通常不易或缓慢经过毛细血管滤过到组织间隙,代谢途径主要在肝、脾、骨髓、淋巴结等网状内皮细胞丰富的组织,被淋巴细胞、单核细胞和巨噬细胞所吞噬,运动到溶酶体分解,成为机体内的储备铁,因此属细胞特异性血池型对比剂。SPIO颗粒直径在30~1000nm之间,颗粒较大,能较快被单核-巨噬细胞吞噬,目前多用于肝脏的临床研究。而USPIO颗粒直径<30nm,颗粒更小、抗原性较弱,单核-巨噬细胞识别与吞噬较慢,在血管内滞留时间更长,是一种理想的灌注成像对比剂。
USPIO被首先用于鼠移植肾的研究[5],随后在鼠慢性排斥(chronic rejection,CR)模型中发现,皮质信号减低发生在肾移植后8~16周,而血尿肌酐水平到28周才有变化[6],说明在监测CR反应中,SPIO增强的磁共振检查比常用的肌苷清除率方法更敏感。Hauqer等[7]首次将其用于人的移植肾研究,未发现剂量引起的区别及对人体的损害。ATN是由于缺血再灌注引起的,有其特征性的改变:只在肾髓质有明显的信号减低,在皮质没有明显的炎症反应,所以没有信号减低。而AR表现为肾脏各部分信号普遍减低,这种变现只是炎症表现与动物实验相符,是非特异性的。说明这种对比剂对于鉴别肾移植后肾功能异常的原因有其特殊的优势和发展前景,但目前我国还未批准此种网状内皮系统对比剂应用于临床人体研究。

磁共振弥散成像

磁共振弥散成像(DWI)是基于流动效应的一种成像方式,是目前唯一能在活体检测体内水分子弥散的方法。弥散是分子的随机热运动,即布朗运动。表观弥散系数(apparent diffusion coefficient,ADC)是通过DWI计算出的定量指数,用于描述不同方向分子扩散的速度,可以消除T2穿透效应,反映组织真正的弥散状况。将每一像素的ADC值进行自然对数运算后可得到DWI图,因此同一像素在ADC图和DWI图中的信号强度通常相反,即弥散运动快的像素,其ADC值高,在DWI上呈低信号,反之亦然。
虽然目前DWI应用最广泛的是脑缺血早期病灶的显示,但肾脏由于其高的血流灌注和高含水量,是最早用DWI进行功能评估的组织[8]。因为肾脏的主要功能是重吸收水和浓缩稀释,不同病变肾组织中水分子的运动可有所变化,因而通过测量肾脏的ADC值可以反映肾脏的病变。实验发现肾脏ADC值与血清肌酐水平呈线性负相关,与分肾GFR呈正相关[9]。同时也在对自体肾的研究中发现急慢性肾功能衰竭的病人,皮质和髓质ADC值较正常肾脏明显减低,并且慢性肾衰的ADC值更低[10]。研究肾功能正常的移植肾病人与正常志愿者比较发现:病人皮、髓质ADC值相近且与正常人髓质相似,正常人ADC值皮质比髓质高,并且ADC值与血肌酐浓度显著相关[11]。上海市第一人民医院用GE 3.0T磁共振机对11名正常功能移植肾研究发现,平均皮质ADC值为 (285.94±20.63)×10-5mm2/s,平均髓质ADC值为(225.63±23.79)×10-5mm2/s。年龄、性别相匹配的11名志愿者22个肾脏的平均皮质ADC值为(301.32±21.02)×10-5mm2/s,平均髓质ADC值为(247.72±19.22)×10-5mm2/s。对2名移植肾急性排斥病人检查,平均皮质ADC值为(202.50±14.52)×10-5mm2/s,平均髓质ADC值为(177.88±18.50)×10-5mm2/s,均明显低于正常功能移植肾(图7)。这一结果大致与文献报道相符,说明DWI可以反映移植肾的生理变化,无创地评估疾病状态。但由于用 3.0T高场强代替1.5T,使得皮、髓质的ADC值的对比更明显,ADC值的基线值和差值均较1.5T的结果增大。说明在没有明显增加磁敏感伪影的情况下,3.0T更利于移植肾的DWI检查。
动脉血氧水平依赖(BOLD)成像技术
动脉血氧水平依赖(BOLD)效应的机制是去氧血红蛋白为顺磁性物,当其含量增加将引起血中水分子去相位,T2*时间降低,导致信号减低。而R2*(表观自旋-自旋弛豫率,apparent spin-spin relaxation rate)可以通过取T2*信号强度的自然对数对比回波时间进行计算。R2*与血中去氧血红蛋白的含量成正比,与氧分压成反比。BOLD成像利用肾髓质内去氧血红蛋白较皮质高,且去氧血红蛋白与尿液浓缩功能密切相关的这一特性,实时地反映髓质尿液浓缩功能在病理和生理情况下氧代谢的变化。

动物实验证实了BOLD技术能可靠地反映肾皮髓质氧合状态的变化,R2*值同应用侵袭性微电极或激光方法测量肾脏皮髓质内氧分压有很强的相关性。人类肾脏髓质氧分压大约为10~20mmHg,皮质内氧分压大约为50mmHg,BOLD在人自体肾的研究证明了肾髓质R2*值高于皮质,与氧分压有很好的相关性。BOLD可以早期发现糖尿病引起的肾脏髓质氧分压降低[12],发现急性单侧尿路梗阻侧肾皮髓质的R2*值和髓质比皮质 R2*比值 (medullary to cortical R2*ratios,MCR2*)均显著降低[13],故BOLD可早期发现患侧肾的氧分压改变。由于肾脏氧分压的改变能先于不可逆肾损害发生之前反映肾脏生理和功能的紊乱,而肾髓质结构的缺氧性损害是触发急性肾衰的原因,故BOLD检查对移植肾随访有重要的临床意义。
研究发现正常功能移植肾髓质R2*值高于皮质,但低于正常肾脏髓质,这种移植肾皮、髓质的R2*值差异减小,暗示了移植肾髓质氧分压相对升高,可能反映了已知的肾小管钠重吸收的减少[10]。Sadow ski等[14]发现急性排斥反应移植肾髓质R2*值明显降低,皮质无明显变化。急性肾小管坏死移植肾髓质R2*值变化不明显,但肾皮质显著升高。在对慢性移植肾肾病病人的研究中发现[15],移植肾的皮髓质R2*值均显著降低,但MCR2*与正常肾比较未见明显变化。由于BOLD技术能无创性评价活体移植肾内的氧含量,彩色R2*图能帮助区分移植肾急性排斥和正常功能者(图8),目前是MR研究移植肾新的热点。
综上所述,尽管磁共振成像的临床应用仍受到技术等方面的限制,存在许多不足,有些新技术仍处于基础研究阶段,但相比较其他研究移植肾的传统检查,不仅可以清晰显示肾脏形态改变,而且能实时评价移植肾功能,性价比高。虽然目前的研究结果还不十分令人满意,活检病理结果仍然是确诊的唯一办法,然而,随着MR成像设备软硬件的不断升级换代,研究不断向纵深发展,有理由相信磁共振成像作为一种无创性的检查必将在今后移植肾的基础研究和临床应用中发挥更加重要的作用。
1.冯晓源,刘含秋.功能磁共振成像在中国的研究现状.中国医学计算机成像杂志,2004,10:292-298
2.Henning J,Nauer th A,Friedburg H.RARE imaging:a fast imaging method for clinical MR.Magn Reson Med,1986,3:823-833
3.Monroy-Cuadros M,McLaughlin K,Salazar A,et al.Assessment of live kidney donors by magnetic resonance angiography:reliability and impact on outcomes.Clin Transplan t,2008,22:29-34
4.Lemke U,Taupitz M,Klüner C,et al.Preoperative imaging in 78 living kidney donors using CE-MRA and DSA.Rofo,2008,180:48-54
5.Yang D,Ye Q,Williams M,et al.USPIO-enhanced dynamic MRI:evaluation of normal and transplanted rat kidneys.Magn Reson Med,2001,46:1152-1163
6.Beckmann N,Cannet C,Zurb ruegg S,et al,Macrophage in filtration detected at MR imaging in rat kidney allog rafts:early marker of chronic rejection?Radiology,2006,240:717-724
7.Hauqer O,Grenier N,Deminere C,et al.USPIO-enhanced MR imaging of macrophage infiltration in native and transplanted kidneys:initial results in hum ans.Eur Radiol,2007,17:2898-2907
8.Thoeny HC,De Keyzer F.Extracranial applications of diffusion-weighted magnetic resonance imaging.Eur Radiol,2007,17:1385-1393
9.Xu Y,Wang X,Jiang X.Relationship between the renal apparent diffusion coefficient and glomerular filtration rate:preliminary experience.JMagn Reson Imaging,2007,26:678-681
10.Thoeny HC,Keyzer FD,Oyen RH,et al.Diffusion-weighted MR imaging of kidneys in healthy volunteers and patients with parenchymal diseases:initial experience.Radiology,2005,235:911-917
11.Thoeny HC,Zumstein D,Simon-Zoula S,et al.Functional evaluation of transplanted kidneys with diffusion-weighted and BOLD MR imaging:initial experience.Radiology,2006,241:812-821
12.dos Santos EA,Li LP,Ji L,et al.Early changes with diabetes in renal medullary hemodynamics as evaluated by fiberoptic probes and BOLD magnetic resonance imaging.Invest Radiol,2007,42:157-162
13.Thoeny HC,Kessler TM,Sim on-Zoula S,et al.Renal oxygenation changes during acute unilateral ureteral obstruction:assessment with blood oxygen level–dependent MR imaging —initial experience.Radiology,2008,247:754-761
14.Sadow ski EA,Fain SB,Alford SK,et al.Assessment of acute renal transplant rejection with blood oxygen level-dependent MR imaging:initial experience.Radiology,2005,236:911-919
15.Djamali A,Sadow ski EA,Muehrer RJ,et al.BOLD-MRI assessment of intrarenal oxygenation and oxidative stress in patients with chronic kidney allograft dysfunction.Am J Physiol Renal Physiol,2007,292:513-522
