实验性大鼠肺气肿模型的建立
2010-05-07谭显曙屠建棋刘立涛匡文娟万莉红周黎明
谭显曙 屠建棋 刘立涛 匡文娟 万莉红 周黎明△
(1.四川大学华西基础医学与法医学院药理学教研室,四川 成都 610041;2.山东济宁医学院,山东 济宁 272067)
肺气肿是指终末细支气管远端气道弹性减退,气腔过度充气增大,出现异常持久性扩张,并伴有呼吸性细支气管、肺泡管、肺泡囊直至肺泡腔壁膨胀及破坏性病理损害而无明显纤维化为特征的一种慢性病。该病病因众多,发病机理未明,病程迁延,病变类型复杂,使肺气肿模型制作的合理模拟及测量指标的客观、精确与量化带来很大难度,多年来虽提出多种动物模型,但实用者甚少[1]。
目前肺气肿动物模型主要是自发性肺气肿小鼠与转基因小鼠[2],以及外源性物质诱导复制[3]。由于长期吸烟是肺气肿的主要环境因素,且烟雾刺激复制肺气肿模型能模拟人肺气肿的慢性发病过程,故烟熏法较之急性伤害性模型更受重视,是肺气肿药物筛选的有效方法。但周期较长,因此,本文采用内毒素(LPS)致敏加烟熏诱导复制实验性大鼠肺气肿模型,以供研究工作者参考。
1 材料和方法
1.1 材料
SPF级SD大鼠购自成都达硕生物科技有限公司,雌雄各半,体重约180~200g;自制烟熏铁皮箱(80×60×50 cm3);LPS(10 mg◦支-1,Sigma公司);天下秀香烟(川渝中烟工业公司生产);快速血气分析仪(Rapidlab348,Bayer公司);倒置荧光相差数码照相显微镜(TE2000-S,Nikon公司)。
1.2 方法
1.2.1 动物分组
将SPF级SD大鼠随机分为:对照组与肺气肿模型组,每组各10只。
1.2.2 模型复制
造模组于实验第l、14 d,经10%水合氯醛腹腔注射麻醉大鼠后,钝性分离大鼠并暴露气管,气管内注入用1 mg◦mL-1LPS 200 μ L,注入气管后适度摇动大鼠。对照组按相同的方法在气管内注入等体积生理盐水。实验第2 d,将大鼠置于80×60×50 cm3的自制烟室中,点燃20支香烟进行烟熏,每日烟熏30min,连续烟熏4 w。对照组大鼠置于相同的无烟熏环境中饲养30min,连续4 w。
1.2.3 采集标本
实验第30 d,10%水合氯醛腹腔注射麻醉大鼠后,取抗凝腹主动脉血2ml,作血气分析;并取左肺组织,经10%甲醛固定后,石蜡包埋切片,常规HE染色,显微镜观察肺组织病理改变。
1.3 统计学处理
采用SPSS11.5统计软件进行数据分析,计量资料的各组数据以d表示,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠动脉血气分析
如表1所示,与对照组相比,肺气肿模型大鼠二氧化碳分压(PaCO2)明显升高(P<0.05),氧分压(PaO2)与PH值明显降低(P<0.05)。
表1 两组大鼠动脉血气值(d,n=10)

表1 两组大鼠动脉血气值(d,n=10)
注:与对照组相比,#p<0.05,差异具有统计学意义。
组别 PH PaCO2(mmHg) PaO2(mmHg) O2sat(%) O2cont对照组 7.33±0.02 55.04±4.37 88.18±10.79 95.68±1.59 20.2±0.35肺气肿模型组 7.15±0.02* 66.87±4.19* 75.65±9.97* 91.66±3.15* 19.34±0.69*
2.2 病理改变
模型组肺组织肉眼观察发现,体积较对照组明显增大,且表面有多个大小不等的过度充气肺泡,颜色苍白,肺组织弹性减弱,在剖胸后肺脏不发生萎缩,保持膨胀状态。经HE染色后,光镜下分析,如图1所示:对照组肺泡大小均一,肺泡间隔较厚,未见肺气肿及肺大泡形成,肺泡间隔无水肿及炎症细胞浸润。模型组肺气肿明显,肺泡扩张,肺泡壁变薄、断裂或消失,局部有肺大泡形成,肺泡间隔可见淤血和炎细胞浸润,平均肺泡面积增大,与对照组比较有显著性差异,经图像处理分析,量化后的统计结果见表2。
表2 两组大鼠平均肺泡面积的结果(d,n=10)

表2 两组大鼠平均肺泡面积的结果(d,n=10)
注:与对照组相比,#p<0.05,差异具有统计学意义。
组别 平均肺泡面积(103μ m2)对照组 0.744±0.18肺气肿模型组 2.922±0.98*
3 讨论
近年来肺气肿的发病率正呈逐年上升的趋势,成为危害人类健康的又一大疾病。而引起肺气肿的危险因素有多种,如吸烟、空气污染、感染和气道高反应性,儿童时期呼吸道感染等等,其中吸烟被认为是肺气肿的主要致病因素[4]。故目前主要的疾病动物模型采用外源性物质诱导:包括烟熏以及LPS。
长期吸烟可以导致呼吸道纤毛结构和功能异常,引起支气管痉挛,增加气道阻力;烟雾中存在的大量氧化剂和自由基,可直接损伤细胞功能,引起白细胞聚集,黏附于血管内皮,导致肺血管内皮细胞以及肺泡巨噬细胞聚集、活化,破坏蛋白酶与抗蛋白酶之间的平衡等,从而形成肺气肿[5]。
另外,LPS作为革兰阴性菌细胞壁层结构,也可通过刺激单核细胞、内皮细胞及中性粒细胞等合成释放一系列炎性介质(如TNF-α等),介导气管及肺组织的炎症反应,破坏蛋白酶与抗蛋白酶之间的平衡等,从而形成肺气肿[6]。
但这些肺气肿动物模型均不同程度存在复制周期长、个体差异大、成功率低等缺点[8],使得肺气肿治疗药物的筛选受限。
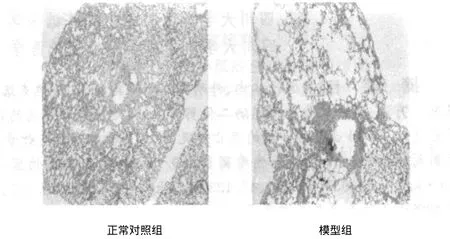
图1 对照组与模型组大鼠肺组织切片HE染色
因此,本文采用气管内注入脂多糖及混合烟熏刺激复制实验性肺气肿大鼠模型,结果发现,30天内模型组大鼠不同程度存在淋巴细胞、中性粒细胞及巨噬细胞等炎细胞浸润,肺泡间隔充血、增厚,肺泡腔不规则扩大,肺泡间隔破裂,有的肺泡相互融合成大泡。
综上所述,气管内注入LPS及混合烟熏刺激可在短期内复制实验性肺气肿大鼠模型,且模型复制稳定,可行,将为今后进行有效药物的筛选提供有效地动物模型。参考文献
1 M ahadeva R,Shapiro SD.Animal models of pulmonary emphysema[J].Curt Drug Targets Inflamm Allergy,2005,4(6):665-673.
2 Campbell EJ.Animal models of emphy sema:the next generations[J].J Clin Invest,2000,106(12):1445-l446.
3 Fl C,Lopes FD,Kasahm DI,et al.Effects of exercise training on popain induced pulmonary emphy sema in Wistar rats[J].J Appl Phy siol,2006,100(1):281-285.
4 李若葆,王金平,鞠学红,等.长期吸烟对大鼠肺组织结构的影响[J].潍坊医学院学报,2007,29(2):97-100.
5 陈剑波,蔡珊,陈平.肺气肿动物模型研究进展[J].国际呼吸杂志,2007,27(9):700-702.
6 马楠,崔德健,梁延杰,等.气管内注入脂多糖法建立大鼠慢性支气管炎模型[J].基础医学与临床,2000,20(4):87-87.
7 American Thoracic society ad hoc Statement Committee.Mechanisms and limits of induced postnatal lung growth[J].Am J Respir Crit Care Med,2004,170(3):319-343.
8 陈丕仁,崔立,侯加法.慢性阻塞性肺病动物模型的研究进展[J].中国实验动物学报,2007,15(3):238-242.
