脂多糖对不同发育期小鼠肝脏β-防御素3表达的影响*
2010-05-07罗咏梅郑筠
罗咏梅 郑筠
(1.四川省建筑医院药剂科,四川 成都 610041;2.中国医药集团总公司四川抗生素研究所,四川 成都 610041)
当机体受到外界病原微生物、炎症因子以及细胞因子刺激时,会激活天然免疫系统产生内源性抗生素肽(Endogenous antibiotic peptide),简称抗菌肽。而作为抗菌肽家族成员之一的防御素,是一类小分子阳离子多肽,分子量在3000-4500 Da之间。根据其分子结构主要分为三类:α-,β-,θ-防御素。它们具有广谱的抗微生物作用,对大多数的革兰氏阳性菌、革兰氏阴性菌、真菌、流感病毒以及 HIV等等,均有明显的杀伤或抑制作用[1-3]。小鼠防御素,包括隐凹素(α-防御素)(Cryptdin)以及β-防御素,目前发现并已经成功克隆的小鼠β-防御素主要包括mBD-1、-2、-3、-4、-5、-6、-7、-8、-9、-11、-12、-13、-14以及-35[4-7]。mBD-1是一种广泛存在于不同上皮的抗菌肽,在肾中的表达量最高,LPS不能诱导其表达,其与人β-防御素1同源性最高[4];mBD-3在食管、气管以及舌中具有固有表达,经LPS或是革兰氏阴性菌感染可在肝、胃肠道以及肺中诱导表达,其与人β-防御素2在结构,功能上相似性最高[5];mBD-4在舌、食管以及气管的上皮中固有表达量最高,气管给予铜绿假单胞菌PAO1注射后,未发现其在肺内表达量有明显改变,但是并不代表其它的刺激物无法引起本身的诱导表达,其与人β-防御素2在蛋白序列及功能上也具有较高的相似性[6]。
由于小鼠防御素与人防御素之间存在很多的共通之处,所以小鼠防御素成为了研究防御素功能以及作用机制的主要对象。对于人防御素在发育过程中起到的关键作用,以往的文献中提到β-防御素以及抗菌肽其他家族成员LL-37在肺部的发育过程中起到的重要保护作用[7],以及在新生儿肺部感染中防御素起到的重要的防御作用[8],但是迄今为止,鲜有文献报道防御素在其他重要器官发育过程中的关键作用。通过本文的研究,了解小鼠防御素mBD-3在正常以及受到LPS感染的不同发育时期小鼠肝脏的表达情况,为进一步研究防御素在胎儿及新生儿感染方面提供依据,也为进一步探索防御素在天然免疫中的作用奠定基础。
1 材料与方法
1.1 材料
健康5周龄ICR小鼠,购自简阳达硕动物中心。T rizol试剂(Invitrogen,USA),其余试剂均来购自成都宝信生物技术公司。二步法 RT-PCR试剂盒(Tiangen,Japan)。RT-PCR试剂盒,PCR mix试剂购自北京天根公司。一抗:anti-mBD-3(Santa Cruz,USA);anti-β-actin(Santa Cruz,USA)。BCA 蛋白试剂盒(pierce,USA);ECL发光试剂盒购自北京奥科生物技术有限公司。显影液,定影液以及胶片购自柯达公司。牛血清白蛋白(BSA)(Sigma,Japan);Tween-20、2-巯基乙醇(Sigma,USA),其余用品均为国产分析纯;小鼠SP检测试剂盒购自成都宝信生物技术公司。
1.2 方法
1.2.1 实验动物的准备
健康ICR小鼠,5~6周龄,饲养于定温空调房内,早晨定时给水及饲料。使用注射器腹腔注射雌鼠PMSG 5 U◦只-1,再42-48 h后注射 HCG 10 U◦只-1。雌鼠:雄鼠按 2∶1的比例合笼。定时熄灯,于晚上12时观察交配情况。翌日,检查雌鼠阴道是否有白色阴栓出现,见阴栓的雌鼠单独饲养,此时为0.5 d。妊娠雌鼠随机分组,每组50只,按日待用。
1.2.2 LPS注射建立小鼠模型
LPS感染组(n=50)孕鼠(E13.5、E16.5)经腹腔注射550μg◦kg-1LPS,24 h 后,取母鼠、胎鼠(E14.5、E17.5)的肝脏备用,在孕期17.5 d的孕鼠注射550μg◦kg-1LPS,取新生鼠(P0、P4)的肝脏备用,新生鼠成年后(三周龄)取肝脏备用;正常对照组(n=50)同时间注射同量的生理盐水,同时间取小鼠肝脏备用。
1.2.3 RT-PCR检测不同发育期小鼠肝脏mBD-3 mRNA表达
按Trizol法提取肝脏总RNA。按照北京天根公司试剂盒说明书,将 RNA反转录为 cDNA,以β-actin作为内对照。反应体系中加入 25 μ l 2 ×mRNA selective PCR buffer I,1 μ l Rnase inhibitor,10 μ l M gCl2,5 μ l dNTP,1 μ l AMV taq,补齐体 积为50 μ l。程序如下:42℃,40min;94℃预变性 2min;94℃变性30 s,55℃退火30 s,72℃延伸45 s,30个循环;最后72℃延伸7min。反应结束后取5 μ l PCR产物用1%琼脂糖凝胶电泳观察。引物序列如下:

基因 上游引物 下游引物 片段长度(bp)mBD-3 5'-CTCTTTGCATTTTCC TGGTG-3'5'-GGGAGCACTGTTTGC ATTT-3' 235 β-actin 5'-AACCCTAAGGCCAAC CGTG-3'5'-CAGGATTCCATACCC AAGAAGG-3' 650
1.2.4 Western-blotting检测不同发育期小鼠肝脏mBD-3蛋白表达
不同发育时期的肝脏蛋白提取步骤按南京凯基公司蛋白提取试剂盒说明书进行,简要程序如下:按组织净重∶裂解液=1∶10的比例,制备组织匀浆液。室温静置 10min,离心10,000 rpm×10min,弃上清,室温10min空气干燥沉淀。所得蛋白,按BCA蛋白浓度测定试剂盒(Pierce)说明书方法测定蛋白浓度。T ricine-SDS-PAGE电泳分离不同的蛋白条带,12 V 4℃冰箱湿转过夜。取出PVDF膜,一抗孵育:将对应抗体按1(200用一抗稀释液稀释后(总体积为 5ml),加入杂交袋中,4℃杂交袋内孵育过夜。移去一抗孵育液,用足量TBST洗液振荡洗涤3×10min。二抗孵育:将HRP标记的二抗(羊抗兔IgG)按1∶5000用封闭液稀释(总体积为5ml),加入杂交盒内,室温振荡孵育1 h。移去二抗孵育液,用足量 TBST洗液振荡洗涤3×10min。PVDF膜浸到ECL化学荧光试剂中显色,然后定影,显影。
1.2.5 免疫组化
不同发育时期的左半叶肝脏取出后,用0.1 mol◦L-1磷酸盐缓冲液(PBS)洗净血迹,置于0.1%DEPC的4%多聚甲醛溶液中固定,30%乙醇 15min,50%乙醇 15min,75%乙醇15min,85%乙醇15min,95%乙醇10min(2次),100%乙醇10min(2次)梯度脱水,乙醇二甲苯(1∶1)15min,二甲苯5-10min,二甲苯石蜡(1∶1)15min,浸蜡1 h(3次),石蜡包埋。载玻片用APES防脱片剂处理,捞片后置烤箱58~60℃孵育30~60min;切片梯度无水乙醇以及二甲苯常规脱蜡;30%H2O2滴在切片上,室温5~10min灭活内源性酶,蒸馏水洗3次;热修复抗原:将切片浸入0.01 M枸橼酸盐缓冲液(PH6.0),微波炉加热间隔5~10min后,反复1~3次,冷却后用磷酸缓冲液(PBS)(PH7.2~7.6)洗涤1~2次;滴加5%山羊血清封闭液,室温孵育20min;滴加适当稀释的相对应的一抗,放入湿盒中,4℃过夜,取出后PBS洗2min×3次。滴加生物素化二抗,20~37℃30min,PBS洗2min×3次;滴加新鲜配制的三抗,20~37℃20min,PBS洗5min×4次;滴加新鲜配制的DAB溶液显色。苏木素轻度复染30 s,梯度无水乙醇脱水,二甲苯透明,中性树胶封片。上述染色均设阳性对照片和阴性对照片,阳性对照片为已知切片,阴性对照片为PBS替代一抗,显微镜观察,阳性结果为胞浆内出现棕黄色颗粒。
1.2.6 免疫组化结果判定
每张切片随机选10个视野,高倍镜下(×400)以细胞浆或膜出现定位清晰的淡黄色至棕褐色颗粒状物质为阳性。根据阳性细胞膜或浆的染色程度及染色细胞百分率评分,行半定量分析:根据阳性细胞比例以及染色的细胞水平进行半定量分析。每个抗原的表达评分标准为:0分:无染色;1分:弱染色;2分:强染色占到25%或中度染色<80%;3分:强染色占到25%-50%或是中度染色>80%;4分:强染色>50%。每种情况,要计算10个最具有代表性的视野的比值。
1.3 统计学处理
2 结果
2.1 mBD-3 mRNA在不同发育期小鼠肝脏表达
RT-PCR结果显示:正常对照组中,mBD-3 mRNA在肝脏中的表达量微弱至无法检测到,仅在出生后第四天检测到较弱的表达。而mBD-3在 LPS诱导后原未见基础有表达的肝脏出现诱导表达,随着发育天数的增加,胎鼠、新生鼠以及成年鼠的肝脏的诱导表达逐渐的增强,在成年后受感染,肝脏的mBD-3表达量达到最高。这说明在发育过程中,胎鼠受到感染后的防御能力在逐渐增强(图1)。
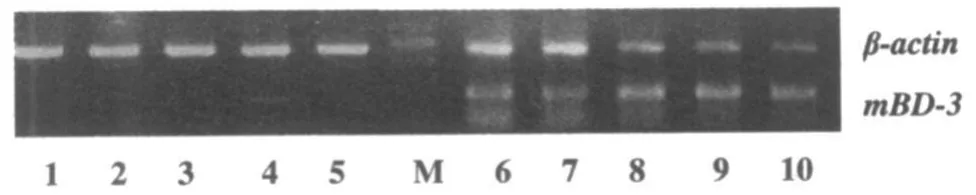
图1 不同发育时期小鼠肝脏mBD-3 mRNA表达电泳图
2.2 mBD-3蛋白不同发育期小鼠肝脏表达以及在肝脏中的分布
Western blotting结果显示:mBD-3蛋白在肝脏中的表达趋势与其RNA的表达趋势基本一致。正常对照组同样未检测到mBD-3蛋白表达,而在LPS感染组,mBD-3出现了诱导表达,且随着发育天数的增加,胎鼠、新生鼠以及成年鼠的肝脏中mBD-3诱导表达逐渐的增强,这种表达在小鼠成年后的肝脏中达到最高(图2)。

图2 不同发育时期小鼠肝脏mBD-3蛋白表达电泳图
在小鼠肝脏发育过程中,正常对照组中,未发现明显表达mBD3的阳性细胞,但是在肝细胞浆中有零星的阳性表达,且随着发育时间的增加,这种零星表达分布逐渐增多(图 3 A、C、E、G、I)。而在LPS感染组,在肝细胞索以及肝细胞内部及肝血窦中均发现大量的mBD3阳性表达细胞,尤其是在库夫氏细胞胞浆内这种阳性表达尤其明显,且随着发育时间的增加,阳性细胞量逐渐的增多,分布也逐渐的变广。胚胎发育中期14.5天,经过LPS诱导在肝脏组织中有较明显的mBD-3表达(图 3 B),到胚胎晚期,第 17.5天时,小鼠胚胎发育成熟,接近成鼠水平(图3 D),在LPS感染组的表达最高(图3 F、H、G)。LPS感染组的阳性表达明显高于正常对照组(图3),组间差异有统计学意义(P<0.001)。


3 讨论
母体感染LPS对母体本身危害极大,也是导致胎儿的宫内死亡,早产,宫内发育迟滞,早发性爆发性新生儿肺炎及死亡的重要原因之一。防御素则具有抵抗LPS感染的功能,同时鼠的β-防御素同人β-防御素有许多相似的地方,比如广泛存在于多种器官组织上皮,有广谱的抗微生物作用,也有固有表达和诱导表达两种方式,同人防御素HBD-2一样都位于小鼠第8号染色体上的特点。基于同源性、上游调控元件、表达方式的共通性,所以本实验选择了mBD-3来观察LPS刺激后不同发育时期小鼠肝脏β-防御素表达的差异。本实验重点就在于研究LPS感染对胎鼠、新生鼠以及成年鼠产生防御性β-防御素的影响,从而对于人β-防御素对抗孕期LPS感染提供借鉴性的实验依据。
1999年,小鼠β-防御素 3(mBD-3)被成功克隆出来,其cDNA序列同HBD-2具有36.7%的同源性,同 HBD-1仅有25.3%的同源性。其氨基酸序列同HBD-2的相似序列达到了39.7%。mBD-3序列由两个外显子将1.7 kb长的内含子分开,在其5'端侧翼链含有 TATA盒以及 NF-κ B的同源结合序列。通过原位杂交的方法检测的结果发现,骨骼肌未检测到表达,在唾液腺、胰腺以及生殖道(睾丸)上皮发现mBD-3的高表达。在脑、肝、肺、卵巢均有表达,在胚胎发育 7天就有表达,在11天时达到最高,后在胚胎15天表达又有所下降。后经气管注射绿脓杆菌PAO1,再使用RT-PCR检测发现在肺、小肠以及肝中的表达量迅速增高。在肝脏的表达,在以后的研究中发现LPS感染可导致肝脏的急性相反应,产生大量的mBD-3。在2002年的研究中,结果显示 mBD-3在舌、肺、心、肝、肾、脾以及阴茎、骨骼肌都没有发现基础表达。但是在使用革兰氏阴性菌感染以后,发现其在舌、食管、肺、肝以及小肠的表达增加了[5]。后期研究发现mBD-3,mBD-4以及mBD-6在多种组织中均能检测到,如食管、舌和气管,附睾组织以及骨骼肌中均有发现,而利用ICR小鼠,腹腔注射 LPS后,利用RT-PCR可检测到肺内的 mBD-3以及 mBD-6表达增加[6]。
而本实验在前人研究的基础上,进一步探讨了mBD-3在小鼠不同发育时期肝脏的表达及LPS感染对其在肝脏发育期中表达的影响。肝脏发育的关键阶段为第15-16天,此时基本形成成年肝脏,且共有四个肝叶,即是左、右、中和尾叶。在正常情况下,肝脏并未检测到mBD-3的基础表达,而在LPS刺激下,mBD-3展示了其诱导表达的特性。通过RT-PCR以及Western blotting检测其在肝脏不同发育时期的基因及蛋白的表达变化,以及免疫组化检测其分布。结果显示在肝脏的各发育阶段mBD-3诱导表达均约有60%以上的增加,而这种增加的趋势,随着小鼠的发育而不断的增强。这种现象可能与鼠的β-防御素基因上游序列炎症反应元件组成或类型有关。mBD-35'侧翼端具有 NF-κ B以及 IL-6、AP-1反应元件,而这些元件正是人β-防御素发生诱导表达的关键转录元件,提示我们LPS很有可能通过这些反应元件来调控mBD-3诱导表达。而且随着发育天数的增加,在受到外界刺激的时候,小鼠肝脏诱导防御素的能力逐渐增强,而且从免疫组化的结果看来阳性细胞分布的范围也较广,这说明在小鼠发育的过程中,肝脏在受到感染时,防御的能力随着器官分化的逐步增加,而逐渐的增高,但在这其中各种反应元件如何发挥作用以及在其他组织的mBD-3的基础表达及诱导表达的变化趋势,将是我们进一步需要实验研究的问题。
4 结论
本实验结果表明不同发育时期小鼠的肝脏在正常情况下,均未见mBD-3的表达,但是在LPS感染情况下,小鼠肝脏大量表达mBD-3,且随着小鼠发育的天数的增加,其诱导表达逐渐增加,提示该分子在肝脏组织发挥天然免疫防御作用中占据重要的地位。
1 van Wetering S,Sterk PJ,Rabe KF,et al.Defensins:key players or bystanders in infection,injury,and repair in the lung[J].Allergy Clin Immunol,1999,104(6):1131-1138.
2 Schutte BC,M cCray PB Jr.[beta]-defensins in lung host defense[J].Annu Rev Physiol,2002,64:709-748.
3 Oppenheim JJ,A Biragyn LW,Yang D.Roles of antimicrobial peptides such as defensins in innate and adaptive immunity[J].Ann Rheum Dis,2003,62(Suppl 2):17-21.
4 Morrison GM,Davidson DJ,Kilanowski FM,et al.Mouse beta-defensin-1 is a functional homolog of human beta defensin-1[J].M amm Genome,1998,9(6):453-457.
5 Burd RS,Furrer JL,Sullivan J,et al.Murine-beta-defensin-3 is an inducible peptide with limited tissue expression and broad-spectrum[J].Shock,2002,18(5):461-464.
6 Jia HP,Wowk SA,Schutte BC,et al.A novel murine-beta-defensin expressed in tongue,esophagus,and trachea[J].J Biol Chem,2000,275(43):33314-33320.
7 Starner TD,Agerberth B,Gudmundsson GH,et al.Expression and activity of beta-defensins and LL-37 in the developing human lung[J].Immunol,2005,174(3):1608-1615.
8 Schaller-Bals S,Schulze A,Bals R.Increased levels of antimicrobial peptides in tracheal aspirates of newborn infants during infection[J].Am J Respir Crit Care Med,2002,165(7):992-995.
9 Yasuhiro Y,Shigetomo F,Takahide N,et al.A Novel M ouse β-Defensin,mBD-6,Predominantly Expressed in Skeletal Muscle[J].J Biol Chem.,2001,276(34):31510-31514.
