“Y”形支架在治疗肝门部胆管梗阻中的应用
2010-05-03曹会存曹广劭刘健李天晓翟水亭薛绛宇史帅涛王子亮白卫星
曹会存 曹广劭 刘健 李天晓 翟水亭 薛绛宇 史帅涛 王子亮 白卫星
经皮经肝穿刺分别行左右肝管引流缓解高位胆管狭窄引起梗阻性黄疸的方法简单有效,经左右肝管置入支架能延长胆管的开通时间,创伤性小,能提高患者的生活、生存质量,为原发病灶的治疗创造条件,已成为肝门部恶性梗阻性黄疸的一个重要的姑息性治疗手段[1]。2002.06~2009.06,笔者单位共对12例肝门部胆管梗阻患者,行经皮肝穿“Y”形支架植入术,并联合应用化疗栓塞术或125I粒子植入术或立体定向放射治疗技术,实现胆汁充分内引流及抗肿瘤治疗的双重疗效,现报告如下。
1 材料与方法
1.1 临床资料 男性7例,女性5例,年龄33~80岁,平均年龄(53.5±11.6)岁。胆管梗阻部位:左、右肝管及汇合部梗阻与肝总管上端同时梗阻5例,肝总管上端距左、右肝管汇合部lcm以内梗阻5例;肝左、右肝管起始段多发梗阻2例。胆管梗阻病因:胆管癌6例,胆囊癌3例,转移癌1例,原发性肝癌1例,胰头癌1例。血清总胆红素132.6~783.9μmol/L,且均以直接胆红素升高为主。临床表现为黄疸、皮肤瘙痒、白陶土样大便等。术前全部经CT或MRI检查确定病变位于肝门部并造成肝总管或/和左右肝管闭塞,无外科手术指征。
1.2 方法
1.2.1 经皮穿刺“Y”形植入术 依据术前CT或MRI图像,在X线透视下经剑突下稍偏左侧和右腋中线分别穿刺左、右肝管,经两个通道引入两条导丝至十二指肠,然后经两留置鞘管沿导丝送入两个球囊导管(直径8mm,长度40mm),同时充盈球囊,使狭窄段胆管得到充分扩张。撤出球囊,送入支架输送器,选择适当长度的支架,使两支架远端越过狭窄段并排行走于胆总管内呈对吻“Y”形排列(平行段应超过2cm),近端位于胆管内而不在肝实质内。准确定位后,两位术者同时回撤支架管,使支架同时释放。或者先经一侧肝管置入1枚支架开通一侧胆管,再经另一侧用导丝穿过支架的网眼置入第2枚支架。若因梗阻严重导丝难以通过狭窄段可先置入引流管引流3~10天后再植入支架。
支架植入后,经导管造影观察支架形态、位置是否良好,12例均支架植入后留置1-2枚内外引流管。以便提高胆汁排出的效率,便于观察胆道内有无出血,支架开放是否完全。观察3~7天造影复查,确定对比剂顺利进入十二指肠可拔除引流管。所使用支架为南京微创公司的自膨式金属支架,长6~8mm,直径6~10mm。
1.2.2 联合抗肿瘤治疗 对乏血供的胆管癌等8例肿块行经皮穿刺125I粒子植入术或立体定向放射治疗技术,均为CT扫描下定位,射线源为直线加速器;对富血供的肝癌等2例肿块进行化疗栓塞术,常用药物为吡柔比星20mg,丝裂霉素4mg,顺铂200mg及栓塞剂10~20ml。介入治疗间隔时间1月左右,治疗1~3次。
2 结果

图1 .2 经皮肝穿胆道造影示;肝门部肿瘤,肝左右胆管及总胆管受累。
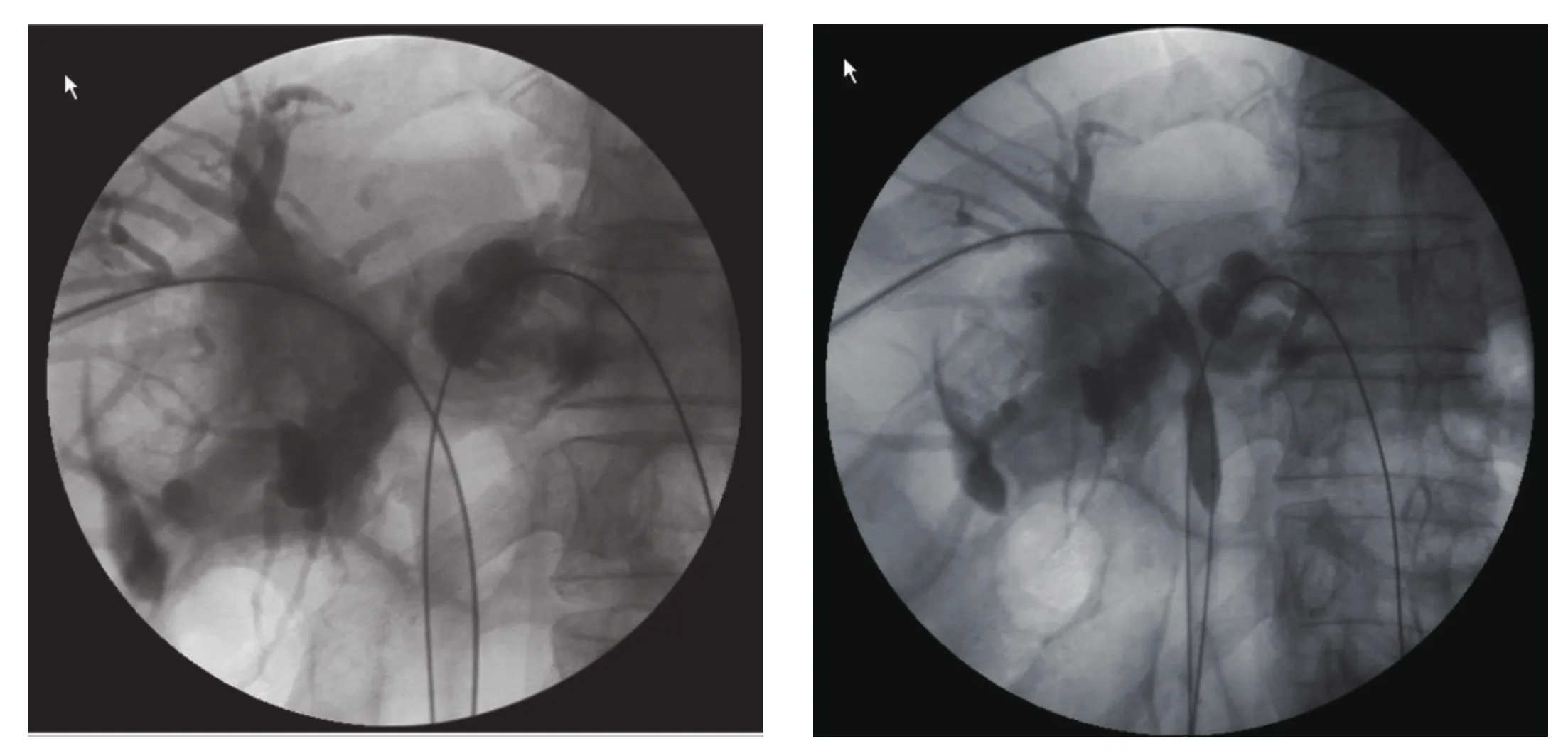
图3 .4 经剑突下和右腋中线分别穿刺左、右肝管,通过两根导丝分别引入球囊对狭窄段进行扩张。
2.1 本组12例中10例经左右肝管分别穿刺,同时向胆总管呈“Y”形并排植入支架,2例先植入右肝管至胆总管的支架,再经支架网眼植入左肝管支架。植入支架前有2例先期放置左右肝管的内外引流,黄疸改善后才置换胆管支架,10例一次穿刺直接放置支架;11例术后均留置1-2枚内外引流管,。术后2周复查肝功能,总胆红素由术前的132.6~783.9μmol/L平均(263.5±153.8),下降至32.1~236.8μmol/L,平均(57.2±10.4),以直接胆红素下降明显,其中7例转氨酶较高的病人基本转为正常。全组病例随访1~18个月,一个月内死亡1例,2~6个月死亡1例,生存6个月以上10例。
2.2 并发症处理 手术技术成功率为100%,没有出现与植入支架有关的严重并发症发生及死亡病例。2例出现轻度腹部胀痛不适,给予密切观察及止痛治疗;1例出现胆管少量出血,生命体征平稳,经外引流及止血药物应用,2天后出血停止;1例出现持续低热,37.5℃左右,给予抗感染治疗后好转。远期并发症主要是支架内再狭窄,随访期间,2例出现支架内再狭窄/闭塞,均给予外引流治疗,黄疸好转。

图5 ,6 同时植入“Y”形双支架于狭窄段,并留置胆道内外引流管,造影复查是造影剂通过顺畅。
3 讨论
肝门部胆管梗阻,是指位于肝、胆总管及左、右肝管汇合部,原发性胆管癌或其附近的恶性肿瘤,侵犯或压迫胆管造成胆管任何部位的梗阻。梗阻发生时多属肿瘤晚期或由于患者自身情况,能做外科根治术仅占7%,姑息性胆肠吻合术也仅适用于19%的病例,但其术后并发症和病死率较高[2]。若不及时解除胆管梗阻,进行性胆管梗阻、胆系感染可导致肝功衰竭或感染加速患者死亡。而通过内镜逆行性胰胆管造影(ERCP)入路很难做到双侧胆管引流,且ERCP成功率较低,特别在胃肠道手术后和高位胆管梗阻的病例,应首选PTCD[3]。随着介入器材的不断改进和PTCD技术的成熟,其技术成功率已接近100%,并发症发生率明显减少,为放、化疗创造了机会,并能同时结合化疗栓塞、放射性粒子植入等治疗原发肿瘤,提高了此类病人的综合疗效。
对于肝门部病变引起的多支胆管梗阻,是全部受到梗阻的胆管都需要得到引流,还是只引流部分优势胆管,目前还没统一意见。有人认为部分胆管引流,患者的生存期较完全引流明显缩短,特别在经皮肝穿刺胆道造影(PTC)胆管显影了却没有得到引流时[4],除了会造成未被引流胆管区域的肝脏功能损害外还可引起胆管炎、肝脓肿[5],影响进一步的抗肿瘤治疗和患者的预后。说明梗阻胆管的完全引流具有重要的临床意义[6]。也有人认为只要被引流的肝脏达到1/3就能满足人体代谢的需要[7]。而内引流符合人的生理需要,避免了外引流导致胆汁外失、肠道内环境改变、护理困难等缺点,所以笔者认为3支主要胆管(右前叶、右后叶及左叶)中能建立较好的内引流的就应争取内引流,即便只有一支能内引流也不应放弃。
“Y”形支架的植入维持了胆汁正常引流的生理腔道,实现了最大程度的胆管内引流。在治疗肝门部胆管梗阻时可采用2枚支架并排放置或先放置1枚支架,再从其网眼中植入第2枚支架。前者放置时要求2枚支架同材质,同直径,释放时由远及近,支架的远端并行足够长度,笔者一般主张不少于2cm,两位术者同时释放,避免先膨胀的支架压迫另一支架开口导致其膨胀不全或影响另一支架的操作。并行放置支架操作比较简单、快捷,但支架并行部分要求肝总管直径足够大并适当减小支架内径,以免对局部胆管壁产生严重压迫,引起炎性水肿等不良反应[8]。即便这样也会对胆汁的流动也会产生影响,这就要求术中充分对淤积胆汁进行置换,即先抽出淤积胆汁,再用生理盐水进行冲洗,这样既清除了含较多有形成分的淤积胆汁又避免了胆汁逆行感染,必要时还需要留置一外引流管,待引流出黄色新鲜胆汁后再拔除引流管。而后者2枚支架的直径可以根据胆管粗细选择。为了利于扩张网眼,最好选择不短缩的激光切割支架,不用编织支架,这就要求放置支架时定位更准确。为了避免支架远端留在穿刺道内,穿刺肝内胆管的位置尽量距狭窄近端远一些,并在植入支架前反复造影证实及准确测量。
术中寻找梗阻胆管的开口及导丝是否能通过梗阻段是整个手术成功的关键,穿刺前应熟悉胆系及肝内血管的走行,以免造成胆管出血甚至假性动脉瘤或胆汁瘘的出现,本组即有1例穿刺过程中累及肝内小血管造成胆管出血。尽量选用“J”形超滑导丝,最好不用直头导丝,导丝通过梗阻段时应轻柔操作,仔细捻转导丝并稍加推力,切忌强行推进,避免造成假道或穿孔,严重者形成胆汁瘘或胆汁瘤。导丝越过梗阻段后,应沿导丝送入造影导管,造影证实导管在胆管内后方可进行球囊扩张。梗阻严重的病例,在导丝过狭窄段困难时,可先行外引流3~10天,胆汁引流后黄疸指数下降,肝功能恢复,全身症状改善,胆管内压力及张力减低,胆管壁水肿消退,导丝较易通过阻塞段,个别原来阻塞的胆管可以再通,此时经皮穿肝通道已建立,置放支架容易,病人出血少,痛苦轻[9]。如胆道梗阻和并胆道感染,亦可先置入外引流或内外引流,待黄疸减退感染控制一周后再置入支架[10]。
支架植入解决胆管梗阻后,对肿瘤本身的治疗成为主要任务,因为抑制肿瘤的生长可以部分减缓支架再狭窄的发生,同时肿物的缩小既改善了患者基本情况也解除了对支架的压迫。原发肿瘤不同,抗肿瘤治疗的治疗方法也不同。由于肿瘤本身已无法切除,介入治疗就成为一种不错的选择。对富血供的肿瘤进行肝动脉化疗栓塞疗效显著,本组行化疗栓塞病例1月后CT复查,肿块体积较前缩小,碘油沉积就好;对乏血供的胆管癌或转移癌行经皮穿刺125I粒子植入术,持续释放的射线可较大程度地杀灭肿瘤,一定程度上延长了胆管支架的通畅时间。本组2例支架再狭窄病例均未行抗肿瘤治疗,具体抗肿瘤治疗对此影响多大,因样本量较小还无法定论,但许庆华等[11]研究认为支架术后是否结合化疗是影响胆道金属支架治疗恶性梗阻性黄疸患者预后的独立因素。
总之,肝门部胆管狭窄可通过放置“Y”形支架来开通左右支胆管梗阻,缓解肝门部胆管梗阻近期疗效显著,提高了患者生存、生活质量,为原发肿瘤的治疗创造了条件,而后者的实施也大大提高了此类病人的综合疗效。但支架内再梗阻仍是影响中远期疗效和临床亟待解决的难题,一旦出现再狭窄需要重新穿刺引流,且操作难度加大。本组2例支架再狭窄病人因患者体质较差,均未再次支架植入,而选择了单纯外引流术。
[1] Pinol V,Castells A,Bordas JM,et al.Percutaneous self-expanding metal stents versus for treating malignant biliary obstruction:randomized clinical trial[J].Radiology,2002,225(1):27-34.
[2] Shigeta H,Nagino M,Kamiya J,et al.Bacteremia after hepatectomy:an analysis of a single center,10-year experience with 407 patients[J].Lang beck Arch Surg,2002,387(3-4):117-124.
[3] 戴定可.翟仁友.于平.胆管内支架治疗肝门部胆管梗阻[J].临床放射学杂志.2006,25(10):949-951.
[4] Chang WH,Kortan P,Haber GB.Outcome in patients with bifurcation tumors who undergo unilateral versus bilateral hepatic duct drainage.Gastrointest Endosc,1998,47:354.
[5] Costamagna G,Tringali A,Petruzziello L,et al. Hilar tumours.Can J Gastroenterol,2004,18(7):451-454.
[6] Lee BH,Choe DH,Lee JH,et al.Metallic stents in malignant biliary obstruction,prospective long-term clinical results.AJR,1997,168:741-745.
[7] Cowling MG,Adam AN.Internal stenting in malignant biliary obstruction.World J Surg,2001,25:355.
[8] 李佳睿.王大伟.兰文婧等.经皮肝穿刺胆道多支架置入治疗肝门部恶性胆管梗阻19例[J].中国老年学杂志.2009,29(15):1948-1950.
[9] 张希全.孙晶华.鹿咏红等.经皮肝途径胆道内支架置入术治疗恶性胆管梗阻(附57例报告)[J].放射学实践.2002,17(3):97-99.
[10] Zhai Renyou,Qian Xiaojun,Dai Dinkg,et al.Malignant biliary obstuction: treatment with interventional radiology[J].Chin Med J,2003,116:889-892.
[11] 许庆华.刘鹏飞.项斌等.胆道金属支架治疗恶性梗阻性黄疸的预后因素分析[J].南京医科大学学报(自然科学版)[J].2009,29(8):1185-1187.
