应用PCR-DGGE技术对发酵全混合日粮中可培养乳酸菌的调查
2010-04-17王福金西野直树王靖宇
王福金 西野直树 王靖宇
(1.大连医科大学实验动物中心,大连 116044;2.国立冈山大学自然科学与技术研究生院分子生物学科,日本冈山700- 8530)
应用PCR-DGGE技术对发酵全混合日粮中可培养乳酸菌的调查
王福金1西野直树2王靖宇1
(1.大连医科大学实验动物中心,大连 116044;2.国立冈山大学自然科学与技术研究生院分子生物学科,日本冈山700- 8530)
为了了解发酵全混合日粮(TM R silage)发酵过程中的乳酸菌的菌种变化,应用MRS琼脂培养基对新鲜啤酒糟和豆腐渣以及它们的发酵 TM R(贮存0、14和56 d)的乳酸菌进行培养,所得的可培养乳酸菌应用PCRDGGE进行筛选,对菌体DNA的碱基序列进行测定,在GenBank上检索相近的16S rDNA序列对其鉴定。结果表明:2种原料中的乳酸菌种类完全不同;加入相同的其他材料变成TM R后,优势乳酸菌发生改变;发酵初期(14 d)的2种发酵TMR中都有2种乳酸菌,并且有1种乳酸菌相同;发酵后期(56 d)的2种发酵TM R中都有5种乳酸菌,而且有4种乳酸菌相同。由此可知,采用不同食品废弃物所制作的发酵TMR,在发酵后期所含菌种趋于相同、种类增加。
PCR-DGGE;发酵 TM R;可培养乳酸菌;分离;鉴定
普通的发酵青贮料(silage)中,与饲料发酵有关的有乳杆菌属(Lactobacillus)、明串球菌属(Leuconostoc)、乳球菌属(Lactococcus)、肠球菌属(Enterococcus)、片球菌属(Pediococcus)以及魏斯氏菌属(Weissella)的乳酸菌[1-5]。这些乳酸菌在不同的发酵期,其优势菌也有所不同,在发酵初期以乳酸球菌为优势菌,但随着发酵进程优势减弱,到后期由乳酸杆菌取代[6],而在发酵全混合日粮(TMR silage)中的乳酸菌种类、数量等问题却知之甚少。2003年Nishino等[7]从发酵TMR中分离出布赫纳乳杆菌(Lactobacillusbuchneri)以来,陆续有干酪乳杆菌(Lactobacillus casei)、魏斯氏菌(Weissella spp.)、发酵乳杆菌(Lactobacillus fermentum)、短乳杆菌(Lactobacillus brevis)、胚芽乳杆菌(Lactobacillus plantarum)、乳酸片球菌(Pediococcus acidilactici)等乳酸菌被发现[8-9],但在TMR发酵各时期的乳酸菌种的变化尚不清楚。因此,本试验利用PCRDGGE技术对发酵TMR在发酵各时期的乳酸菌种类进行了分离,为寻找出提高发酵TMR好气安定性的菌种,开发调制发酵TMR所使用的添加剂提供理论依据。
1 材料与方法
1.1 发酵TMR的调制与贮存
采用新鲜的啤酒糟或豆腐渣(占50%),配以干苜蓿草、干苏丹草、玉米、麦麸、干甜菜渣、糖蜜和豆粕,调制成2种 TMR(表1)。将调好的TMR材料300 g,放入0.05mm厚的塑料袋(27mm×39mm)中真空密封,保存在 25℃恒温室内,贮存 0、14和56 d。
1.2 乳酸菌的培养与分离
取新鲜的啤酒糟、豆腐渣、贮存0、14和56 d的2种发酵TMR各20 g,加入180 m L生理盐水,震荡10m in,在无菌状态下,将溶菌液等比以10倍梯度逐级稀释至10-7,再将各浓度的溶菌液在培养皿中与加热融化的MRS琼脂培养基充分混合,待琼脂凝固后,移至30℃培养箱中培养3 d。
在每种样本的固体培养皿中,挑选有20~30个菌落的培养皿任意钓取10个菌落接种于液体MRS琼脂培养基中提纯,培养3 d继代1次,共继代3次,菌液50μL与10%灭菌脱脂奶粉混匀,-21℃保存。
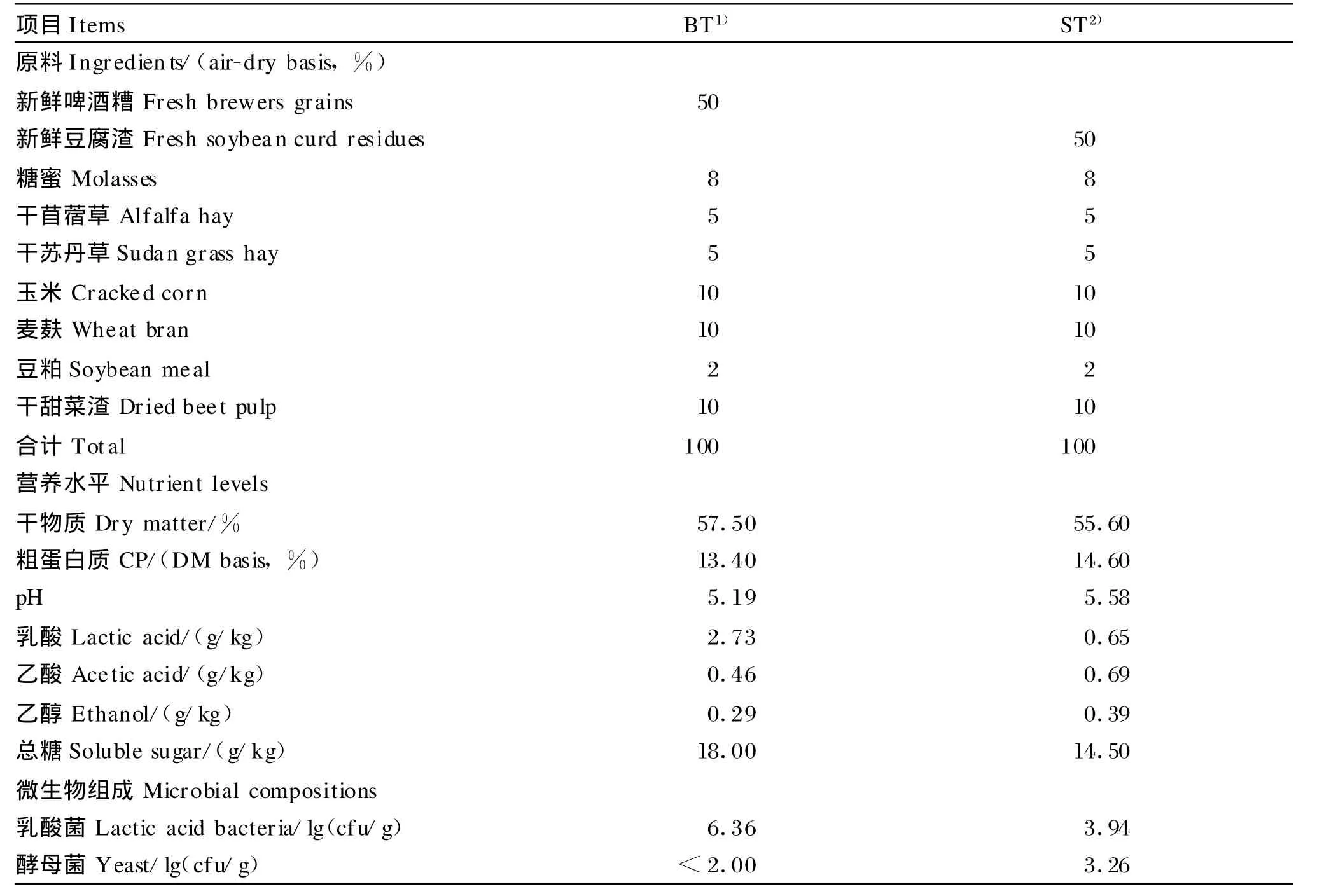
表1 2种TMR的成分、营养水平及微生物组成Tab le 1 Ingredients,nutrient levels and m icrobial compositions of tw o TMR
1.3 乳酸菌DNA的提取
将液体培养液在8 000 r/m in、4℃的条件下离心15 m in获得菌体。应用 DNeasy Tissue K it(QIAGEN,美国)试剂盒提取乳酸菌DNA,-21℃保存。
1.4 乳酸菌种类的筛选
提取的细菌DNA应用PCR在16s rDNA的V 3 领 域增 幅,引 物 为 GC357 f(5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCCTACGGGAGGCAGCAG-3′) 和 517r(5′-ATTACCGCGGCTGCTGG-3′),采 用 30 次循环进行增幅(TP650,TaKaRa公司,日本),产物为160 bp。应用 DGGE(DCode Universal M utation System Bio-red公司,日本)对PCR增幅产物进行电泳分离,浓度梯度为25%~50%,条件为150V、12 h 、60 ℃。
筛选标准:电泳后凝胶中条带处于同一水平线上的为同一菌种,只取1个样本备用,其余舍弃;对于不同水平线上的,全部留用,以备下一步DNA的鉴定。
1.5 乳酸菌的鉴定
将筛选后的细菌DNA应用PCR的Bye Dye 25法,使其在全域增幅,引物为27 f(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1 492r(5′-GGCTACCTTGTTACGACTT-3′)。PCR 产物经处理后在ABIPRISMTM310Genetic Analyzer(ABIApp lied Biosystems,美国)进行碱基序列测定,所得结果在GenBank中进行检索,确定细菌的种类和名称(整个试验过程见图1)。
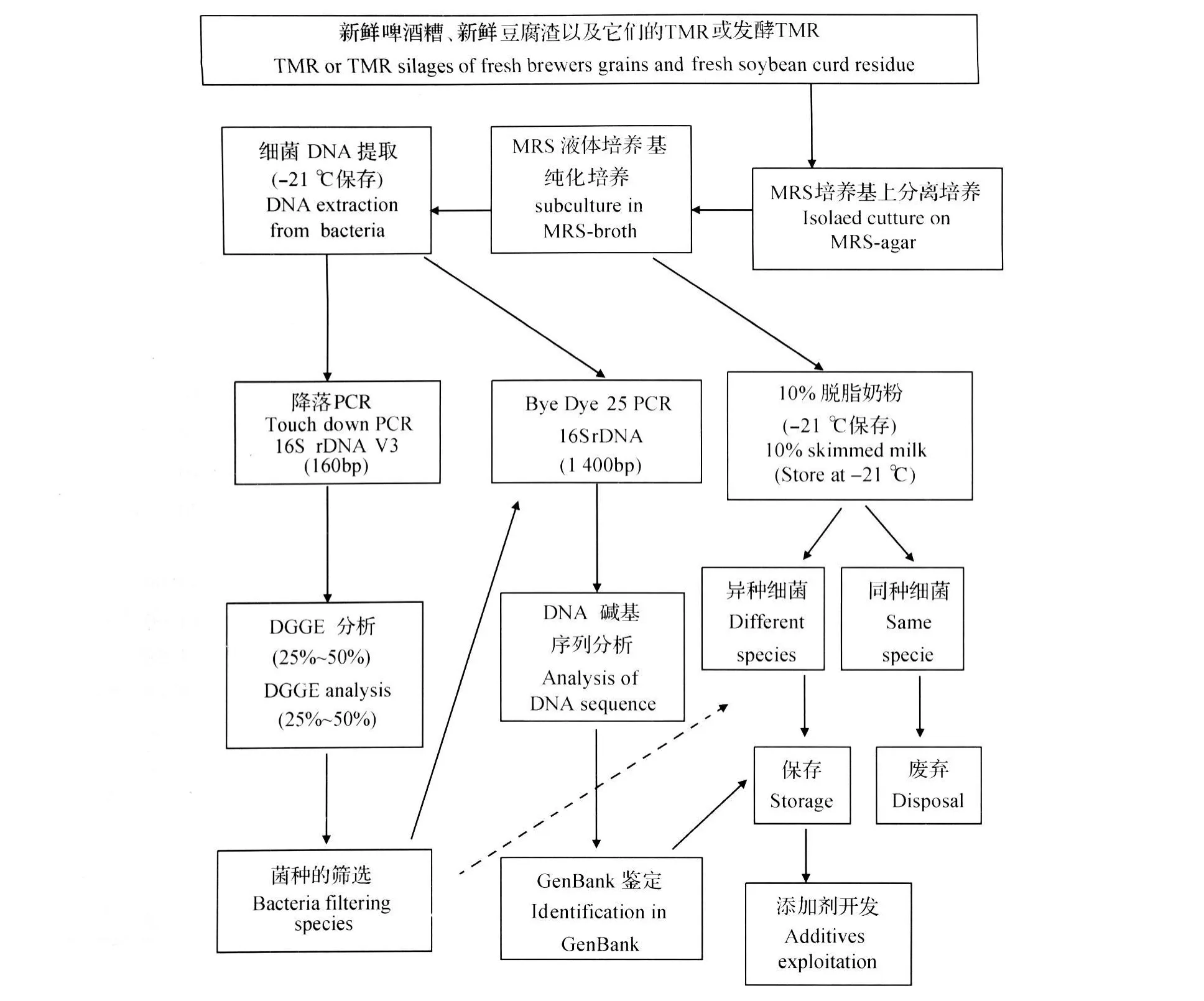
图1 试验的流程图Fig.1 Schematic flow of the experiment
2 结 果
本次试验所获得的DGGE的DNA电泳条带如图2、图3和图4所示,图中的DNA条带通过碱基序列测定后,在GenBank中的检索结果见表2。
2.1 新鲜啤酒糟和豆腐渣及其发酵TMR中的可培养乳酸菌
在新鲜的啤酒糟的10个样本中检出了发酵乳杆菌和副干酪乳杆菌(Lactobacillus paracasei)2种乳酸菌(图2),其中后者为优势菌(表3)。加入其他材料混合成TMR后菌种发生了变化,10个样本中副干酪乳杆菌未被检出,而出现了德氏乳杆菌(Lactobacillus delbrueckii),并与发酵乳杆菌一起构成优势菌。新鲜的啤酒糟与其发酵TMR中都有共有的一个菌种是发酵乳杆菌。
同样,在新鲜豆腐渣10个样本中检出3种乳酸菌,胚芽乳杆菌、假肠膜明串珠菌(Leuconostoc pseudomesenteroides)和魏斯氏菌(图2),其中前者为优势菌(表3)。加入其他材料后菌种发生变化,10个样本中检出胚芽乳杆菌、发酵乳杆菌和牛链球菌(Streptococcusbovis)3种乳酸菌,其中前两者一起构成优势菌(表3)。新鲜豆腐渣与其发酵 TMR中也有一共同菌种发酵乳杆菌,但和啤酒糟与其TMR中所含菌种不同。
2.2 贮存14 d的发酵TMR中的可培养乳酸菌
在所有发酵14 d的含有啤酒糟的发酵 TMR的30个样本中,只有2种乳酸菌胚芽乳杆菌和短乳杆菌被检出(图3),其中前者为优势菌(表3)。
同样,在发酵14 d的豆腐渣发酵TMR的30个样本中,也只有假肠膜明串珠菌和胚芽乳杆菌2种乳酸菌被检出见(图3),其中前者数量多,为优势菌(表3)。
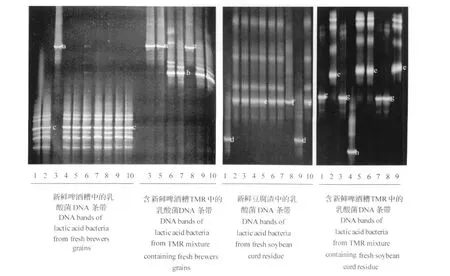
图2 新鲜啤酒糟和豆腐渣以及其TMR中的乳酸菌DNA条带Fig.2 DNA-bands of lac tic acid bacteria of fresh brewers grains,fresh soybean curd residues and their TMR
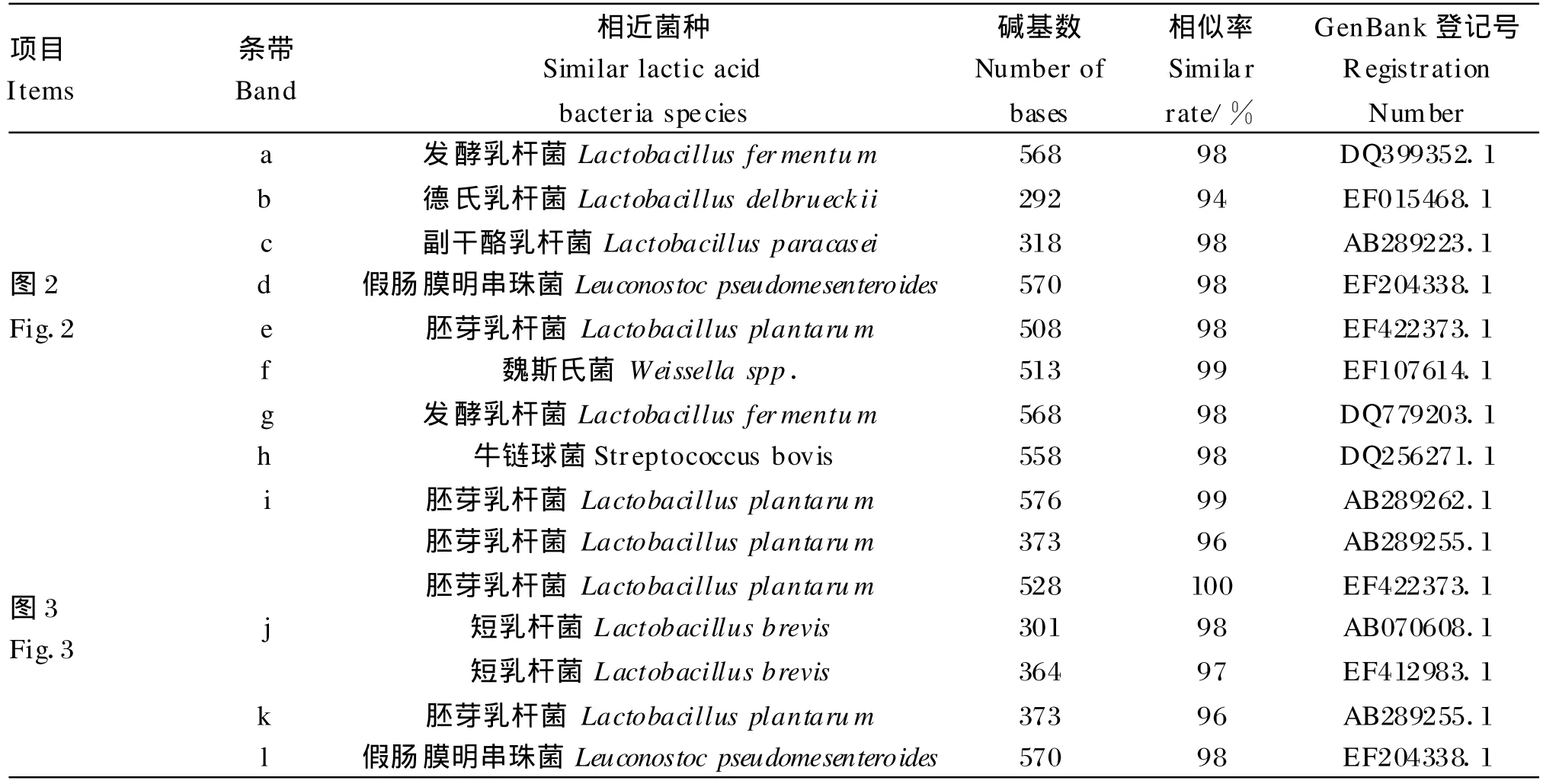
表2 碱基序列测定结果与在GenBank中检索到的乳酸菌的相似率Table 2 Sim ilar rate of searched lac tic acid bac teria in GenBank and result of determ ination of base sequence
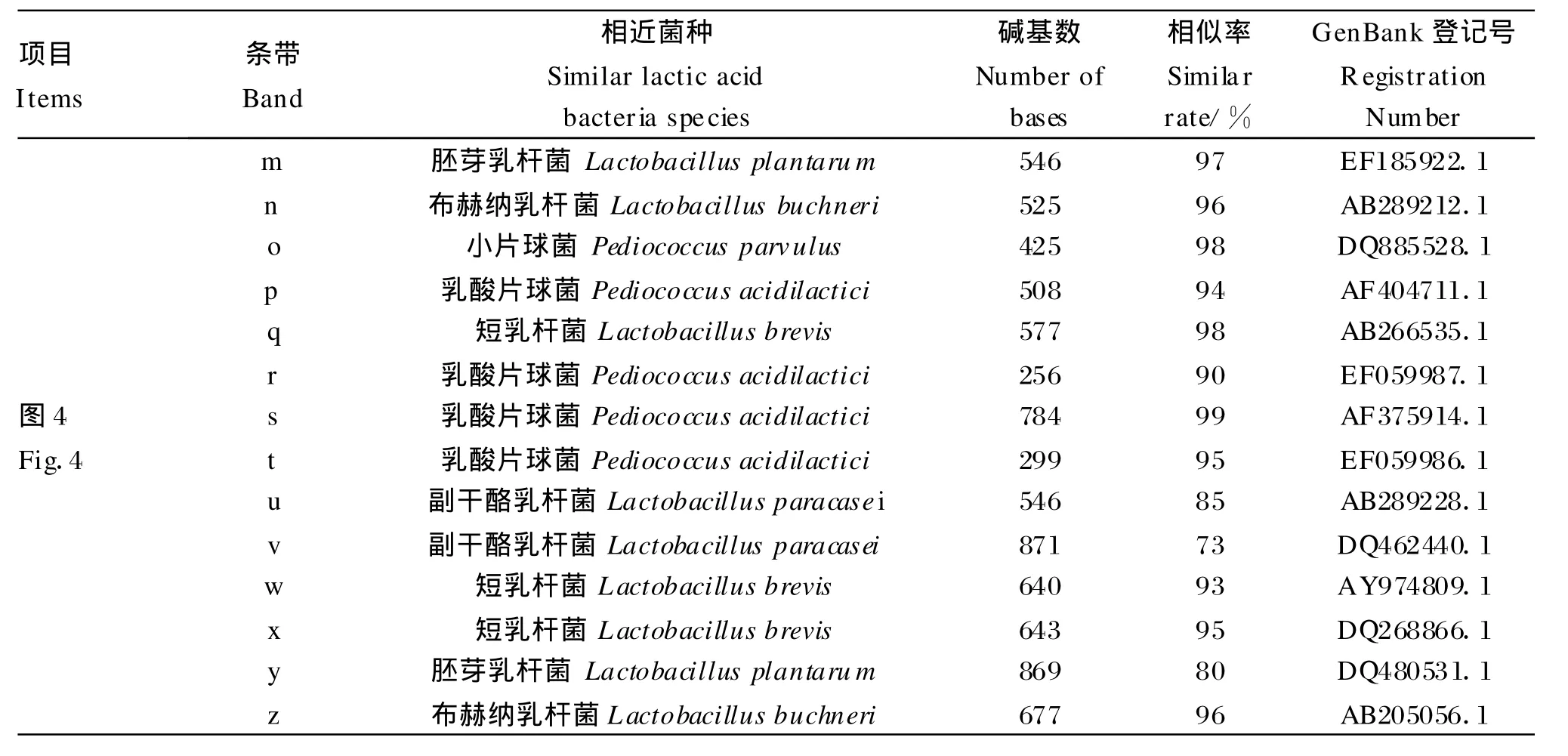
项目Items条带Band相近菌种Sim ilar lactic acid bacteria species碱基数Number of bases相似率Sim ilar rate/%GenBank登记号Registration Num ber m 胚芽乳杆菌 Lactobacillus plantarum 546 97 EF185922.1 n 布赫纳乳杆菌Lactobacillus buchneri 525 96 AB289212.1 o小片球菌 Pediococcus parvulus 425 98 DQ885528.1 p 乳酸片球菌Pediococcus acidilactici 508 94 AF404711.1 q短乳杆菌Lactobacillus brevis 577 98 AB266535.1 r图4 Fig.4乳酸片球菌Pediococcus acidilactici 256 90 EF059987.1 s乳酸片球菌Pediococcus acidilactici 784 99 AF375914.1 t 乳酸片球菌Pediococcus acidilactici 299 95 EF059986.1 u副干酪乳杆菌Lactobacillus paracase i 546 85 AB289228.1副干酪乳杆菌Lactobacillus paracasei 871 73 DQ462440.1 w短乳杆菌Lactobacillus brevis 640 93 AY974809.1 v x 短乳杆菌Lactobacillus brevis 643 95 DQ268866.1 y胚芽乳杆菌 Lactobacillus plantarum 869 80 DQ480531.1 z 布赫纳乳杆菌Lactobacillus buchneri 677 96 AB205056.1
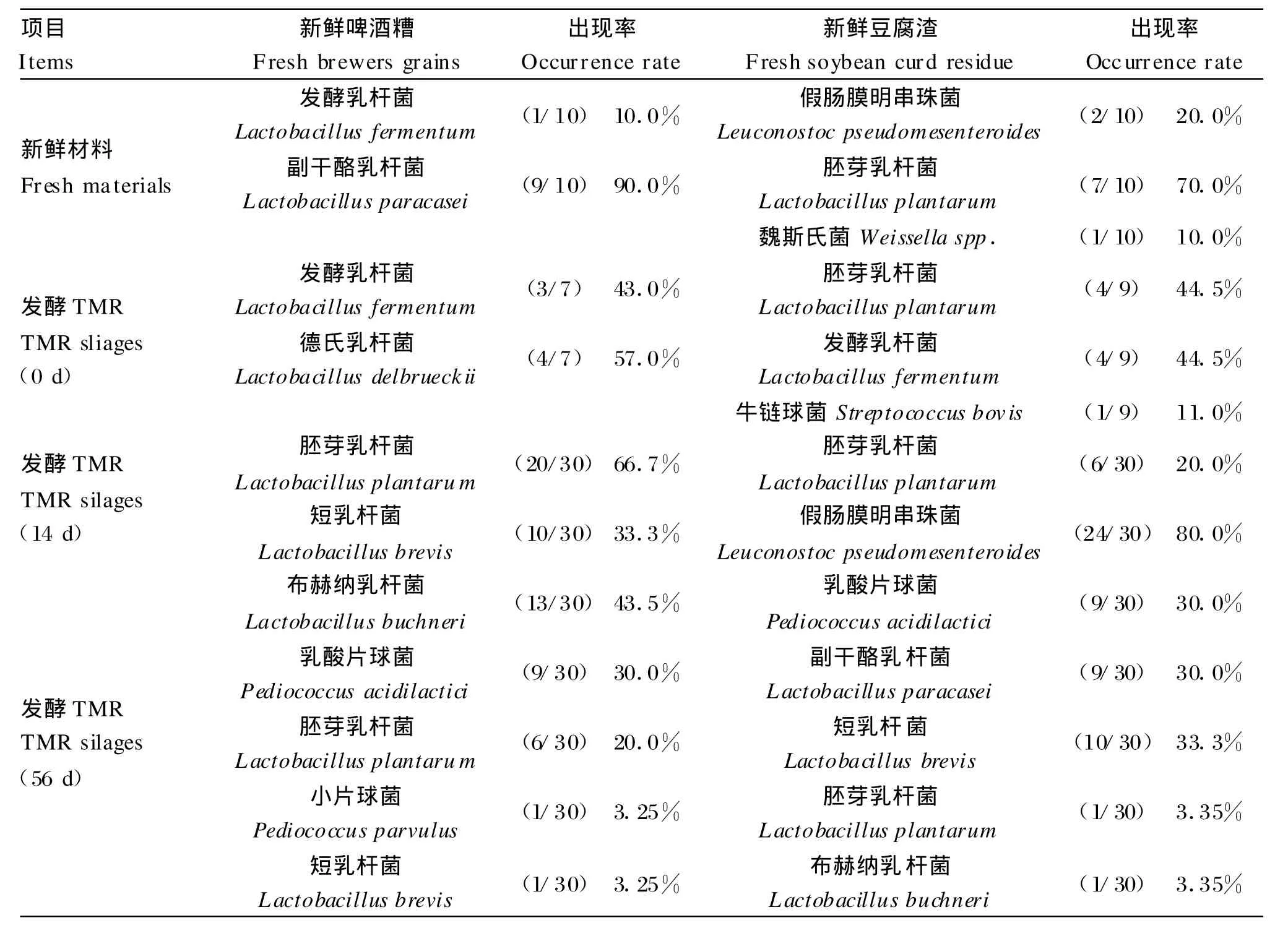
表3 2种材料及其发酵TM R中的乳酸菌的种类Tab le 3 Lactic acid bacteria species of tw om aterials and their TMR by identification
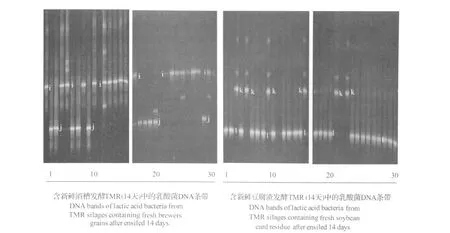
图3 贮存14 d的2种发酵TMR中的乳酸菌DNA条带Fig.3 DNA bands of lactic acid bacteria of two TMR silages after ensiled for 14 days
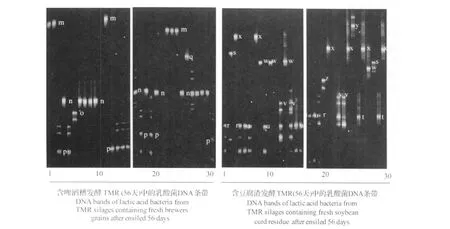
图4 贮存56 d的2种发酵TMR中的乳酸菌DNA条带Fig.4 DNA bands of lactic acid bacteria of two TMR silages after ensiled for 56 days
同时2种发酵TMR中都有一共同的菌种胚芽乳杆菌。
2.3 贮存56 d的发酵TMR中的可培养乳酸菌
在发酵56 d的含啤酒糟发酵TMR的30个样本中检出5种乳酸菌(图4),其中布赫纳乳杆菌含量最多,乳酸片球菌和胚芽乳杆菌次之,小片球菌(Pediococcus parvu lus)和短乳杆菌最少(表3)。
而在发酵56 d的含豆腐渣发酵TMR的30个样本中也检出5种乳酸菌(图4),其中短乳杆菌、乳酸片球菌和副干酪乳杆菌较多,胚芽乳杆菌和布赫纳乳杆菌最少(表3)。
值得关注的是2种发酵 TMR之间,竟有布赫纳乳杆菌、乳酸片球菌、胚芽乳杆菌和短乳杆菌 4种共同含有的乳酸菌;占所含菌量的96.5%(含啤酒糟发酵TMR)和70.0%(含豆腐渣发酵TMR)。
3 讨 论
乳酸菌是一种过氧化氢酶阴性菌,通常情况下只能在厌氧条件下存活。但乳酸菌可以将部分的氧的毒性排出体外,当与氧气接触时,不能像绝对厌氧菌那样完全死亡[10]。因此,自然界存在着许多乳酸菌,由于有氧状态限制了它们的繁殖,它们地域和附着物种的不同所存在的菌种也不同,本次试验中的材料新鲜啤酒糟和豆腐渣中的优势乳酸菌的不同,也说明了这一点。当2种新鲜材料与同样的其他材料混合形成2种TMR时,优先乳酸菌种也发生了变化,由于是有氧状态乳酸菌不能大量繁殖,因此,结果表明是其他材料中所附着的乳酸菌造成的,2种TMR(贮存14 d)中共同含有1种乳酸菌发酵乳杆菌也说明了这一点。
内田仙二[11]曾报道,发酵青贮饲料在厌氧发酵过程中,材料上所附着的乳酸菌的不同,不同乳酸菌所利用的糖及有机酸的基质也不同,所产生的乳酸、乙酸、丙酸等生成物的比例也不同。从这次试验结果来看,在贮存14 d的2种发酵TMR中各自检出2种乳酸菌,而在贮存56 d的2种发酵TMR中各自检出5种乳酸菌。因此,发酵 TMR中的乳酸菌的变化,不是简单的材料上附着的优势菌的扩繁,而是同一乳酸菌种间优势竞争的、此消彼长的动态平衡状态。
从以前的试验结果来看,发酵过程中乳酸菌数量是低(贮存0 d)、高(贮存初期)、低(贮存后期)的变化规律[9,12-15],结合本次试验结果,贮存初期(14 d)乳酸菌数量大,但菌种类少;而贮存后期(56 d)时数量上有所减少,但菌种数量增加。说明在发酵TMR的发酵初期,一些适应这一环境的乳酸菌迅速繁殖,数量上增加,但到发酵后期环境(pH、养分等)的变化,它们的繁殖也受到了限制,数量有所减少,而其他乳酸菌量得以扩充,达到多种乳酸菌共同处于优势的状态。但2种发酵TMR中的乳酸菌种趋于相同,这为发酵TMR菌种添加剂的研制提供了可靠的依据。
本试验是在发酵TMR开封后有氧状态下进行的,有可能忽略了一些对氧敏感的乳酸菌;另外对1个样本的培养皿中只钓取10个菌落进行鉴定,有可能漏掉一些已培养的乳酸菌,因此在今后的试验方法上还需要进一步改进与探讨。
4 结 论
采用50%的新鲜啤酒糟和50%的新鲜豆腐渣,再配以相同的其他材料所制成的2种发酵TMR,在发酵过程中随着发酵时间的延长,所含乳酸菌的种类逐渐增多,而且乳酸菌菌种有趋于相同的趋势。
[1] 蔡義民.サイレージ乳酸菌の役割と高品質化調製[J].日本草地学会誌,2001,47:527-533.
[2] CA IY,KUMA IS,ZHANG J,et al.Com parative studies of Lactobacilli and Enterococci associated with forage crops as silage inocu lants[J].Animal Sc ience Journal,1999a,70:188-194.
[3] CA I Y,BENNO Y,OGAWA M,et al.Effect of applying lactic acid bacteria isolated from forage crops on ferm entation characteristics and aerobic deterioration of silage[J].Journal of Dairy Science,1999b,82:520-526.
[4] ZHANG J,CA I Y,KOBAYASH I R,et al.Characteristics of lactic ac id bacteria iso lated from forage crops and their ef fec ts on silage fermentation[J].Journal of the Science of Food and Agriculture,2000,80:1455-1460.
[5] ENNAHAR S,CA I Y,FUJITA Y.Phylogenetic diversity of lactic acid bacteria associated with paddy rice silage as determ ined by 16S ribosomal DNA analysis[J].Applied and Environm ental Microbio logy,2003,69:444-451.
[6] 増子孝義.サイレージの発酵[M]∥内田仙二.サイレージ科学の進歩,東京:デーリィ,1999:86-89.
[7] N ISH INO N,YOSH IDA M,SH IOTA H,et al.A ccumulation of 1,2-propanediol and enhancem ent of aerobic stability in w hole crop m aize silage inoculated with Lac tobacillus bucheri[J].Journal of Ap-p lied Microbiology,2003,94:800-807.
[8] N ISH INO N,WADA H,YOSH IDA M,et al.Microbial counts,fermentation products,and aerobic stability of w hole crop corn and a totalm ixed ration ensiled with and without inoculation of Lactobacillus casei or Lactobacillus buchneri[J].Journal of Dairy Science,2004,87:2563-2570.
[9] W ANG F J,N ISH INO N.Ensiling of soybean curd residue and wetbrewers grainswith or without other feeds as a total m ixed ration[J].Journal of Dairy Science,2008,91:2380-2387.
[10] 岡田早苗.乳酸菌の定義と分類,同定[M]∥乳酸菌研究集談会.乳酸菌の科学と技術,東京:学会出版センター,2003:9-16.
[11] 内田仙二.サイレージ研究の進展と課題[M]∥内田仙二.サイレージ科学の進歩,東京:デーリィ■ジャパン,1999:24-32.
[12] NISH INO N,HARADA H,SAKAGUCH I E.Evaluation of fermentation and aerobic stability of w et brewer's grains ensiled alone or in combination with various feeds as a total m ixed ration[J].Journal of the Science of Food and Agriculture,2003,83:557-563.
[13] NISHINO N,WADA H,YOSHIDA M,et al.Microbial counts,fermentation products,and aerobic stability of who le crop corn and a totalm ixed ration ensiled with and without inoculation of Lactobacillus caseior Lactobacillus buchneri[J].Journal of Dairy Sc ience,2004,87:2563-2570.
[14] NISH INO N,HATTORI H.Resistance to aerobic deterioration of totalm ixed ration silage inoculated with and without homofermentative or heterofermentative lac tic acid bacteria[J].Journal of the Science of Food and Agricu lture,2007,87:2420-2426.
[15] WANG F J,NISHINO N.Resistance to aerobic deterioration of totalm ixed ration silage:effect of ration formulation,air in filtration and storage period on fermentation characteristics and aerobic stability[J].Journalof the Science of Food and Agriculture,2008,88:133-140.
Au thor,WANG Fujin,associate professor,E-mail:w angfujin2000@qq.com
(编辑 王智航)
Investigation of Cultivab le Lactic Acid Bacteria in TotalMixed Ration Silages by PCR-DGGE Technique
WANG Fujin1NISHINO Naoki2WANG Jingyu1
(1.Laboratory Animal Center,Dalian Medical University,Dalian116044,China;2.Depar tment of Biomolecular Science,Graduate School of Natural Science and Technology,Okayama University,Okayama700-8530,Japan)
To understand the change of lactic acid bacteria during totalm ixed ration(TM R)silages ensiled process,M RSagar was used to cultivate and separate lac tic acid bacteria from fresh brew ers grains,soybean curd residue and their TMR silages(stored for 0 day,14 and 56 days);These cultivab le lactic ac id bacteria were screened by PCR-DGGE,and then the p roducts were analyzed for bac terial DNA sequences.GenBank database w as searched to determ ine the closest relatives of 16S rDNA sequences to identity them.The results show ed that the lactic acid bacteria were dif ferent between fresh brew ers grains and soybean curd residue;and the p redom inant lactic ac id bacteria species were altered w hen they were m ixed with other materials.There were two species of lac tic acid bac teria in both of the tw o TMR silages in the initial period of fermentation,and one species was the sam e between the tw o TMR silages;but five species of lactic acid bacteriawere found in the two TMR silages in later fermen tation,and four specieswere the sam e between the two TMR silages.In conclusion,lactic acid bacteria species tend to be the sam e,and species types increase in later fermentation w hen using different food by-products to make TM R silages.[Chinese Journal of Anima l Nutrition,2010,22(6):1636-1643]
PCR-DGGE;TM R silage;cultivable lactic bacteria;separation;Identification
S816.3 S816.6
A
1006-267X(2010)06-1636-08
10.3969/j.issn.1006-267x.2010.06.025
2010-04-20
王福金(1964—),男,吉林通榆人,副教授,博士,主要从事动物营养研究。E-mail:wangfujin2000@qq.com
