黄鳝肠道cDNA文库构建及营养相关表达序列标签分析
2010-04-17周定刚
唐 勇 刘 旭 周定刚
(四川农业大学动物科技学院,雅安 625014)
黄鳝(Monop terus albus)是广泛分布于我国南北水域的名优水产养殖品种之一,目前其主要来源还是在天然水域,滥捕滥捞已导致其野生资源急剧下降,面临枯竭。我国人工养殖黄鳝已经有多年的历史,但一直未能形成规模,要使其成为一个真正稳定的产业,还有许多疑难问题需要解决。动物在与外界环境相互作用的过程中,主要靠消化道来完成营养物质的消化和吸收,满足机体营养代谢的需要,维持自身生命活动。黄鳝肠道内与营养代谢相关的细胞种类丰富,具有与消化相关的多种酶类[1]。肠道不仅是营养相关功能基因的主要表达中心,大量的肠上皮细胞还是消化道阻止病原体入侵的物理屏障,在生长代谢和黏膜免疫中占有相当重要的地位[2]。
构建cDNA文库是研究功能基因组学的基本手段之一。cDNA在研究某类特定细胞中基因组的表达状态及表达基因的功能鉴定方面具有特殊的优势,且出现假阳性的几率低。随着构建cDNA文库的技术方法逐步完善,近年在水产领域已陆续建立了鲤鱼(Cyprinus carpio)[3]、中华绒螯蟹(Eriocheir sinensis)[4]、草鱼(Ctenopharyngodn idellus)[5]、大海马(Hippocampus kuda)[6]、日本七鳃鳗(Lampetra japonica)[7]、大鲵(Andrias davidianus)[8]、石斑鱼(Epinephelus coioides)[9]、文昌鱼(Branchiostoma belcheri)[10]等多种重要水生经济动物不同组织的cDNA文库,并通过测序获得了大量有研究和开发价值的新基因。但目前尚未见黄鳝肠道cDNA文库构建的报道。为此,笔者以黄鳝全肠为材料,用Gateway技术构建了黄鳝肠道未剪切cDNA文库并对其进行了规模EST测序及分析,旨在为黄鳝营养代谢与免疫相关基因的筛选提供基因序列资源,并为营养代谢等相关功能基因在肠道的差异表达提供基础依据。
1 材料与方法
1.1样品及试剂
试验选择平均体重为(231±3)g的健康活体成年黄鳝3尾,分别在冰盘上取出新鲜的全肠组织,去除内容物后液氮迅速冷冻,保存于-80℃冰箱备用。
Trizol Reagent试剂盒,FastTrackTM2.0试剂盒,CloneM inerTMcDNA文库构建试剂盒,Super-Scrip tTMⅢ反转录酶,RNase H,PureLinkTMQuick Gel Extraction and PCR Purification Combo试剂盒,载体pDONRTM222,大肠杆菌感受态细胞DH10B均购自Invitrogen公司;卡那霉素(kanam ycin,Kan)和X-gal购自Sigm a公司;T4DNA连接酶和T4 DNA聚合酶购自Promega公司;其余试剂均为国产分析纯。常规溶液和试剂按《分子克隆实验指南》[11]配制。
1.2 总RNA提取与mRNA分离
采用Trizo l Reagent试剂盒一步法提取总RNA, mRNA分离按FastTrackTM2.0试剂盒说明书完成;用1%甲醛变性凝胶电泳检测总RNA和m RNA。
1.3 cDNA文库构建
以m RNA为模板,使用SuperScriptTMⅢ反转录酶和C loneM inerTMcDNA文库构建试剂盒中提供的Biotin-attB2-Oligo(dT)引物合成cDNA第1链;cDNA第2链使用DNA聚合酶Ⅰ和RNase H合成;用T4DNA聚合酶补平cDNA末端,然后用T4DNA连接酶加上attB1接头。采用PureLinkTMQuick Gel Extraction and PCR Purification Combo试剂盒分级分离纯化cDNA。
选择符合条件的cDNA进行BP重组〔利用一个attB DNA片段或表达克隆和一个attP供体载体(donor vector)之间的重组反应,创建一个入门克隆〕进入载体pDONRTM222,连接产物纯化后用电激转化仪将重组子转化到DH 10B感受态细胞,电压为2.0 kV,电击时间为5ms。
从2m L转化细菌原液中取10μL稀释1 000倍后,从中取出50μL涂布含有Kan+X-gal的LB平板,过夜培养,第2天计数。文库指标计算公式:
滴度(titer)即cDNA文库菌液的浓度(CFU/ m L)=平板上的菌落数(CFU)×稀释系数/涂板体积(m L);
库容即总克隆生成单位数(CFU)=滴度(CFU/m L)×总体积(m L)。
剩余培养物加入甘油至终浓度20%存于-80℃,即为文库菌液。随机挑取平板上阳性克隆进行插入片段的PCR鉴定。
1.4 测序与数据处理
随机挑取1 056个阳性单克隆进行5′单向测序,测序引物为M 13(5′-GTAAAACGACGGCCAG-3′),3730测序仪(ABI)测序及序列初步分析由上海英骏生物公司完成。
通过Cross_M atch程序将序列文件与载体序列进行比对,筛选并屏蔽掉载体序列,用BLASTCLUST软件采取单链法的聚类方法,通过序列间的两两比对,建立距离矩阵,把同属于一个基因的EST数据聚在一起,使用Phrap软件将待拼接序列中同属于1个转录本的EST序列联结起来,拼接形成重叠群(contig),从而降低序列的冗余。
将contig序列和单拷贝EST(singleton)序列合并,得到最终的单基因簇(unigene)序列。使用批量化b lastx和blastn程序对unigene序列进行比对,数据库选择nr和nt数据库,得到每个unigene所对应的序列相似程度最高(score>80,E<10-10)[12]的基因。BatchBLAST对unigene进行比对得到相似程度最高的基因,利用SeqGO进行功能基因的注释,得到每个基因的功能[13]。
2 结 果
2.1 总RNA提取及mRNA分离
提取的黄鳝肠道组织总RNA在1%的甲醛变性凝胶电泳图(图1)上能观察到很清晰的28S rRNA与18S rRNA、以及5S rRNA 3条带,无明显脱尾,也没有明显的基因组和蛋白质污染杂带;28S和18S的亮度比基本上为2∶1的关系,由此说明总RNA无降解,完整性比较好,适合下一步试验使用。
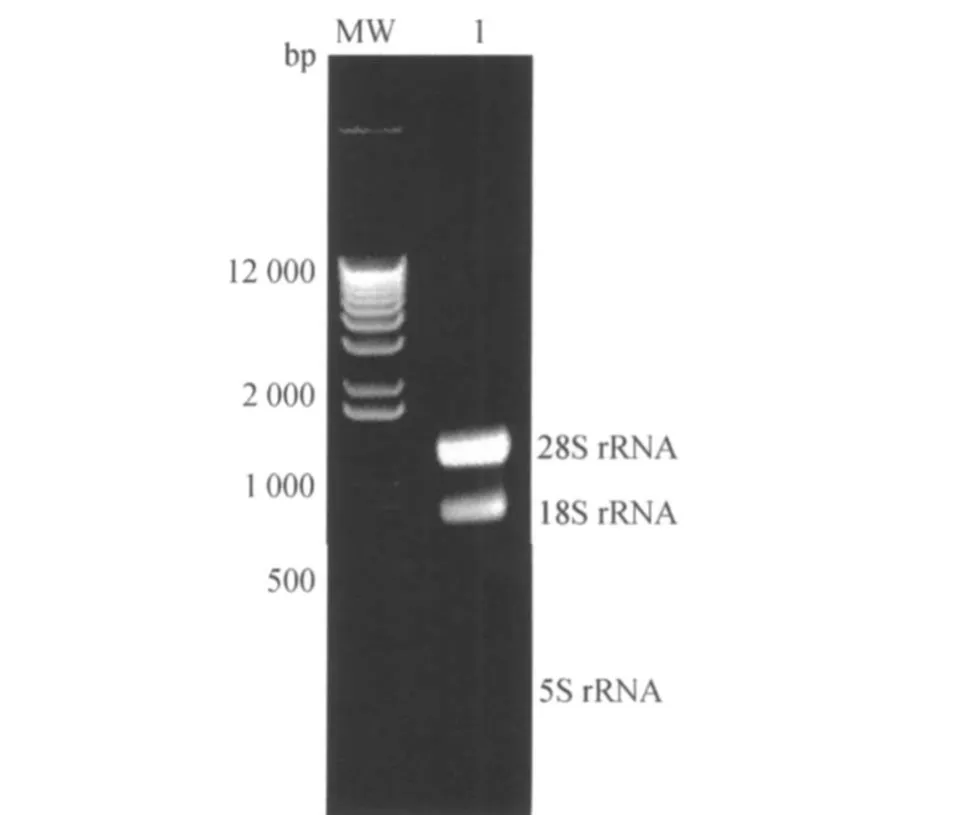
图1 总RNA的1%甲醛变性凝胶电泳Fig.1 1%formaldehyde denaturing gel electrophoresis of total RNA
分离结果显示mRNA呈弥散分布,也无降解现象,说明mRNA足够纯度,完全符合逆转录要求。
2.2 cDNA文库构建与鉴定
过夜培养后检测平板的单菌落数为364个(图2),滴度为7.28×106CFU/m L,库容量为1.46×107CFU。
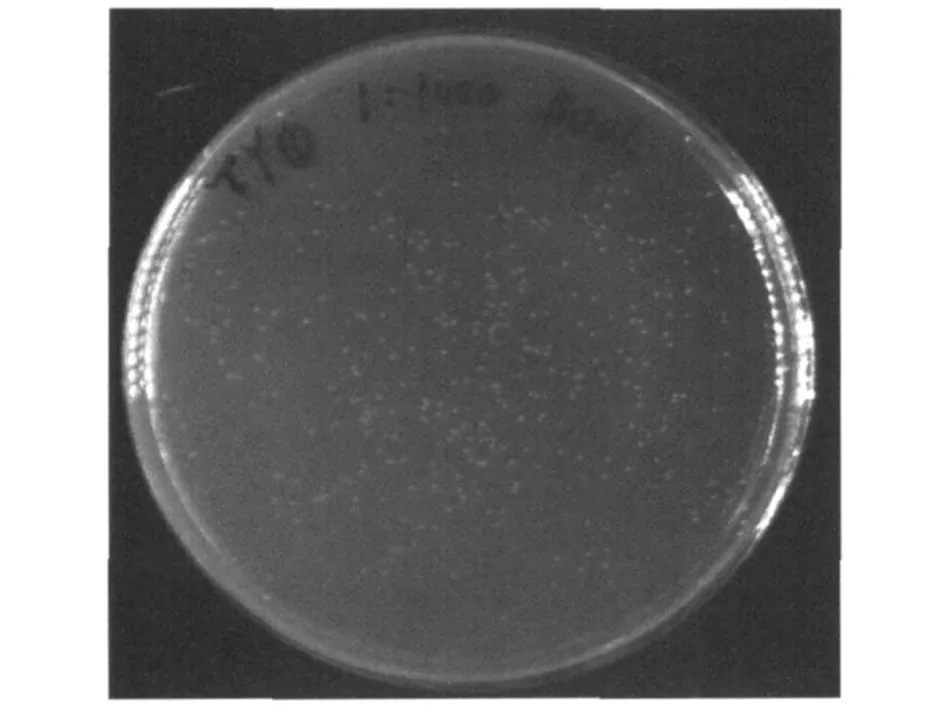
图2 cDNA文库平板计数Fig.2 Plate count o f cDNA library
2.3 重组率和插入片段的PCR鉴定
随机挑取32个克隆进行菌落PCR鉴定,电泳(图3)和统计结果表明阳性克隆率为96.88%(31/ 32),平均插入片段约2.11 kb,84.38%(27/32)的插入片段大于850 bp。
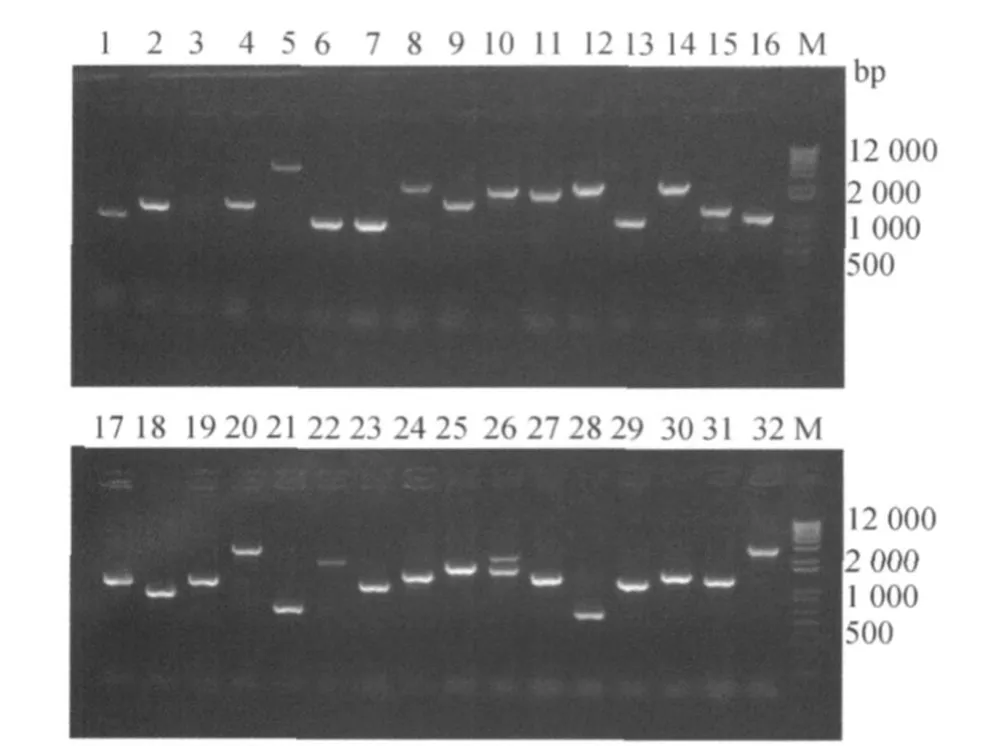
图3 黄鳝cDNA文库中32个重组克隆的PCR鉴定Fig.3 PCR analysis o f random 32 recombinant clones of the cDNA library
2.4EST测序结果
2.4.1 结果统计
测序得到1 056个序列,结果经过Sequencing A-nalysis软件以及DNA STAR软件分析,得到实际可用高质量EST序列906条(GenBank accession number:GW 584265~GW585168)。使用Phrap软件拼接(表1),拼出61个contig包含205条EST,其中包含10条以上EST的contig有4个,最多的包含19个EST(图4);singleton 701个,总计unigene 762个,由此得到冗余度为8.00%(61/762)。(795/906)的EST处于700~999 bp之间,而850~899 bp的EST最多,占25.50%(231/906)。
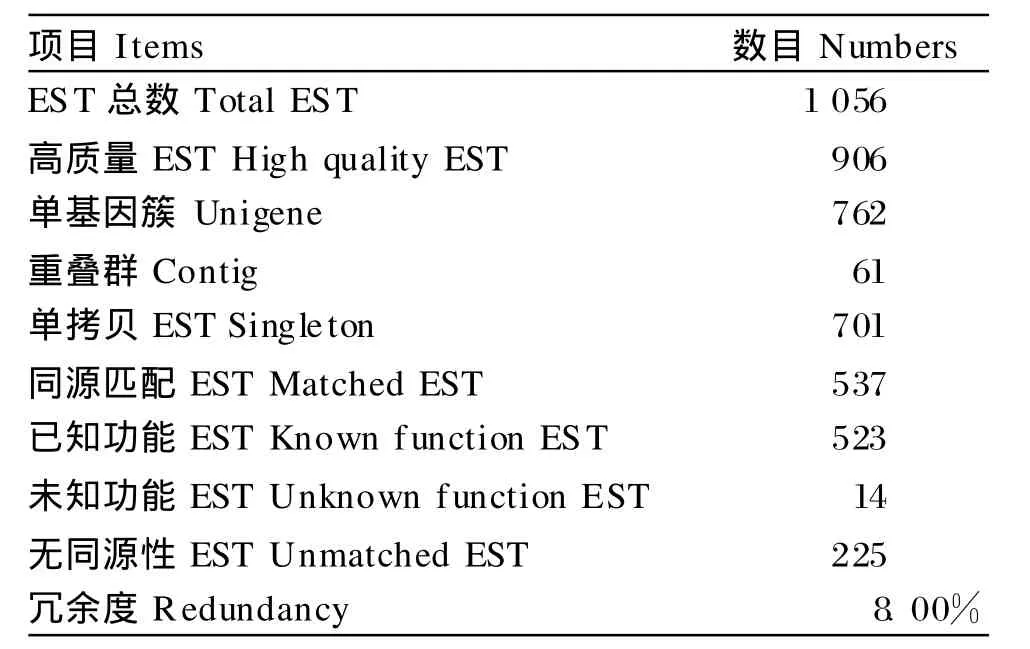
表1 黄鳝cDNA文库的EST初步统计Table 1 Prelim inary statistics of EST from the cDNA library of Monop terus albus
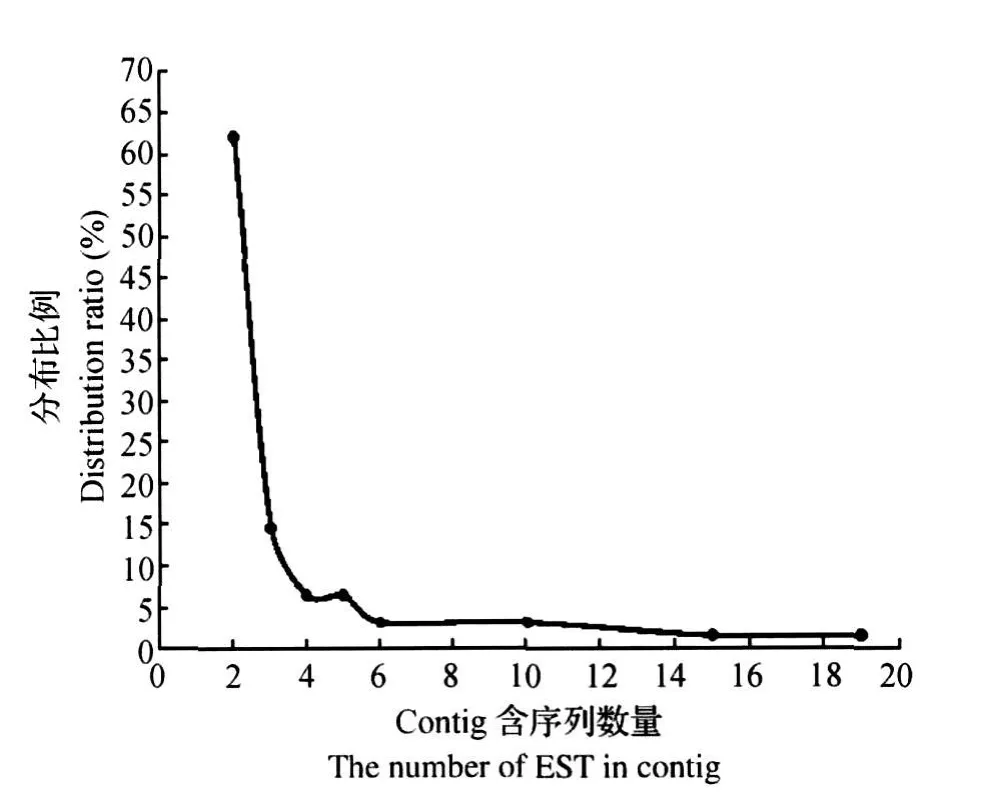
图4 Contig序列分布比例Fig.4 Distribution ratio of contig sequence
2.5 营养代谢相关EST
肠道作为主要的消化吸收场所,包含有大量与营养代谢功能相关的EST。初步统计有5类59种,其中:蛋白质/氨基酸代谢类25种,碳水化合物代谢类13种,脂类代谢类5种,能量代谢类12种,无机离子代谢类4种(表2,同种基因只列出1个EST)。其中表达量最高的是几丁质酶类,共有46个EST (5.10%,46/906);其次是胰蛋白酶原,有41个EST (4.50%,41/906)。
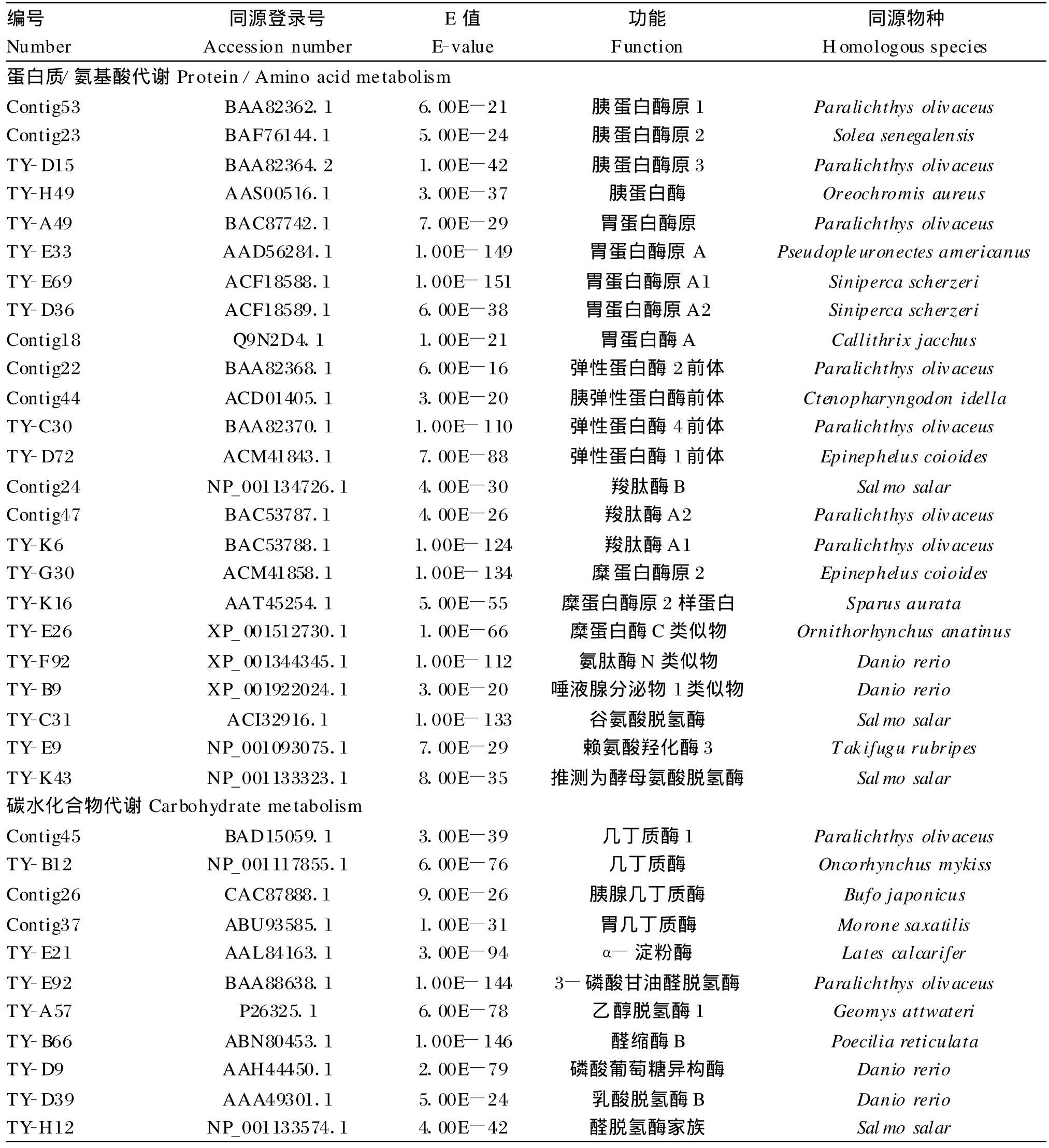
表2 黄鳝肠道cDNA文库营养代谢相关EST统计Table 2 Statistics of nutrition metabolism related EST from cDNA library of M.albus
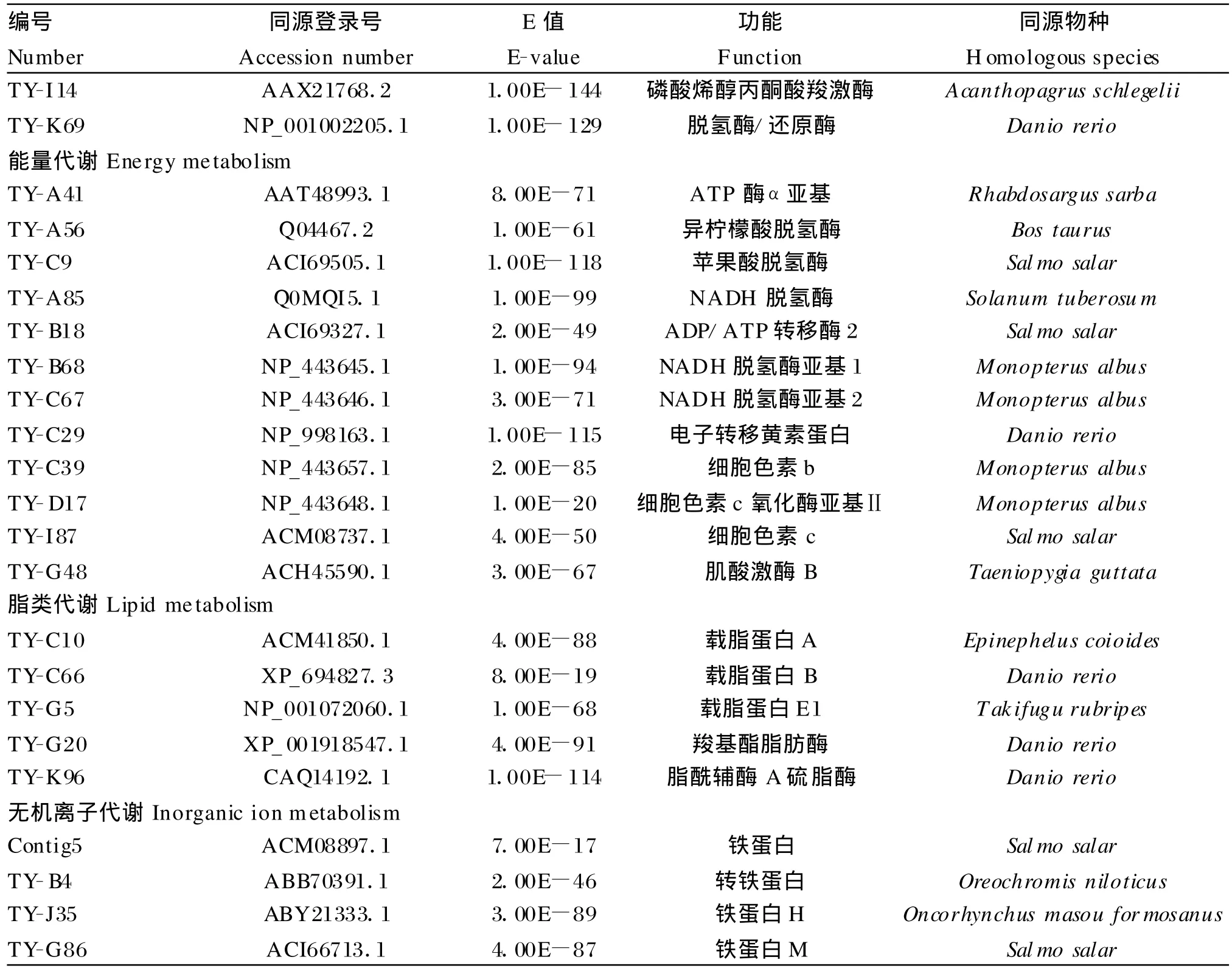
编号Number同源登录号Accession number E值E-value功能Function同源物种H omologous species TY-I14 AAX21768.2 1.00E-144磷酸烯醇丙酮酸羧激酶Acanthopagrus schlegelii TY-K 69 NP_001002205.1 1.00E-129脱氢酶/还原酶Danio rerio能量代谢Energymetabolism TY-A 41 AAT48993.1 8.00E-71 ATP酶α亚基Rhabdosargus sarba TY-A 56 Q 04467.2 1.00E-61异柠檬酸脱氢酶Bos taurus TY-C9 ACI69505.1 1.00E-118苹果酸脱氢酶Salmo salar TY-A 85 Q0MQI5.1 1.00E-99 NADH脱氢酶Solanum tuberosum TY-B18 ACI69327.1 2.00E-49 ADP/ATP转移酶2 Salmo salar TY-B68 NP_443645.1 1.00E-94 NADH脱氢酶亚基1 M onop terus albus TY-C67 NP_443646.1 3.00E-71 NADH脱氢酶亚基2 M onop terus albus TY-C29 NP_998163.1 1.00E-115电子转移黄素蛋白Danio rerio TY-C39 NP_443657.1 2.00E-85细胞色素b Monopterus albus TY-D17 NP_443648.1 1.00E-20细胞色素c氧化酶亚基ⅡM onop terus albus TY-I87 ACM 08737.1 4.00E-50细胞色素c Salmo salar TY-G48 ACH 45590.1 3.00E-67肌酸激酶B Taeniopygia guttata脂类代谢Lipid metabolism TY-C10 ACM 41850.1 4.00E-88载脂蛋白A Epinephelus coioides TY-C66 XP_694827.3 8.00E-19载脂蛋白B Danio rerio TY-G5 NP_001072060.1 1.00E-68载脂蛋白E1 Takifugu rubripes TY-G 20 XP_001918547.1 4.00E-91羧基酯脂肪酶Danio rerio TY-K 96 CAQ14192.1 1.00E-114脂酰辅酶A硫脂酶Danio rerio无机离子代谢Inorganic ionm etabolism Contig5 ACM 08897.1 7.00E-17铁蛋白Salmo salar TY-B4 ABB70391.1 2.00E-46转铁蛋白Oreochrom is niloticus TY-J35 ABY 21333.1 3.00E-89铁蛋白H Oncorhynchusmasou formosanus TY-G 86 ACI66713.1 4.00E-87铁蛋白M Salmo salar
3 讨 论
3.1 cDNA文库构建
高质量的起始总RNA和m RNA是成功构建cDNA文库最重要的因素,本试验采用进口一次性枪头和离心管,所需液体试剂现用现配,并对所有试剂、器械进行严格去RNA处理,尽量减少外源RNA的污染,有效保证了总RNA和m RNA的质量。
未剪切文库构建采用Invitrogen公司开发的专用CloneM inerTMcDNA文库构建试剂盒,在构建过程中利用Gateway技术,不需要使用限制性内切酶切割等步骤,不会对任何基因产生剪切;Super-Scrip tTMⅢ反转录酶具有独特的降低RNA酶活性的功能,充分保证了合成的cDNA第1链的长度和产量;利用与Gatew ay技术结合的重组酶可以将构建好的cDNA文库穿梭于任何表达载体间,并保证文库的库容量无明显损失;这样构建的未剪切cDNA文库的全长比例和库容量等均优于标准cDNA文库。
cDNA文库质量鉴定主要包括2部分内容,即文库的代表性和重组cDNA片段的序列完整性。一个高质量的cDNA文库,其库容量应大于5×106CFU,本试验成功构建了未剪切cDNA文库,文库的容量为1.46×107CFU,符合高质量文库的要求,并充分保证了大分子cDNA的完整性,有利于获得较多的基因信息;通过PCR检测,文库的平均插入片段为2.11 kb,重组率为96.88%,能充分保证下一步的EST分析及目的基因筛选。
3.2 黄鳝肠道营养代谢相关EST
黄鳝消化道内存在蛋白酶、胰蛋白酶、淀粉酶和脂肪酶[1]。从黄鳝肠道cDNA文库中,我们发现了大量与蛋白质、氨基酸和脂类代谢酶类高度相似的蛋白编码序列,并且蛋白质、氨基酸代谢酶的种类与EST数目明显多于脂肪酶,如各种蛋白酶原、羧肽酶A和B、氨肽酶、谷氨酸脱氢酶,而仅发现1个 α-淀粉酶EST(表2)。胰蛋白酶是鱼类肠道内的一种主要的碱性蛋白质水解酶之一,其前体形式为胰蛋白酶原,这也是黄鳝肠道中表达量较高的酶类(共有41个EST)。目前还没有从分子水平具体阐明胰蛋白酶对黄鳝消化作用机制的研究报道。
在大量与碳水化合物代谢有关EST中,代表几丁质酶(chitinase)的EST共计46个,是文库中表达量最高的酶蛋白基因序列。几丁质酶可以将几丁质水解为N-乙酰氨基葡萄糖。几丁质作为至关重要的有机碳源和氮源参与到生态系统的物质和能量流中[14],这主要归功于许多生物存在与几丁质亲和的代谢酶系,使几丁质能被相对高效地降解和再利用[15];几丁质酶同时具有识别和结合含几丁质的病原菌并抑制其生长的作用[16-17]。黄鳝肠道内大量的几丁质酶可能与其在野外常摄食昆虫和甲壳类水生动物有关。
在黄鳝肠道中,还发现载脂蛋白A(apo lipoprotein A,apo-A)、载脂蛋白B(apolipoprotein B,apo-B)和载脂蛋白E(apo lipop rotein E,apo-E)等多种载脂蛋白编码序列(表2)。载脂蛋白在血浆脂质代谢中起着较重要的作用,其基本功能是运载脂类物质及稳定脂蛋白的结构。鱼体通过几种载脂蛋白将脂类和脂溶性成分从肠道输送到肝脏或外周组织。从较早的研究中可见,饲料组成也能调控鱼类肝脏和血清脂蛋白中apo A-Ⅰ和apo C-Ⅱ的基因表达[18]。饲料中的营养组分可通过影响脂蛋白中载脂蛋白组分的表达调控脂蛋白的合成[19-20]。因此对脂类运输蛋白的研究,有助于寻找鱼类配合饲料中植物性油源的最佳配比。同时,载脂蛋白还有抗菌活性[21],在肠道中起着重要的免疫作用。
肠道内旺盛的物质代谢必然伴随大量的能量代谢,从文库中发现黄鳝肠道内含有黄素蛋白、细胞色素b、细胞色素c氧化亚基、NADH脱氢酶、ATP酶等呼吸链组分。呼吸链在传递氢或电子的过程中,为肠道消化吸收作用源源不断地产生能量。另外在无机离子代谢方面,铁蛋白是存在于细胞内的一种主要的铁结合蛋白,可以保护细胞免受高铁的氧化作用带来的损害[22-23]或清除来自于细菌等微生物的游离铁,促进肠道对铁的吸收[24]。转铁蛋白则是一种存在于血浆中的结合铁离子的蛋白,主要生理功能是在血清中将食物中吸收到血液中的铁运输到机体的需铁部位,调节铁离子平衡和能量平衡、并通过与转铁蛋白受体结合以吞噬作用进入细胞,抗菌杀菌等[25]。
3.3 与不同食性鱼类肠道cDNA文库的比较
我们将获得的黄鳝肠道营养相关EST(表3)与草鱼(Ctenopharyngodon idella)[5]和大西洋鲑(Salmo salar)[26]肠道获得的EST比较,发现黄鳝与草鱼相似性极小,与其仅有1个胰弹性蛋白酶前体(pancreatic elastase precursor)基因具有同源性;而与大西洋鲑比较,有8种同源的基因,这可能与黄鳝和大西洋鲑同属于肉食性鱼类,而草鱼属于草食性鱼类有关。黄鳝肠道其余营养相关基因中与肉食性的牙鲆(Paralichthys olivaceus)比较有9种同源,与模式物种斑马鱼(Danio rerio)比较也有9种同源基因,余下的也多数与肉食性的鱼类,如青鱂(Oryzias latipes)、虹鳟(Oncorhynchusmykiss)、斑鳜(Siniperca scherzeri)、斜带石斑鱼(Epinephelus coioides)、条纹鲈(Morone saxatilis)、红鳍东方鲀(Takifugu rubripes)等同源。这表明鱼类消化道中各种基因的表达与其生态环境和生活习性等密切相关。
4 结 论
本文首次成功构建了黄鳝肠道cDNA文库,并进行了EST测序,一方面可以永久保存其基因资源;另一方面可以利用功能筛选、免疫学筛选、EST分析等现代分子生物学技术阐明其与营养代谢、免疫相关的功能基因,为探讨黄鳝分子营养机制提供基础资料。
[1] 刘家芳,杨代勤,阮国良.黄鳝消化酶活性的研究[J].湖北农业科学,2007,46(5):804-807.
[2] Magnadóttir B.Innate immunity o f fish[J].Fish and Shellfish Imm unology,2006,20:137-151.
[3] 陈文波,刘黎黎,李文笙,等.鲤鱼肝胰脏cDNA文库的表达序列标签分析及Lb-Fabp mRNA的特征[J].水生生物学报,2009,33(3):376-384.
[4] Zhao D X,Song S H,W ang Q,et al.D iscovery of immune-related genes in Chinesem itten crab(Eriocheir sinensis)by expressed sequence tag analysis of haem ocy tes[J].Aquacu lture,2009,283(3/4):297-303.
[5] 张学俊,屈 刚,朱文漓,等.草鱼肠道cDNA文库构建及部分ESTs分析[J].水生生物学报,2007,31 (2):251-258.
[6] 张 宁.大海马cDNA文库构建、分析及抗菌肽新基因的初步功能研究[D].博士学位论文.广州:中山大学,2007.
[7] 李旭霞,逄 越,肖 蓉,等.日本七鳃鳗(Lampetrs japonica)唾液腺cDNA文库的构建[J].辽宁师范大学学报(自然科学版),2004,27(1):73-75.
[8] 杨 芳,贺智敏,詹显全,等.大鲵肝脏组织定向cDNA文库的构建及鉴定[J].动物学报,2004,50 (3):475-478.
[9] 张 勇,张为民,李 欣,等.石斑鱼卵巢cDNA文库构建及脂肪酸结合蛋白克隆[J].中山大学学报(自然科学版),2003,42(2):66-69.
[10] 方永强,中庆祥,翁幼竹,等.文昌鱼头部cDNA文库的构建[J].台湾海峡,2003,22(2):131-135.
[11] Sambrook J,Fritsch E F,Maniatis T.Molecular Cloning:A Laboratory M annu l[M].3rd ed.New York:Cold Spring Harbor Laboratory Press,2002: 857-980.
[12] Hwang M D,Fung Y W,W ang R X,et al.Analysis o f exp ressed sequence tags form a fetal human heart cDNA library[J].Genom ics,1995,30(2): 293-298.
[13] 胡松年.基因表达序列标签(EST)数据分析手册[M].杭州:浙江大学出版社,2005.
[14] Leake J R,Read D J.Chitin as a nitrogen source for mycorrhizal fungi[J].Mycological Research, 1990,94:993-995.
[15] Nem at O K,Saul R.The chitin catabolic cascade in themarine bacteriumVibrio fum issii[J].The Journal of Biological Chem istry,1996,271(52):33 425-33 432.
[16] Boot R G,Blommaart E F C,Sw art E,et al.Identification of a novel acidic mamm alian chitinase distinct from chitotriosidase[J].The Journalof Biological Chem istry,2001,276(9):6 770-6 778.
[17] Suzuki M,M orim atsu M,Yam ashita T,etal.A novelserum chitinase that is expressed in bovine liver [J].FEBS Letter,2001,506(2):127-130.
[18] Sheridan M A.Lipid dynam ics in fish:aspects of absorption,transportation,deposition and mobilization [J].Comparative Biochem istry and Physiology, 1988,90(4):670-690.
[19] 李志琼,余 冰,张克英,等.饲粮中添加α-亚麻酸对产蛋鸡载脂蛋白B和血脂的影响[J].动物营养学报,2008,20(6):674-678.
[20] 胡国良,曹华斌,郭小权,等.高能低蛋白日粮对蛋鸡肝载脂蛋白A-Ⅰ基因mRNA表达的影响[J].中国兽医科学,2009,39(7):641-645.
[21] V illarroel F,Bastías A,Casado A,et al.A polipoprotein A-Ⅰ,an antim icrobial protein inOncorhynchus mykiss:evaluation of its expression in primary defence barriers and plasma levels in sick and healthy fish[J].Fish and Shellfish Imm uno logy,2007,23 (1):197-209.
[22] Epsztejn S,Glickstein H,Picard V,etal.H-ferritin subunit overexpression in erythroid cells reduces the oxidative stress response and induces mu ltidrug resistance p roperties[J].Blood,1999,94(10):3 593-3 603.
[23] Balla G,Jacob H S,Balla J,et al.Ferritin:a cytoprotetive antioxidant stratagem of endothelium[J]. The Journal o f Biological Chem istry,1992,267 (25):18 148-18 153.
[24] 徐奇友,单安山,王 安.乳铁蛋白对早期断奶仔猪组织中微量元素含量的影响[J].动物营养学报, 2005,17(4):62.
[25] Cheng Y,Zak O,Aisen P,et al.Structure of the hum an transferrin receptor-transferrin comp lex[J]. Cell,2004,116(4):565-576.
[26] Hagen-Larsen H,Laerdah l J K,Panitz F,et al. An EST-based approach for identifying genes expressed in the intestine and gills of pre-smolt A tlantic salmon(Salmo salar)[J].BMC Genom ics,2005, 6:171.
*Correspond ing au thor,p rofessor,E-m ail:Zhoudg2004@126.com
(编辑 李一航)
