乳源β-酪啡肽对大鼠小肠葡萄糖吸收及血糖浓度的影响
2010-04-17任欢欢车超平张凡庆段云兵张源淑
任欢欢 郝 澍 车超平 张凡庆 段云兵 张源淑
(南京农业大学重点动物生理生化实验室,南京 210095)
长期以来,糖尿病一直被认为是一种常见的严重危害健康的慢性终身疾病,而今糖尿病已成为现代人类所面临的一个主要健康问题,其死亡率居于肿瘤、心血管疾病之后的第3位,引起了世界卫生组织的高度重视。目前,如何对糖尿病患者进行治疗和日常保健,是备受人们关注的话题。随着功能性食品和饲料的开发研究,研究乳源生物活性肽对血糖的影响也越来越多地受到人们的关注。乳作为哺乳动物优质的蛋白质来源、主要的钙磷来源,同时也是乳源活性肽的重要来源,而受到优先关注。
日本国立健康营养研究所最新研究发现,同时食用米饭和牛奶可降低血糖浓度,对防治糖尿病很有帮助,但作用的有效成分不明确[1]。β-酪啡肽(β-casom orphins,β-CMs)是由酪蛋白酶解产生的一类肽,包括β-CM 7、β-CM 5和β-CM 4等,由Brantl等[2]首先从牛乳酪蛋白的酶解产物中分离出来,并证明具有阿片肽活性,能够被纳洛酮(naloxone,NaL)所逆转。由于β-CMs分子量较小,在小肠内可以以完整肽段的形式被机体吸收,不会引起机体的免疫排斥反应,加之其食物源的安全性,已越来越多地引起人们的重视。以往的研究发现, β-CMs能在动物胃肠道被完整地吸收,产生与内源性阿片肽类似的生理调节功能,如刺激胰岛素、生长抑素的释放,调节肠运动,提高采食量,促进肠道水分与电解质的吸收等[3-6]。根据其刺激胰岛素分泌的作用,推测其可能有降血糖效果。宗亚峰[7]研究证实体外β-CM 7能够抑制小肠对葡萄糖的吸收,体内灌胃具有辅助降血糖的作用,但其作用机制还不明确。相关的研究目前在国内外均无报道。
糖尿病在临床上以高血糖为主要特点,因而本文从葡萄糖的吸收和血糖浓度入手进行研究。血糖的来源主要是通过胃肠吸收、糖原分解和糖异生这3个途径,而肠道吸收是最主要的途径。小肠内葡萄糖的吸收主要以主动方式逆浓度差转运而实现。目前多数关于β-CMs的研究都是利用离体器官和组织进行的[3],而直接在体内对β-CMs进行的研究甚少。为了探讨主要的乳源活性肽β-CMs应用于饮食和健康保健食品中可能的辅助降血糖作用,本试验以SD大鼠为研究对象,通过体内灌胃β-CM 5和β-CM 7及体外制作翻转小肠囊模型[8],检测β-CMs对大鼠血糖相关因子的影响及血糖水平的变化,目的是经过严格的科学研究,确定乳中β-CMs的降糖效果和可能的降糖机制,为乳源活性肽在人类保健食品和动物饲料添加剂等方面的研究、开发和应用提供一定的试验和理论依据。
1 材料与方法
1.1 试验材料
试验动物:SD大鼠,由上海实验动物中心提供。试验鼠用颗粒饲料购于南京协同医药生物工程有限公司。
主要试剂:β-CM 7(Tyr-Pro-Phe-Pro-Gly-Pro-Ile)和β-CM 5(Tyr-Pro-Phe-Pro-Gly),色谱纯(纯度>97%),美国凤凰药业有限公司提供;NaL、葡萄糖和糖原测定试剂盒均购自南京建成生物工程研究所;胰岛素放射免疫试剂盒购自北京北方生物技术研究所。
主要仪器:水浴恒温震荡器、高速离心机、721型分光光度计等。
1.2 体外试验
1.2.1 体外肠囊制作
SD大鼠,雌雄不限,体重200 g左右,自由采食和饮水,断颈处死后,参照陈其才等[8]的试验方法制作翻转离体小肠囊模型。
1.2.2 不同浓度β-CMs对离体小肠葡萄糖吸收的影响
β-CM 7和β-CM 5共分为4个浓度组,每组6个重复。4个浓度组的终浓度分别为0(对照组)、7.5×10-5(高剂量组)、7.5×10-6(中剂量组)、7.5×10-7mol/L(低剂量组),分别添加于含15 mm ol/L葡萄糖的K reb's液中。将肠囊放入预热的25℃无糖的K reb's液中,温浴10 m in后,转入37℃上述试验用的K reb's液中(保持肠囊内液面与囊外液面相平或略高),立即通入混合气体,并开始计时。用100μL微量进样器每隔10m in吸取肠囊内溶液样品,再补充同体积的无糖K reb's液,以进行肠囊对葡萄糖吸收的动态研究,总时间为60 m in。检测小肠囊内溶液的葡萄糖浓度。
1.2.3 β-CM 7对小肠葡萄糖吸收的阿片机制研究
翻转离体小肠囊的制作同1.2.1。试验分为3组:对照组(终浓度为0 mol/Lβ-CM 7,15 mmol/L葡萄糖的K reb's液);试验Ⅰ组(终浓度为7.5×10-5mo l/L的β-CM 7,15 mmo l/L葡萄糖的K reb's液);试验Ⅱ组(终浓度为7.5×10-5mol/L的β-CM 7和1.5×10-4mol/L NaL,15mmol/L葡萄糖的K reb's液)。混匀后,将肠囊放入预热的25℃无糖的K reb's液中温浴10 min,后转入37℃上述试验用的K reb's液中,立即通入氧气,并开始计时。用100μL微量进样器每隔10 min吸取肠囊内液体,再补充同体积的无糖K reb's液。检测小肠囊内溶液的葡萄糖浓度。
1.3 体内试验
1.3.1 试验设计
体重约200 g的SD大鼠21只(其中11只雄性,10只雌性),笼养,基础饲料喂养,自由采食和饮水。预饲1周后将大鼠随机分成3组,即对照组、β-CM 7组和β-CM 5组,分别灌胃生理盐水(对照组)、7.5×10-6mol/Lβ-CM 7(β-CM 7组)和7.5×10-6mo l/Lβ-CM 5(β-CM 5组)。每天2次,每次1m L,间隔12 h,连续灌胃30 d。
1.3.2 样品收集与保存
在试验期内,每5 d断尾采血并制备血清,动态检测血清中葡萄糖浓度的变化。在第30天灌胃0.5 h后处死,并取血液、肝脏及肌肉,-20℃保存备用。
1.3.3 葡萄糖浓度的测定
氧化酶法测定灌胃后第5天、第10天、第15天、第20天、第25天和第30天时大鼠血清中葡萄糖浓度,具体操作按照试剂盒说明书进行。计算公式如下:
葡萄糖浓度(mmol/L)=(样本管吸光度值/标准管吸光度值)×标准液浓度。
1.3.4 大鼠肝糖原和肌糖原含量的测定
具体操作按照试剂盒说明书进行。计算公式如下:
糖原含量(mg/g组织)=(样本管吸光度值/标准管吸光度值)×标准管糖原含量×样本测定前稀释倍数×10/1.11。
1.3.5 大鼠血清胰岛素含量的测定
血清中胰岛素(insulin)含量的放射免疫分析(RIA)按照胰岛素放射免疫分析试剂盒的说明书进行操作。FMJ-182放射免疫γ计数器检测并获得数据。
1.4 数据处理
采用SPSS 13.0软件进行数据分析和统计。先对数据作单因素方差分析(One-way ANOVA),若处理间差异显著,再用Duncan氏多重比较,P<0.05表示差异显著,P<0.01表示差异极显著。所有数值以平均值±标准差(mean±SD)表示。
2 结 果
2.1 体外试验结果
2.1.1 不同浓度β-CMs对离体小肠囊葡萄糖吸收的影响
由表1可知,与对照组相比,处理30m in后, β-CM 7高剂量组的葡萄糖浓度极显著降低(P<0.01),中剂量组的浓度显著降低(P<0.05);处理40 m in后,高、中剂量组的葡萄糖浓度均极显著降低(P<0.01);处理50 m in后,高剂量组的葡萄糖浓度极显著降低(P<0.01),中剂量组的浓度显著降低(P<0.05);处理60 m in后,高、中、低剂量组的葡萄糖浓度均极显著降低(P<0.01)。由此可以说明,β-CM 7对离体肠囊葡萄糖的吸收有抑制作用,这种抑制作用随着β-CM 7浓度的增加而显著增强。
由表2可知,与对照组相比,处理50 m in后,β-CM 5高、低剂量组的葡萄糖浓度均显著降低(P<0.05);处理60m in后,高剂量组的葡萄糖浓度显著降低(P<0.05)。由此可以说明,β-CM 5对离体肠囊葡萄糖的吸收也有抑制作用。
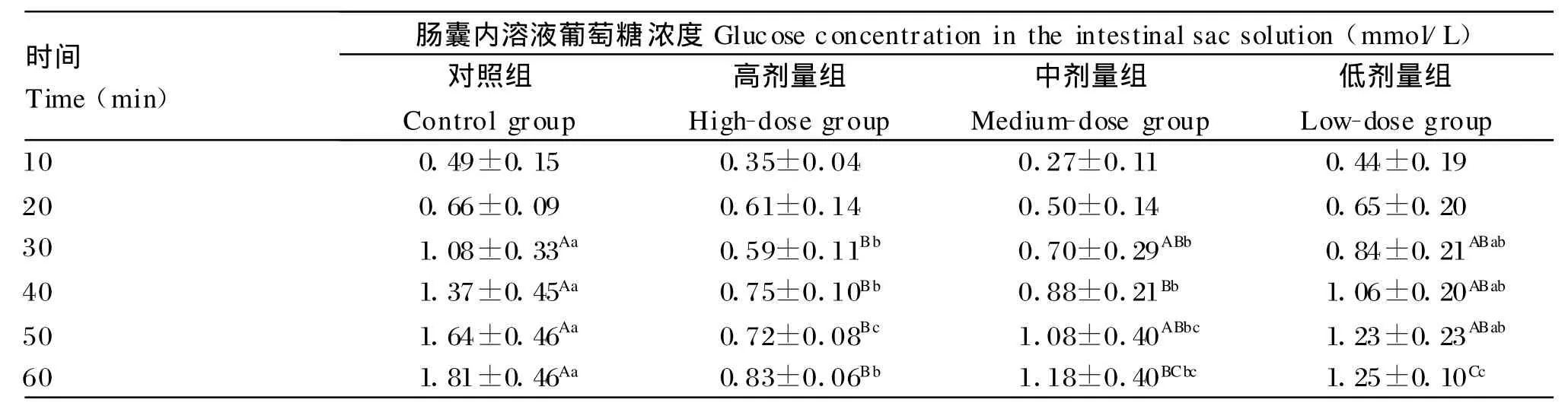
表1 不同浓度的β-CM 7对离体肠囊葡萄糖吸收的影响Table 1 Ef fects of differentβ-CM 7 concentrations on intestinal absorption of glucose in vitro(n=6)
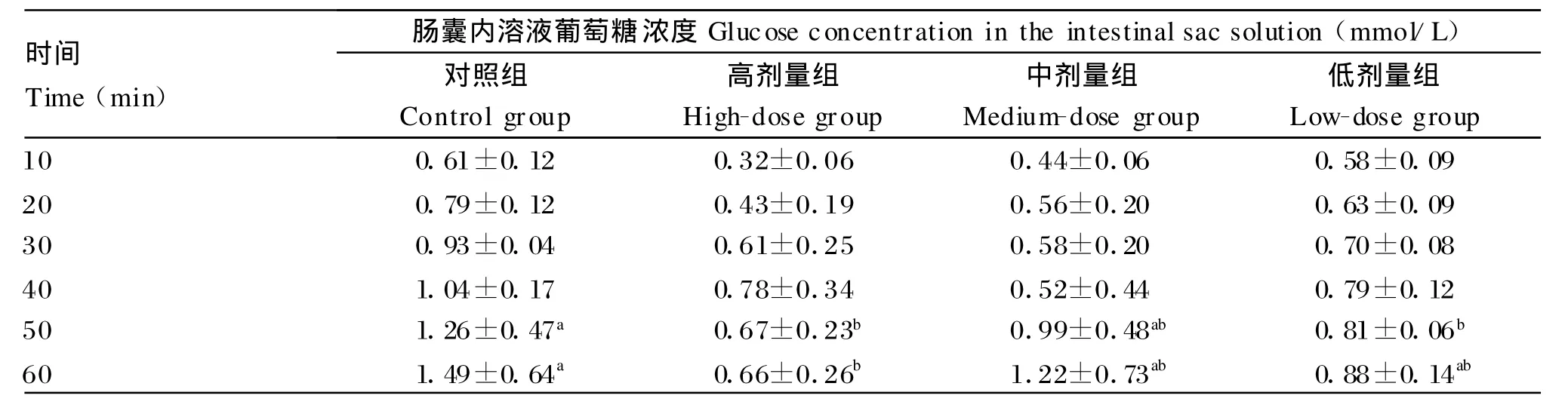
表2 不同浓度的β-CM 5对离体肠囊葡萄糖吸收的影响Table 2 Ef fects of differentβ-CM 5 concentrations on intestinal absorption of glucose in vitro(n=6)
2.1.2 β-CM 7对小肠囊葡萄糖吸收的阿片机制研究
如表3所示,与对照组相比,处理20m in后,试验Ⅰ组和试验Ⅱ组葡萄糖浓度均显著下降(P< 0.05);处理40m in后,试验Ⅰ组和试验Ⅱ组葡萄糖浓度均极显著下降(P<0.01);处理50 m in后,试验Ⅱ组葡萄糖浓度极显著下降(P<0.01),而试验Ⅰ组显著下降(P<0.05)。并且从处理10 m in到处理60 m in后,试验Ⅰ组和试验Ⅱ组葡萄糖浓度之间并无显著差异(P>0.05)。说明加入NaL后没有逆转β-CM 7对葡萄糖吸收的抑制效用,即β-CM 7抑制小肠葡萄糖吸收是通过非阿片途径进行的。
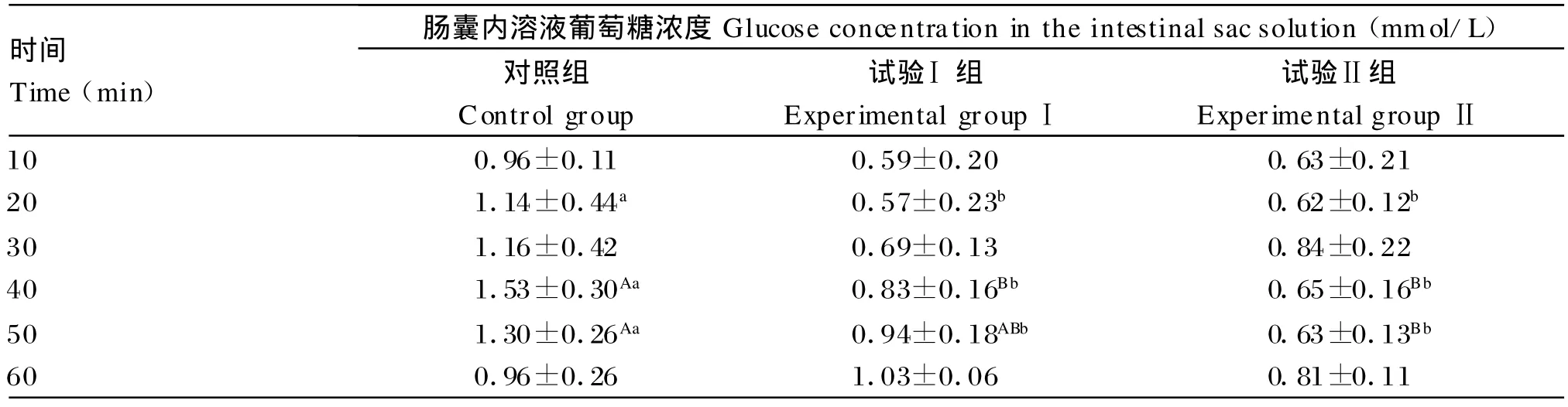
表3 β-CM 7及NaL对小肠囊葡萄糖吸收的影响Tab le 3 Effects o fβ-CM 7 and NaL on intestinal absorp tion o f glucose in vitro(n=6)
2.2 体内试验结果
2.2.1 血糖浓度测定结果
血糖浓度测定结果见表4。由表4可以看出,随着灌胃天数的增加,β-CM 7组和β-CM 5组大鼠的血糖浓度开始低于对照组。在第20天、第25天和第30天,β-CM 7组和β-CM 5组大鼠的血糖浓度均极显著地低于对照组(P<0.01)。由此可以说明,体内连续灌胃β-CM 7和β-CM 5均可以降低大鼠的血糖浓度。
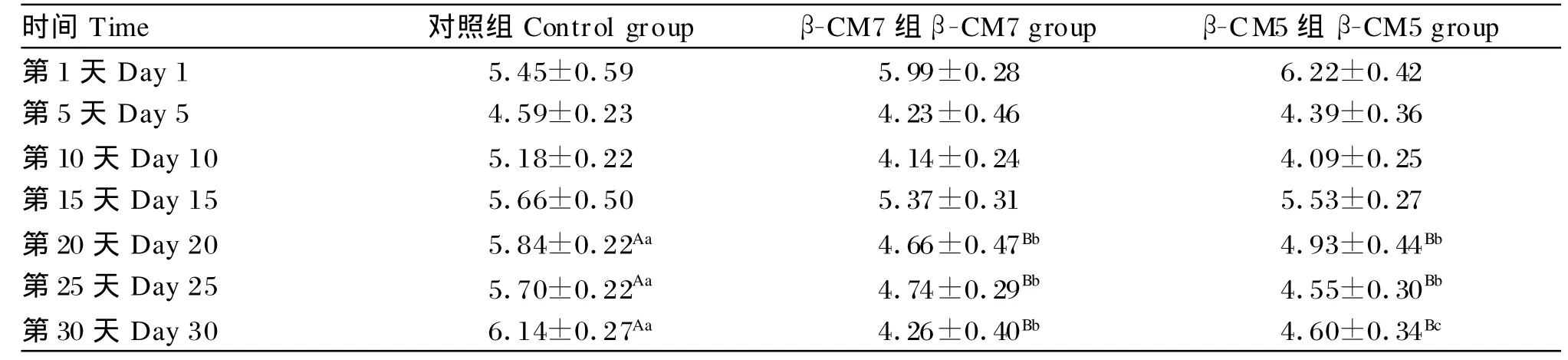
表4 灌胃β-CM 7和β-CM 5对大鼠血糖浓度的影响Tab le 4 Effects o f intragastricβ-CM 7 andβ-CM 5 in fusions on concentration of serum g lucose in rats (n=7,m ol/L)
2.2.2 肝糖原和肌糖原测定结果
由表5可知,大鼠肝糖原含量,β-CM 7组与对照组相比差异不显著(P>0.05),而β-CM 5组极显著低于对照组(P<0.01);β-CM 7组和β-CM 5组大鼠肌糖原含量均低于对照组,且差异极显著(P<0.01)。

表5 灌胃β-CM 7和β-CM 5对大鼠肝糖原和肌糖原含量的影响Table 5 Effec ts o f in tragastricβ-CM 7 andβ-CM 5 infusions on hepatic glycogen andm uscle glycogen contents in rats (n=7,mg/g)
2.2.3 大鼠血清中胰岛素测定结果
结果见表6,β-CM 7组和β-CM 5组血清胰岛素含量与对照组差异均不显著(P>0.05),即β-CM 7和β-CM 5不是通过直接作用于胰岛素而对血糖浓度的产生影响的。

表6 灌胃β-CM 7和β-CM5对大鼠血清胰岛素浓度的影响Table 6 Effects o f intragastricβ-CM 7 andβ-CM 5 in fusions on content o f insulin in serum o f rats (n=7,μIU/m L)
3 讨 论
随着功能性食品和饲料的开发研究,乳源生物活性肽对血糖浓度影响的研究也越来越多地受到人们的关注。乳作为哺乳动物优质的蛋白质来源、主要的钙磷来源,同时也是乳源活性肽的重要来源,而受到优先的关注。Blouet等[9]研究发现用α-乳白蛋白(乳清蛋白中主要成分)配制成营养混合悬液喂食雄性W istar大鼠,其进食后2 h内的血糖水平明显低于其他蛋白质配方饮食组。Frid等[10]对14名Ⅱ型糖尿病患者进行的试验观察发现,乳清蛋白能降低其早餐后2 h和午餐后3 h的血糖升高程度。但就现有研究结果,乳清蛋白降低血糖的具体机制还不甚清楚,有待继续深入研究。
β-CMs是来源于β-酪蛋白的一类阿片肽。这类肽序列是编码在其前体蛋白质中,在肠道消化或者摄食过程中由蛋白水解酶消化释放出来。其中,从β-酪蛋白释放出的β-CM 7或β-CM 5是一类最具代表性乳源活性肽,不仅起着营养功能的作用,还具有重要的生理调节作用[6]。宗亚峰[7]研究发现,β-CM 7在62.5、125.0和250.0 mg/L浓度下,对小肠囊吸收葡萄糖均有一定抑制作用,其抑制效应呈现一定的剂量关系。在本试验的体外肠囊试验中,β-CM 7和β-CM 5在浓度为7.5×10-7~7.5×10-5m ol/L浓度范围内均能抑制离体小肠囊对葡萄糖的吸收,且高、中剂量组与对照组差异显著,说明其抑制作用的大小与浓度有关,这一结果与宗亚峰[7]的结果相一致。
据报道,β-CMs能明显提高胰岛素和胰高血糖素的分泌[11],增加餐后胰岛素和生长激素抑制素的含量,而这种作用能被NaL所逆转。谈寅飞等[12]的研究表明,一定浓度的β-CM 7能促进表面灌流的仔猪胃窦黏膜分泌胃泌素,NaL不能阻断该效应,提示β-CM 7的作用和G细胞上非阿片位点有关。本试验加入NaL后,发现没有逆转β-CM 7对小肠葡萄糖吸收的抑制作用,这与谈寅飞等[12]的研究机理相似,说明β-CM 7对小肠葡萄糖吸收的抑制作用并不是通过它的阿片样活性而实现的,该作用与肠细胞上的非阿片位点有关,即β-CM 7抑制小肠葡萄糖的吸收是通过非阿片途径进行的。
已有研究证实灌胃β-CM 7(浓度7.5× 10-7mm ol/L)能够显著降低血糖水平[7]。本试验结果表明,体内灌胃浓度为7.5×10-6mmol/L的β-CM 7或β-CM 5的第20天、第25天和第30天, β-CM 7组和β-CM 5组大鼠的血糖浓度均极显著地低于对照组,说明β-CM 7和β-CM 5具有降低血糖的作用,与前人研究结果相一致。
葡萄糖是所有动物体内不可缺少的营养物质[13],胰岛素是体内唯一降低血糖的激素,它促进组织细胞摄取和利用葡萄糖,促进肝细胞和肌肉细胞将葡萄糖合成糖原,促进糖类转变为脂肪,抑制糖的异生。本试验研究发现β-CM 5组和β-CM 7组大鼠的血清胰岛素水平与对照组相比差异不显著,这表明β-CMs不是通过促进胰岛素的分泌而达到降血糖效果的,即并非通过刺激胰岛素分泌途径发挥降糖作用的。有研究证实β-CMs能促进胰岛素的分泌[14],而造成β-CMs生理活性功能不一的原因,可能与体内生物环境的复杂性、试验动物的差异(种类、性别、年龄等)、给药剂量以及样品的单一性等有关。目前多数关于β-CMs的研究都是利用离体器官和组织进行的[3],而直接在体内对β-CMs进行的研究甚少,因而体内试验部分仍有待于进一步的研究。
在糖代谢过程中,肝脏是调节血糖浓度的主要器官。肝脏内不仅存在很多的糖代谢途径,而且还可以储存糖原。当血糖浓度过高时,一部分葡萄糖可以直接转换为肝糖原在肝脏中储存,从而使血糖浓度降低。本研究结果显示,连续灌胃β-CM 7或β-CM 5后大鼠肝糖原的含量并没有高于对照组,这说明β-CMs也不是通过将葡萄糖转变成肝糖原这条途径而发挥降糖作用的。但在本试验中发现β-CM 7组和β-CM 5组大鼠肌糖原含量极显著降低,提示β-CMs可能对肌糖原消耗有影响,其机制需进一步研究。
总之,β-CMs虽已明确具有降糖作用,但其降糖作用的机制以及作用剂量等仍有待于从多方面进行研究。
4 结 论
①β-CM 7和β-CM 5能通过非阿片途径抑制小肠对葡萄糖的吸收,抑制作用的大小与浓度有关。
②β-CM 7和β-CM 5具有降血糖作用,其降低血糖的途径不是通过转变成肝糖原途径,也不是通过改变胰岛素分泌途径进行的,可能与大鼠肠道葡萄糖的转运和肌糖原的消耗有关,其详细机理有待进一步研究。
[1] Yoko W,M ichiko S,Noriko N,et al.The glycem ic index for m ixed foods betw een rice and other foods such as vinegar,soya bean,m ilk,and m ilk products [J].Health Sciences,2001,17(3):133-142.
[2] Brantl V,Teschemacher H,Henschen A,et al.Novel opioid pep tides derived from casein(beta-casomorphins).1.Isolation from bovine casein peptone[J]. Hoppe-seylers Zeitschrift Fur Physiologische Chem ie,1979,360:1 211-1 216.
[3] Froetschel M A.Bioactive pep tides in digesta that regulategastrointestinal function and intake[J].Anim al Science,1996,74:2 500-2 508.
[4] 凌明亮,黄仁术,严梅根,等.β-酪啡肽对早期断奶仔猪生长性能及小肠形态、菌群、吸收功能的影响[J].粮食与饲料工业,2004,11:31-33.
[5] 张源淑,宗亚峰,邹思湘,等.仔猪胃肠道食糜和血液中酪啡肽的检测及阿片样活性分析[J].畜牧兽医学报,2006,37(10):1 063-1 066.
[6] 张源淑,邓 艳,宋晓丹,等.酪啡肽及其酪蛋白水解肽对早期断奶仔猪分泌性免疫球蛋白A和细胞因子水平的影响[J].动物营养学报,2008,20(2): 196-199.
[7] 宗亚峰.β-酪啡肽在胃肠道内的释放、吸收和稳定特性及其对胃肠机能的影响[D].博士学位论文.南京:南京农业大学,2007:104-107.
[8] 陈其才,严定友,吴政星.生理学实验[M].第1版.北京:科学出版社,1995:110-113.
[9] Blouet C,M ariotti F,M ikogam i T,et al.Meal cysteine imp roves postprandial glucose control in rats fed a high-sucrose m eal[J].Journal o f Nutritional Biochem istry,2007,18:519-524.
[10] Frid A H,Nilsson M,Hoist JJ,et al.Effect of whey on blood g lucose and insulin responses to composite break fast and lunch m eals in type 2 diabetic sub jec ts [J].American Journal of Clinical Nutrition,2005, 82:69-75.
[11] Morley JE,Levine A S,Yamada T,etal.Effect of exorphins on gastrointestinal func tion,hormonal release and appetite[J].Gastroenterology,1983,84 (6):1 517-1 523.
[12] 谈寅飞,陈伟华,邹思湘.酪啡肽对仔猪离体胃窦黏膜分泌胃泌素的影响[J].南京农业大学学报,2000, 23(2):72-75.
[13] 孙海洲,卢德勋.十二指肠灌注不同水平的玉米淀粉对生长肥育绵羊小肠内葡萄糖消化及吸收的影响[J].动物营养学报,1999,11(增刊):173-185.
[14] 秦宜德,徐从贞,罗 欣,等.β-酪啡肽-7对大鼠生长、相关激素及生长素受体m RNA表达影响[J].营养学报,2004,26(2):111-115.
*Correspond ing au thor,p rofessor,E-m ail:zhangyuanshu@njau.edu.cn
(编辑 李一航)
