饲料脂肪水平对胭脂鱼生长性能、肠道消化酶活性和脂肪代谢的影响
2010-04-17王朝明张桂众尚卫敏贾思超丛潇飞刘本祥
王朝明 罗 莉* 张桂众 尚卫敏 贾思超 丛潇飞 颜 忠 刘本祥
(1.西南大学动物科技学院,北碚 400716;2.重庆市万州区水产研究所,万州 404020)
胭脂鱼(Myxocyprinus asiaticus)属鲤形目(Cyp riniformes),胭脂鱼科或亚口鱼科(Catostom idae)。目前全世界约有该科鱼类14属,近80种[1],其中绝大多数分布于北美洲,仅有少数分布在中美洲及亚洲[2]。中国胭脂鱼是亚口鱼科鱼类在亚洲大陆唯一分布的单型属、种,主要分布于我国的长江和闽江流域[3],是我国特有珍稀鱼类、国家二级濒危保护动物[4],具有较高的学术价值和经济价值。
关于胭脂鱼营养与饲料的研究较少,只有袁锡立等[5]研究了胭脂鱼仔鱼的开口饲料,陈建等[6]研究了胭脂鱼的蛋白质需求。脂肪是鱼类最佳能源物质,为鱼类提供必需脂肪酸,促进脂溶性维生素的吸收和运输[7],是鱼类饲料中不可缺少的营养物质。已有研究表明,饲料中适宜的脂肪含量可以提高饲料利用率,促进鱼类生长[8-9],而供给过多的脂肪则会增加鱼体脂肪沉积,抑制鱼类生长[10-12]。关于脂肪水平对胭脂鱼生长调控和脂肪代谢的影响还未曾见报道。
本试验以胭脂鱼幼鱼为研究对象,采用单因子试验设计设定6个饲料脂肪水平,研究不同脂肪水平对胭脂鱼生长、肠道消化道酶活性和脂肪代谢的影响,探讨脂肪水平影响鱼类生长的作用机制,确定胭脂鱼的适宜脂肪水平和最佳能蛋比。
1 材料与方法
1.1 试验饲料与试验设计
试验饲料为半精制饲料,以酪蛋白和明胶(4∶1)为蛋白质源,蛋白质水平为40%[6];糊精、α-淀粉为糖源;大豆油为脂肪源。采用单因子浓度梯度法配制脂肪水平为2.04%、4.43%、6.88%、9.02%、11.98%和13.39%的6种试验饲料,其中脂肪水平的增减用糊精调平。各原料粉碎过60目筛,称重后混匀,少量的组分采用逐级扩大法混合,用面条机制成直径为2mm的饲料,自然风干后,过筛,选取颗粒大小适宜者用胶袋密封,置于冰箱中冷冻保藏,备用。试验饲料组成及营养水平见表1。
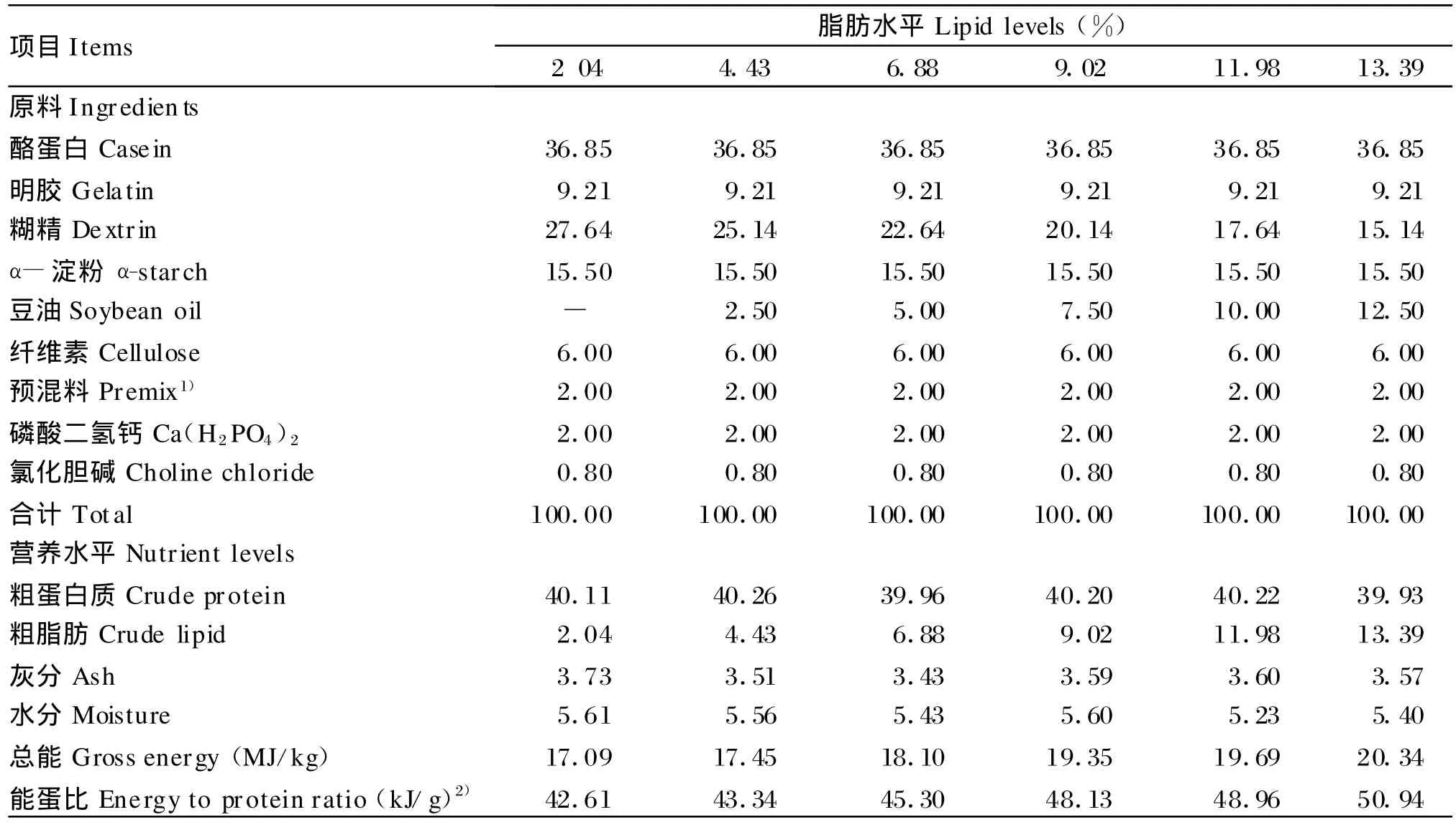
表1 试验饲料组成及营养水平(风干基础)Tab le 1 Composition and nutrient levels of experimental diets(air-d ry basis,%)
1.2 饲养管理
胭脂鱼鱼种由重庆市万州区水产研究购回后用3%的食盐溶液消毒,用药饵投喂3 d,再用基础饲料驯养10 d。摄食正常后选取体质健壮、规格整齐的平均体重为(6.73±0.21)g的胭脂鱼幼鱼540尾,随机分为6组,每组设3个重复,每个重复30尾鱼,以重复为单位养殖到已编号的循环水族缸(体积为200 L,水体5~6 h交换1次)中。每天投喂3次(08:00、13:00和18:00各1次),投饲率2%~3%,根据水温和鱼体生长情况调整投饲量。试验期共56 d,试验期间水温24~28℃,pH 6.5~7.0,溶解氧大于5mg/L,氨氮浓度小于0.05mg/L。
1.3 样品采集和测定
试验开始前,选取10尾鱼放于-20℃冰箱保存备用测定初始鱼常规营养成分。养殖试验结束后,饥饿24 h,统计每缸中鱼的数量并称总质量,计算其增重率、特定生长率和饲料系数。每组随机取30尾鱼,其中8尾用于测定全鱼营养组成;12尾解剖分离出肝胰脏、肠道后取背部两侧白肌,将肝胰脏、肠道和白肌样品放在-20℃冰箱保存备测;10尾取静脉血,在3 000 r/min离心15 m in后吸取上层血清备用。
饲料和试验鱼常规营养成分测定:干物质采用105℃干燥恒重法;粗蛋白质采用凯氏定氮法;粗脂肪采用索氏提取法;灰分采用马福炉550℃灼烧法;饲料能量用弹式热量计直接测定;能蛋比参照陈佳毅[13]的方法。
肌肉RNA与DNA比值参照齐治家[14]的方法。
肠道消化酶活性测定:酶液的制备参照南京建成生物工程研究所试剂盒的组织匀浆方法,蛋白酶活性测定采用Folin-酚法[15];脂肪酶活性测定参照聚乙烯醇橄榄油乳化液水解法[15];淀粉酶活性用碘-淀粉比色法测定(南京建成试剂盒)。
脂肪代谢相关指标:血清总脂采用香草醛法[15]测定;血清甘油三酯和总胆固醇采用酶法测定(南京建成试剂盒);肝胰脏苹果酸脱氢酶和血清脂蛋白脂酶用比色法测定(南京建成试剂盒)。
1.4 数据分析
数据均以平均值±标准差表示,用SPSS 11.5统计软件中One-way ANOVA进行方差分析,并用Duncan氏进行多重比较,P<0.05为差异显著。
2 结 果
2.1 饲料脂肪水平对胭脂鱼生长性能的影响
从表2可知,随着饲料脂肪水平的增加,胭脂鱼增重率、特定生长率呈先增后降的趋势,均在6.88%组达到最高,且显著高于2.04%、11.98%和13.39%组(P<0.05);而饲料系数则相反,呈先降后升的趋势,在6.88%组达到最低,且显著低于2.04%、4.43%、11.98%和13.39%组(P<0.05)。
经统计分析表明,增重率(y)和饲料系数(y)与饲料脂肪水平(x)的二次曲线回归方程分别为y= -0.771 3x2+10.212 0x+83.846 0(R2= 0.868 4)和y=0.019 1x2-0.268 0x+2.244 3 (R2=0.977 7)。当增重率和饲料系数达到极值时,脂肪水平分别为6.62%和7.02%。以能蛋比为x轴,增重率(y)的回归方程为:y=-1.6x2+ 146.7x-3 237.8(R2=0.994 5);饲料系数(y)的回归方程为:y=0.038 6x2-3.547 8x+83.353 0 (R2=0.900 2)。当增重率和饲料系数达到极值时,能蛋比分别为45.77和45.96 k J/g。
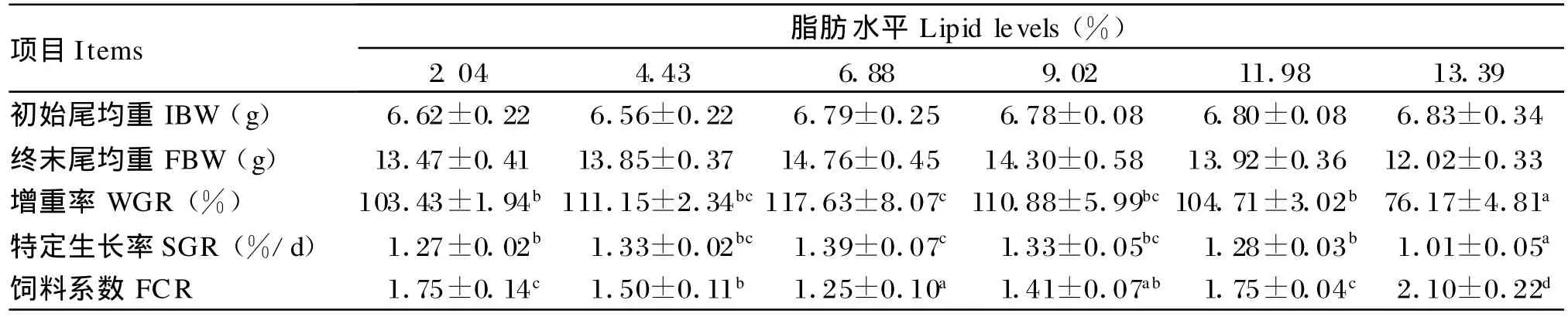
表2 饲料脂肪水平对胭脂鱼生长性能的影响Table 2 Effects o f dietary lipid levels on grow th performance o f Chinese sucker
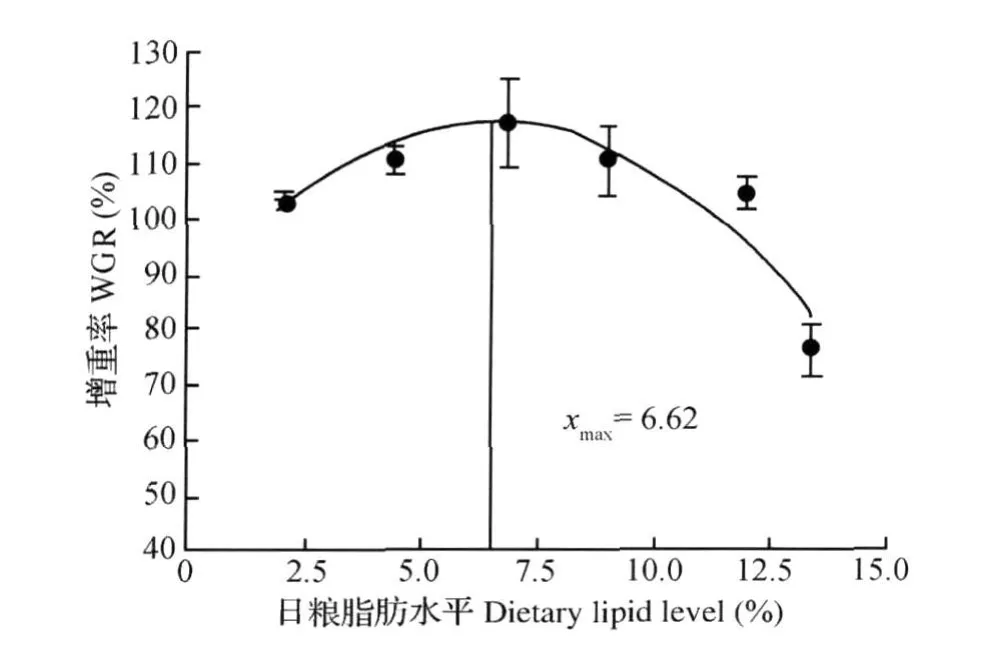
图1 胭脂鱼增重率与饲料脂肪水平的回归分析Fig.1 Regression analysis betw een WGR and dietary lipid levels of Chinese sucker
2.2 饲料脂肪水平对胭脂鱼肌肉RNA与DNA比值的影响
由表3可知,随饲料脂肪水平增加,RNA与DNA比值呈先升后降趋势,在6.88%组达到最高,且显著高于2.04%、11.98%和13.39%组(P< 0.05)。RNA与DNA比值(y)与饲料脂肪水平(x)的回归方程为y=-0.038 1x2+0.539 2x+ 2.315 6(R2=0.944 4)。RNA与DNA比值和增重率之间有很好的正相关关系(图5),以增重率为x轴,RNA与DNA比值为y轴进行回归分析得到直线方程为y=0.040 3x-0.601 9(R2=0.913 7)。

图2 胭脂鱼饲料系数与饲料脂肪水平的回归分析Fig.2 Regression analysis between FCR and dietary lipid levels o f Chinese sucker
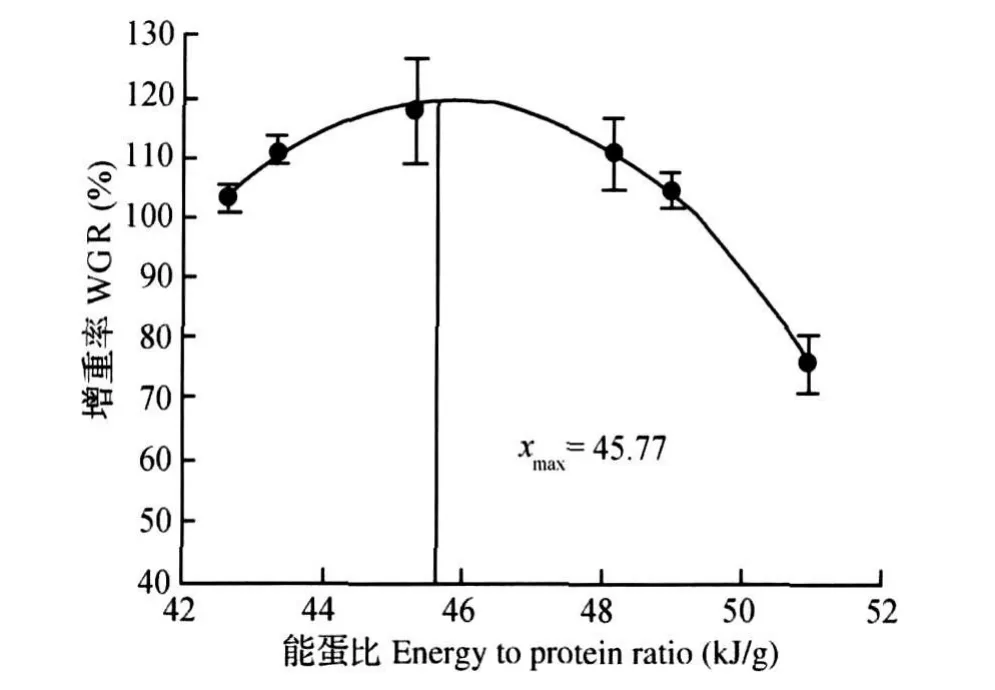
图3 胭脂鱼增重率与饲料能蛋比的回归分析Fig.3 Regression analysis between WGR and dietary energy to p rotein ratio o f Ch inese sucker
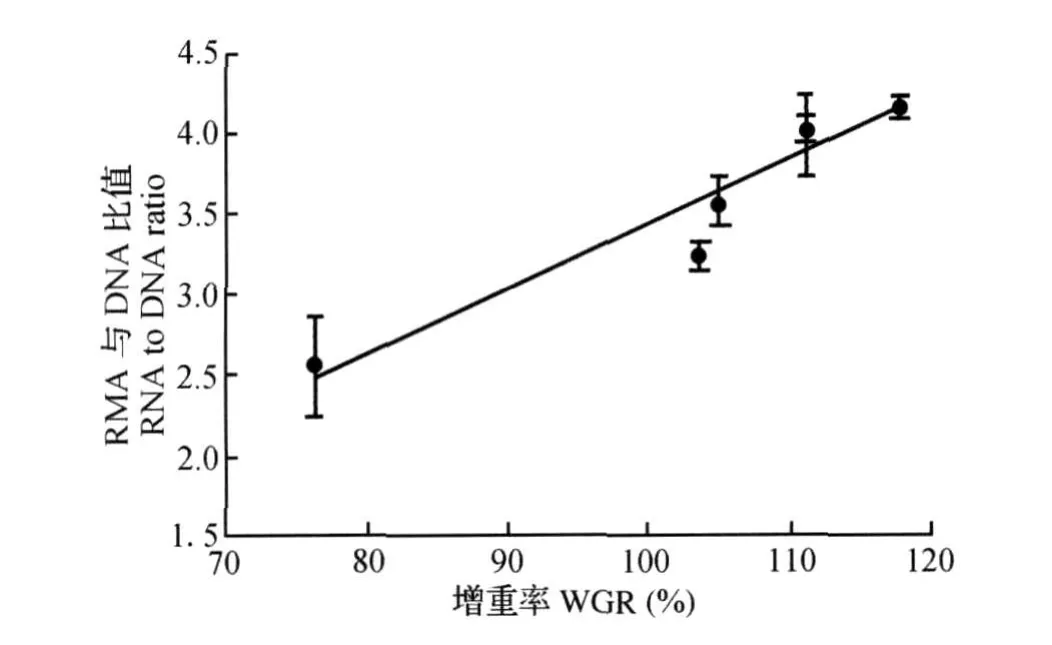
图4 胭脂鱼饲料系数与饲料能蛋比的回归分析Fig.4 Regression analysis betw een FCR and dietary energy to p rotein ratio of Chinese sucker

表3 饲料脂肪水平对胭脂鱼肌肉RNA与DNA比值的影响Table 3 Ef fec ts of dietary lipid levels on RNA to DNA ratio of Chinese sucker
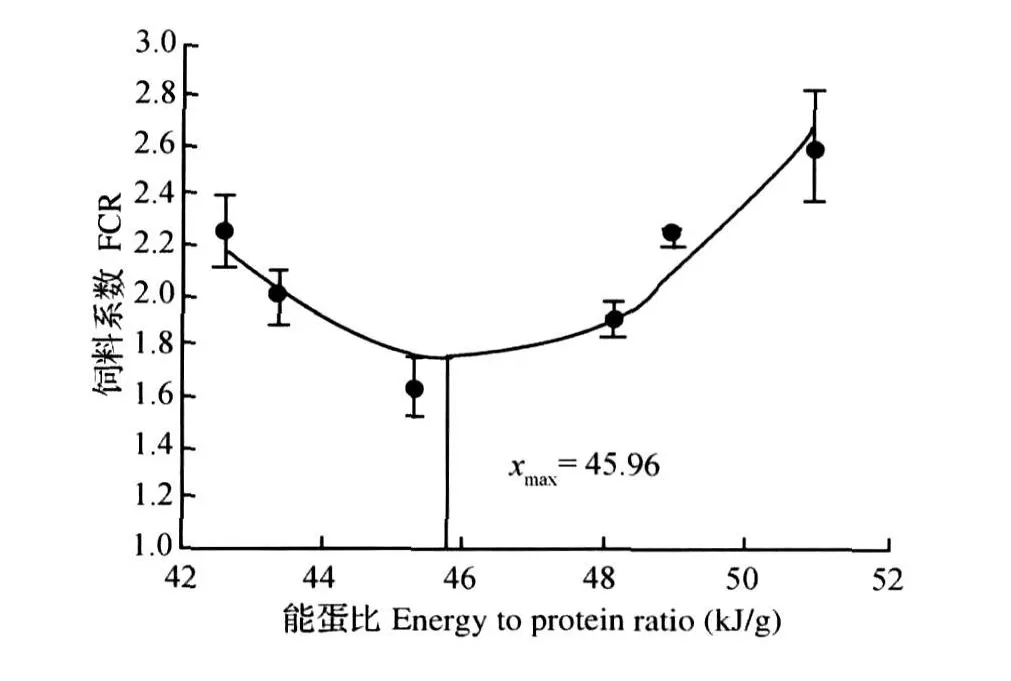
图5 RNA与DNA比值与增重率的关系Fig.5 Relationship betw een RNA to DNA ratio and WGR
2.3 饲料脂肪水平对胭脂鱼肠道消化酶活性的影响
从表4可知,随着饲料脂肪水平增加,胭脂鱼肠道蛋白酶活性在2.04%~11.98%组之间呈显著下降趋势(P<0.05),在11.98%~13.39%组之间保持相对稳定(P>0.05),11.98%组与对照组相比蛋白酶活性降低71.71%(P<0.05);脂肪酶活性在2.04%~6.88%组之间显著增加(P<0.05),在6.88%~13.39%组之间差异不显著(P>0.05), 6.88%组与对照组相比脂肪酶活性增加37.14% (P<0.05);淀粉酶活性在2.04%~6.88%组之间显著降低(P<0.05),在6.88%~13.39%组之间差异不显著(P>0.05),11.98%组与对照组相比淀粉酶活性降低46.88%(P<0.05)。

表4 饲料脂肪水平对胭脂鱼肠道消化酶活性影响Tab le 4 Effects o f dietary lipid levels on intestinal digestive enzyme activities o f Chinese sucker(U/mg p rot)
2.4 饲料脂肪水平对胭脂鱼脂肪代谢的影响
从表5可知,血清总脂、甘油三酯和总胆固醇含量随饲料脂肪水平增加而增加,13.39%组与对照组相比血清总脂含量增加56.13%(P<0.05)、甘油三酯含量增加99.96%(P<0.05)、总胆固醇含量增加58.19%(P<0.05);血清脂蛋白脂酶和肝胰脏苹果酸脱氢酶活性随饲料脂肪水平增加总体呈下降趋势,13.39%组与对照组相比血清脂蛋白脂酶活性降低46.30%(P<0.05),肝胰脏苹果酸脱氢酶活性下降65.11%(P<0.05)。
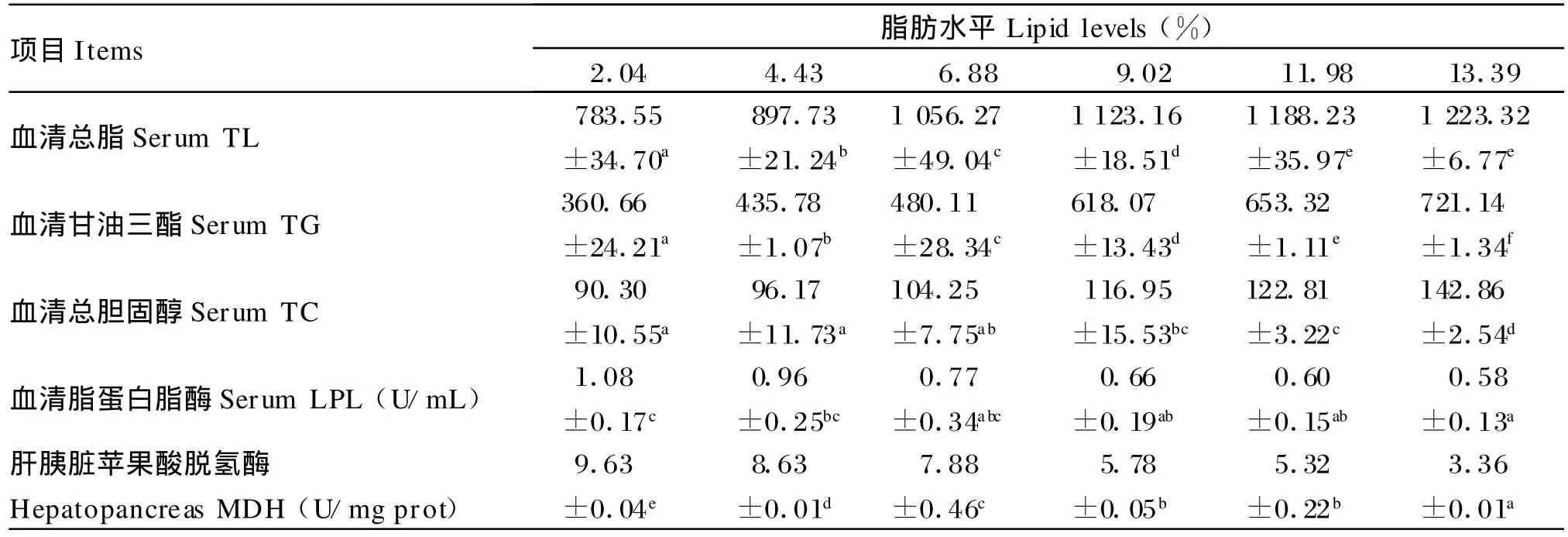
表5 饲料脂肪水平对胭脂鱼脂肪代谢的影响Tab le 5 Ef fects of dietary lipid levels on lipid metabolism of Chinese sucker(mg/d L)
3 讨 论
鱼类对碳水化合物的利用能力较低,维持正常生命活动的能量主要依靠蛋白质和脂肪的分解[8]。蛋白质是鱼类饲料中价值最高的部分[16],当饲料中脂肪含量不足时,用于生长的蛋白质将被作为能源以维持鱼类的生存[17]。高效经济的饲料应尽量由脂肪提供能量,以减少蛋白质的消耗量,降低成本,同时也可降低因高蛋白质饲料而造成大量氮排泄对水体的污染[16]。然而,饲料中脂肪含量过高时,则会抑制鱼类的生长[10-12],增加体内脂肪沉积,所以,确定鱼类适宜脂肪水平是有必要的。本试验采用二元回归方法[8,18]分析饲料脂肪水平对胭脂鱼增重率和饲料系数的影响并确定胭脂鱼的适宜脂肪水平为6.62%~7.02%。根据现有的研究结果,该脂肪水平低于肉食性鱼类军曹鱼(Rachycentron canadum)(15%)[9]和鳜鱼(Siniperca chuatsi)(7%~12%)[16],高于草食性鱼类草鱼(Ctenopharyngodon idella)(4%)[10],而与肉食性鱼类脂肪需求相对较低的青鱼(Mylopharyngodon piceus)(6.5%)[19]比较接近。同时,等氮饲料脂肪水平变化必然引起饲料能量变化。对能蛋比和增重率、饲料系数进行回归分析,确定胭脂鱼的适宜能蛋比为45.77~45.96 kJ/g。
鱼类个体的生长实质上是通过蛋白质合成来实现的[20]。在蛋白质合成过程中,信使RNA和转运RNA是重要的参与者,RNA的浓度随组织生长而增加,而DNA的浓度保持相对稳定[21-22]。鱼体肌肉中RNA与DNA比值是一个精确地反映鱼类细胞合成能力和生长状况的指标[21]。本试验中肌肉RNA与DNA比值与增重率之间呈正相关,相关系数达到0.913 7。饲料脂肪水平增加,RNA与DNA比值先升高后降低,表明饲料中适宜的脂肪含量提高了肌肉蛋白质合成的速度[23]和细胞合成能力,促进了胭脂鱼的生长,而过量的脂肪使RNA与DNA比值,降低了肌肉蛋白质合成的速度和细胞合成能力,抑制了胭脂鱼的生长。
鱼类(特别是无胃鱼类)的机械消化能力很差,主要靠消化酶进行化学性消化,故消化酶活性可以反映其消化能力。饲料成分对鱼类消化酶活性的影响具有复杂性和效应的多样性[24]。饲料脂肪水平的变化不仅影响脂肪酶活性,还可能影响蛋白酶和淀粉酶的活性,而且研究的结果差异较大[7,25-27]。本试验中,脂肪水平对胭脂鱼肠道蛋白酶、脂肪酶和淀粉酶均有影响,而且脂肪最低水平(2.04%)组的肠道蛋白酶和淀粉酶活性明显高于其他组。这可能是因为饲料中脂肪供给不足,促使胭脂鱼增强对蛋白质和碳水化合物的消化吸收能力以维持其正常的生命活动。随着脂肪水平增加,肠道蛋白酶活性降低,这与王吉桥等[27]对七彩神仙鱼(Symphsodon discus)的研究和Morais等[25]对塞内加尔鳎(Solea senegalensis)的研究结果一致,说明脂肪水平对胭脂鱼肠道蛋白酶活性有抑制作用。随着脂肪水平增加,肠道淀粉酶活性呈先降低后稳定趋势,脂肪酶活性呈先升后稳定趋势,转折点均出现在6.88%组,其机制有待进一步探讨。
Scott等[28]和Lee等[29]研究证实,苹果酸脱氢酶、葡萄糖-6-磷酸脱氢酶活性的高低直接关系到还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的生成量,进而影响体内脂肪的合成。本试验中,饲料脂肪水平增加,肝胰脏中苹果酸脱氢酶活性降低,这与Jorge等[30]对塞内加尔鳎的研究一致,其他学者也有相似的报道[8-9]。这说明饲料脂肪水平增加抑制了胭脂鱼的脂肪合成代谢,其机制有待进一步研究。脂蛋白脂酶是脂肪分解的关键酶,生理作用是脂解血浆脂蛋白-甘油三酯而释放游离脂肪酸和单酸甘油酯,以供组织氧化供能和贮存[31]。它通过控制其在脂肪组织与其他组织器官表达水平的高低直接决定脂肪组织与其他组织器官脂质底物配额的相对量,从而间接决定从食物中摄入脂类的代谢前途——以体脂形式贮备起来或作为能源底物消耗掉,并最终对机体脂质蓄积状况产生决定性影响[32]。脂蛋白脂酶活性随脂肪水平的增加而降低,这可能与胭脂鱼摄入大量脂肪后,减少了对脂蛋白分解脂肪酸供能的依赖有关。无论是从肠道吸收的脂类还是机体自身组织合成的脂类(如,肝脏或脂肪组织合成的脂类),都要通过血液在体内运转。因此,血脂的来源既有外源性的,也有内源性的。Leibowitz等[33]、Choudhary等[34]和Lee等[35]对小白鼠的研究表明投喂高脂饲料组血清的甘油三酯和胆固醇含量显著高于对照组或低脂组,M arte等[36]对大西洋鳕(Gadus morhua)的研究中发现,高脂组血清甘油三酯和胆固醇高于低脂组,Kotaro等[37]对红鳍东方鲀(Takifugu rubripes)研究认为,血清甘油三酯随脂肪水平增加而增加。本试验研究结果与上述研究结果相似。根据上述试验结果推测,血脂水平增加可能与血清脂蛋白脂酶活性降低[38-39]以及外源脂肪摄入增加有关。
4 结 论
①胭脂鱼的适宜脂肪水平为6.62%~7.02%,最佳能蛋比为45.77~45.96 kJ/g。
②饲料脂肪水平对胭脂鱼肠道蛋白酶、淀粉酶活性有抑制作用。
③随饲料脂肪水平增加,胭脂鱼血脂水平增加,脂肪合成代谢酶和脂肪分解酶活性降低。
[1] Sun Y H,X ie C X,Wang W M,et al.The genetic variation and biogeography o f catostom id fishes based on m itochond rial and nucleic DNA sequences [J].Journal of Fish Biology,2007,70:291-309.
[2] Turner B J.Evolutionary Genetics of Fishes[M].New York:Plenum Press,1984.
[3] 杨 星,杨军峰,汤明亮,等.长江中国胭脂鱼群体的遗传分化[J].武汉大学学报(理学版),2006,52 (4):503-507.
[4] 张春光,赵亚辉,康景贵.我国胭脂鱼资源现状及其资源恢复途径的探讨[J].自然资源学报,2000,15 (2):155-158.
[5] 袁锡立,刘本祥,薛治国,等.胭脂鱼仔鱼开口饲料的初步研究[J].淡水渔业,2004,34(2):14-15.
[6] 陈 建,向 枭,段 彪,等.胭脂鱼幼鱼对粗蛋白质的需要量[J].中国畜牧杂志,2008,44(9):32-34.
[7] Zhou Q C,Zhou JB,ChiSY,et al.Effec tof dietary lipid level on grow th perform ance,feed utilization and digestive enzyme of juvenile ivory shell,Babylonia areolate[J].Aquaculture,2007,272:535-540.
[8] Chou B S,Shiau SY.Op tim al dietary lipid level for grow th o f juvenile hybrid tilapia,Oreochromis niloticus×Oreochrom is aureus[J].Aquaculture, 1996,143:185-195.
[9] W ang J T,Liu Y J,Tian L X,et al.Effect o f dietary lipid level on grow th performance,lipid deposition,hepatic lipogenesis in juvenile cobia(Rachycentron canadum)[J].Aquaculture,2005,249:439-447.
[10] Du Z Y,Liu Y J,Tian L X,et al.Ef fec tof dietary lipid level on grow th,feed utilization and body composition by juvenile grass carp(Ctenopharyngodon idella)[J].Aquaculture Nutrition,2005(11):139-146.
[11] Regost C,Arzel J,Cardinal M,et al.Dietary lipid level,hepatic lipogenesis and flesh quality in turbot (Psetta maxima)[J].Aquaculture,2001,193:291-309.
[12] Pedro B,Beatriz O,Susana C,et al.D ietary lipid level af fects grow th perform ance and nutrient utilization o f Senegalese so le(Solea senega lensis)juveniles[J].British Journal of Nutrition,2009,102: 1 007-1 014.
[13] 陈佳毅.脂肪(能量)蛋白比对梭鲈幼鱼生长和代谢的影响[D].硕士学位论文.苏州:苏州大学,2008. [14] 齐治家.生物化学[M].上海:上海技术出版社, 1985.
[15] 桂远明.水产动物机能学实验[M].北京:中国农业出版社,2004.
[16] 王贵英,曾可为,郑翠华,等.饲料脂肪水平对鳜鱼生长的影响研究[J].淡水渔业,2003,33(2):11-12.
[17] H uang C H,Lin W Y,Chu JH.Dietary lipid level influences fatty acid profiles,tissue composition, and lipid peroxidation of so ft-shelled turtle,Pelodiscus sinensis[J].Comparative Biochem istry and Physiology,2005,142:383-388.
[18] Lin Y H,Shiau S Y.D ietary lipid requirement of grouper,Epinephelus ma labaricus,and ef fec ts on immune responses[J].Aquaculture,2003,225:243-250.
[19] 刘梅珍,石文雷,朱晨炜,等.饲料中脂肪的含量对团头鲂鱼种生长的影响[J].水产学报,1992,16 (4):330-336.
[20] 文 华,高 文,罗 莉,等.草鱼幼鱼饲料的苏氨酸需要量[J].中国水产科学,2009,16(2):238-247.
[21] V idal E A G,D iMarco P,Lee P.Effec ts of starvation and recovery on the survival,grow th and RNA/ DNA ratio in loliginid squid paralarvae[J].Aquaculture,2006,260:94-105.
[22] Renee M A,Catherine K,Elaine M C.A mode l to estim ate grow th in young-o f-the-year tautog,Tautoga onitis,based on RNA/DNA ratio and seawater temperature[J].Journalof Experim entalMarine Bio logy and Ecology,2006,329:187-195.
[23] H itom i Y,Yoshia A.Increase in the level o f skeletalm uscle alpha-actin mRNA in rats fed a non protein diet supplemented w ith cystine and threonine [J].Bioscience,Biotechno logy,and Biochem istry, 1993,57(1):158-159.
[24] 黎军胜,李建林,吴婷婷.饲料成分与环境温度对奥尼罗非鱼消化酶活性的影响[J].中国水产科学, 2004,11(6):585-588.
[25] M orais S,Caballero M J,Conceica~o L E C,et al. Dietary neutral lipid level and source in Senegalese sole(Solea senegalensis)larvae:effect on grow th, lipidm etabolism and digestive capacity[J].Comparative Biochem istry and Physio logy,2006,144:57-69.
[26] Buchet V,Zambonino I J L,Cahu C L.Ef fect of lipid level in a compound dieton the development of red d rum Sciaenops ocellatus larvae[J].Aquaculture,2000,184:339-347.
[27] 王吉桥,耿加振,姜玉声,等.饲料中脂肪含量对七彩神仙鱼幼鱼生长和消化的影响[J].水产学杂志, 2009,22(1):24-30.
[28] Scott R A,Comnelius SG,M ersm ann H J.Ef fec ts o f age on lipogenesis and lipo lysis in lean and obese sw ine[J].Journal of Anim al Science,1981,52: 505-511.
[29] Lee Y B,Kauffman R G.Cellularity and lipogenic enzym e changes activities of proc ine intramuscular adipose tissue[J].Journal of Anim al Science,1974, 38:538-544.
[30] Jorge D,Rebeca R J,Stephan P,et al.Effect of dietary carbohyd rate-to-lipid ratios on grow th,lipid deposition andm etabolic hepatic enzym es in juvenile Senegalese sole(Solea senegalensis)[J].Aquaculture Research,2004,35:1 122-1 130.
[31] 刘 茜.草鱼LPL基因克隆及草鱼脂肪细胞提取与培养的研究[D].硕士学位论文.杨凌:西北农林科技大学,2007.
[32] 汪福保,罗 莉,李 云,等.镁对草鱼生长和脂肪代谢的影响[J].动物营养学报,2010,22(1):12-18.
[33] Leibowitz S F,Dourmashkin JT,Chang G Q,et al. A cute high-fat diet paradigms link galanin to triglycerides and their transport and metabolism in muscle [J].Brain Research,2004,1008:168-178.
[34] Choudhary M I,Naheed S,Jalil S,et al.Ef fects of ethanolic ex tract ofIris germanicaon lipid p rofile of rats fed on a high-fat diet[J].Journal of Ethnopharmacology,2005,98:217-220.
[35] Lee J,Chae K,Ha J,et al.Regulation of obesity and lipid disorders by herbalextracts fromMorus alba,Melissa o ffcina lis,andArtem isia capillarisin high-fat diet-induced obesem ice[J].Journalof Ethnopharmacology,2008,115(2):263-270.
[36] Marte A K,Anne V,Gerd M B,et al.Characterisation of lipid transport in A tlantic cod(Gadus morhua)w hen fasted and fed h igh or low fat diets [J].Aquaculture,2009,288:325-336.
[37] Kotaro K,Takeshi F,Nakahiro I,et al.Effect of dietary lipid levels on the grow th,feed utilization, body composition and blood characteristics of tiger pufferTakifugu rubripes[J].Aquaculture,2009, 298:111-117.
[38] 姚 煜,梁旭方,李光照,等.鳜脂蛋白脂酶和肝脂酶基因结构与组织表达[J].中国水产科学,2009, 16(4):506-517.
[39] N iu J,Liu Y J,Tian L X,et al.Effects of dietary phospholipid level in cobia(Rachycentron canadum) larvae:grow th,survival,p lasma lipids and enzymes of lipid metabolism[J].Fish Physiology and Biochem istry,2008,34:9-17.
*Correspond ing au thor,associate professor,E-mail:luoli1972@163.com
(编辑 菅景颖)
