马铃薯茎尖培养部分无机盐浓度对黄化苗发生的影响
2010-04-16马朝宏
黄 萍,马朝宏,颜 谦
(1.贵州省生物技术研究所,贵州 贵阳 550006;2.贵州省农业科学院科技开发处,贵州 贵阳 550006)
马铃薯茎尖培养又叫分生组织培养,是包括马铃薯在内的许多植物脱除病毒的重要手段。自1955年,法国人Moral和Martin通过茎尖培养,获得了无PVX、PVA和PVY的马铃薯植株后,这项技术快速发展,为解决马铃薯病毒危害提供了有效途径。
但是在马铃薯茎尖组织培养过程中,因品种差异,会出现培养茎尖在诱导过程中黄化苗发生严重的现象,影响了茎尖培养试管苗的构建。关于如何控制马铃薯茎尖诱导过程中黄化苗的发生还未见详细报道。本项目组多年来从事马铃薯的茎尖剥离培养工作,并开展了茎尖培养黄化苗发生的相关研究,以下是这一研究结果的报道。
1 材料与方法
1.1 试验材料
试材是贵州省马铃薯研究所选育的马铃薯新品种B01-31-9。
1.2 试验方法
1.2.1 马铃薯幼芽的获取
在田间筛选无病虫害感染、无损伤、健壮的薯块用于室内自然催芽,待芽长至2~5 cm时,切下幼芽。
1.2.2 消毒
将幼芽上的幼叶剥去,用70%酒精灭菌30 s、再用10%次氯酸钠溶液浸泡10~15 min后,无菌水清洗3~5次,备用。
1.2.3 茎尖剥离
将清洗干净的幼芽置于40倍双目解剖镜下,用解剖针去掉未展开幼叶,直至露出半圆形光滑生长点,用解剖刀从0.3mm处切下,将切下的茎尖接种在装有茎尖诱导培养基的试管或三角瓶内,每管接1个剥离后的茎尖(三角瓶内接4个),放入光照培养箱内培养(培养条件为2000lx,22℃,光照12h)。
1.2.4 茎尖诱导培养基类型
以MS作为马铃薯茎尖诱导的基本培养基,将MS培养基中的大量元素(NH4NO3、MgSO4·7H2O、CaCl2·2H2O及铁盐)作单因素试验(表1),其它因素仍为MS培养基中的使用浓度。外源激素浓度均为0.5 mg·L-16-BA和0.1 mg·L-1NAA,培养基pH值为6.0。每种培养基接种20个茎尖,重复3次。

表1 各因素试验设计(mg·L-1)Table 1 Experiment designs of inducing factors
1.2.5 方差分析
对各因素处理下茎尖培养过程中黄化率及成苗率情况用DPS数据处理系统软件进行新复极方差(SSR)分析,多重比较。
2 结果与分析
2.1 NH4NO3浓度改变对黄化苗的影响

图1 NH4NO3浓度改变对黄化苗数及成苗率的影响Figure 1 Influence of concentration of NH4NO3on the etiolation and differentiation
由图1可见,NH4NO3浓度大于或小于1 600 mg·L-1时,茎尖培养出现黄化苗的数量均较高,其中以浓度为2 000 mg·L-1形成黄化苗的平均数最高,达到3.8株,高出最低值3.4。但不同浓度处理对茎尖分化成苗数的影响差异不显著。方差分析结果证明:NH4NO3不同浓度间在黄化率上的差异达到显著水平(F=4.16,F0.05=3.48,F0.01=5.99),在茎尖成苗系数上的差异没有达到显著水平(F= 0.47,F0.05=3.48,F0.01=5.99)。经SSR的多重比较,NH4NO3浓度为1 600 mg·L-1与2 000 mg·L-1和1 800 mg·L-1的黄化率有显著差异(1 600 mg·L-1与2 000 mg·L-1,P=0.0045;1 600 mg·L-1与1 800 mg·L-1,P=0.095)。
2.2 MgSO4·7H2O浓度改变对黄化苗的影响
由图2可见,MgSO4·7H2O的浓度在600 mg·L-1时,茎尖培养出现黄化苗的比例最高;其次则是200 mg·L-1和500 mg·L-1;当浓度是400 mg·L-1时黄化苗数最低。在所试浓度范围内,400 mg·L-1最利于茎尖分化成苗,此时成苗率最高,是43%;当低于400 mg·L-1时,茎尖培养成苗率最低,为37%。
据方差分析表明,各浓度处理间在对马铃薯茎尖培养黄化苗发生的影响上达到了显著水平(F=5.42,F0.05=3.48,F0.01=5.99),而对茎尖分化成苗的影响差异未达到显著水平(F=0.59,F0.05= 3.48,F0.01=5.99)。由多重比较可知,400 mg·L-1与600 mg·L-1浓度虽对成苗率的影响差异不显著,但对黄化苗数的影响差异达到了极显著水平,此时P=0.0021。

图2 MgSO4·7H2O浓度改变对黄化苗数及成苗率的影响Figure 2 Influence of concentration of MgSO4·7H2O on etiolation and differentiation
2.3 铁盐浓度改变对黄化苗的影响
从图3可知,随着铁盐浓度的增加,黄花苗的发生降低,降低的幅度达3.4株。经方差分析,不同浓度处理和黄化苗发生的F值是20.3,远大于F0.05=4.07(F=20.3,F0.05=4.07,F0.01=7.59),表明铁盐的不同浓度处理间在黄化苗的发生上的差异达到了显著水平。各浓度处理下茎尖培养成苗的比例以13.9 mg·L-1和83.4 mg·L-1处理下最高(是42%),高出最低值5%,但经方差分析,各浓度处理对茎尖培养成苗影响的差异并不显著,F值是0.062,小于 4.07(F=0.062,F0.05=4.07,F0.01=7.59)。
在以上4种处理浓度中,当MS培养基中铁盐浓度只有13.9 mg·L-1(1/2倍)时,发生黄化苗的比例最高,与其它3个处理浓度达到了极显著差异(1/2倍与1倍,P=0.0011;1/2倍与2倍,P=0.0003<0.001;1/2与 3倍,P=0.0002<0.001)。
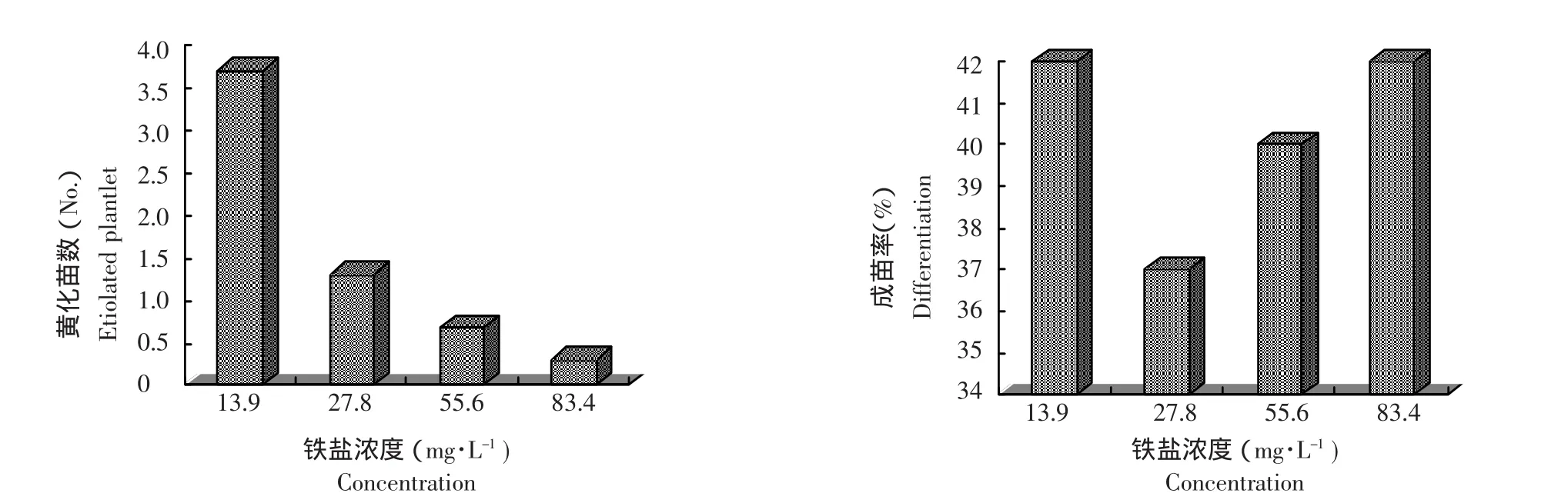
图3 铁盐浓度改变对黄化苗数及成苗率的影响Figure 3 Influence of concentration of iron salt on the etiolation and differentiation

图4 CaCl2·2H2O浓度改变对黄化苗数及成苗率的影响Figure 4 Influence of concentration of CaCI2·2H2O on the etiolation and differentiation
2.4 CaCl2·2H2O浓度改变对黄化苗的影响
在所试CaCl2·2H2O的各浓度处理中,低于或高于400 mg·L-1的浓度范围内黄化苗出现的比例均高出400 mg·L-1的,其中以600 mg·L-1的浓度下黄化苗的发生率最高;在200 mg·L-1至400 mg·L-1的浓度范围内,随CaCl2·2H2O浓度的增加,成苗率有增高的趋势,以后CaCl2·2H2O浓度再增加对成苗率的变化影响不大(图4)。据方差分析,CaCl2·2 H2O的各浓度处理对茎尖培养过程中黄化苗发生的均方比 F值是 2(F0.05=3.48,F0.01=5.99,P= 0.171),各浓度处理对茎尖培养成苗率的均方比值F=0.64(F0.05=3.48,F0.01=5.99,P=0.65),表明各处理因子对黄化苗发生及成苗率的影响均未达到显著水平,即本试验所设的各处理浓度对黄化苗的发生及分化的影响不大。
3 讨论
马铃薯茎尖组织培养过程中易出现苗黄化现象,严重时白化、甚至死苗,极不利于试管苗的构建和增殖。为缓解茎尖培养过程中黄化苗的发生,本试验设置了4种因子的不同浓度处理研究,结果证明:钙浓度对马铃薯茎尖培养过程中黄化苗的发生及成苗率的改变无显著影响;镁、氮和铁盐的浓度改变虽对茎尖成苗影响不明显但对茎尖培养过程中黄化苗的发生有显著的抑制作用;当镁和氮的使用浓度过高和过低时都会导致较高的黄化率发生,适当的使用浓度能明显地降低黄化率,此浓度范围与MS培养基中的接近;同时也证明高浓度的铁盐显著降低了黄化苗的发生机率,其中以3倍于MS培养基中的铁盐浓度的效果最佳,降幅达16%。
关于植物黄化苗研究的大田试验报道较多[1-2],主要原因是土壤营养元素(如氮、磷、钾等)的缺乏引起。武建林等[3]报道了土壤氮、磷、钾养分状况对植物缺铁黄化发生的重要影响,认为硝态氮的吸收和还原所产生或释放的氢氧根离子可引起植物体外pH升高,使铁的有效性降低,从而导致黄化[4]。万惠恩[5]在对黄瓜叶片黄化发生的研究中也提出,适当地调节氮、磷、钾浓度对于植物正常生长有明显促进作用,缺氮和氮过剩都会引起叶片黄化。以上报道的部分结论在我们的试验中得到了进一步的验证,证明在马铃薯茎尖培养过程中,增加铁盐浓度可明显降低黄化苗的发生,缺氮、镁和氮、镁过剩都会提高黄化率。但前面报道的有些结论,如大田试验中pH、磷、钾等因子也会引起植株黄化苗的发生,这是否适用于马铃薯的茎尖组织培养过程及最佳的使用浓度情况如何,还有待于以后的试验研究得出结论。
[1]潘佑找,费永俊.果树缺铁性黄化的原因及防治技术[J].森林病虫通讯,2000,19(4):30-31.
[2]蒋代华,李昆志,顾明华,等.银杏幼树黄化原因的探讨[J].广西农学报,2002,3(增刊):119-123.
[3] 武建林,李有文,李立平,等.植物黄化与氮磷钾营养的关系[J].西北农业学报,2004,13(1):104-108.
[4] Lucena J.Effects of bicarbonate,nitrate and other environmental factors on iron deficiency chlorosis:A review[J].Journal of Plant Nutrition,2000,23(11-12):1591-1606.
[5]万惠恩.温室黄瓜叶片八种黄化的识别与诊断措施[J].农业科技与信息,2004,21(1):39.
