兔 VX2肝癌动物模型的建立*
2010-04-13李祖茂周翔平
杨 林,李祖茂,周翔平
(1.川北医学院附属医院放射科,四川 南充 637000;2.川北医学院附属医院病理科,四川 南充 637000;3.四川大学华西医院放射科,四川 成都 610041)
原发性肝癌(p rimary hepatic carcinoma,PHC)的发病率在世界各地均呈上升趋势,也是我国常见的恶性肿瘤之一。PHC手术切除率仅 20%,在 PHC的非手术疗法中,介入治疗占有及其重要的地位。如何提高肝癌介入治疗的远期疗效仍是临床面临的重要课题。肝癌介入治疗的实验研究需要借助动物模型来完成。既往肝癌动物模型多采用化学药物诱导法建立在大鼠身上,该法具有诱导时间长和成瘤率低等缺点。另外,采用大鼠肝癌动物模型进行数字减影血管造影(diagnostic digital subtraction angiography,DSA)及肝动脉化疗栓塞(chemoembolization)治疗的研究多需开腹行肝动脉插管,操作较为复杂,动物死亡率较高。兔 VX2肿瘤是由 Shope等[1]使用病毒在兔皮肤诱导出的乳头状瘤,经 72次传代培养后,建立起来的鳞癌细胞株。由于兔缺乏针对该肿瘤的抗体,故此鳞癌极易在兔体内生长,常接种到兔的肝脏和肾脏等部位,制作原位肿瘤模型。本文介绍应用 VX2肿瘤组织块制作兔移植性肝癌模型方法。
1 材料与方法
1.1 实验动物:雄性新西兰大白兔 26只(平均体重2.0 kg),由四川大学华西实验动物中心提供(合格证号:10)。荷瘤兔由华中科技大学同济医学院冯敢生教授惠赠。
1.2 药物:10%水合氯醛;安定(天津金耀氨基酸有限公司);8%硫化钠;优维显 300(广州先灵公司);青霉素(华北制药股份有限公司);庆大霉素(乐山三九长征药业股份有限公司);聚维酮碘溶液(成都永安制药有限公司)。
1.3 设备:PHILIPS Brilliance 64层螺旋 CT(荷兰);MEDRADRSTELLANTTMCT 211高压注射器(美国 MEDRAD公司);SIEMENS AXIOM Artis FA DSA(德国)。
1.4 肝癌动物模型的建立:肿瘤移植手术由同一组医师(1名高年资外科主治医师,2名住院医师)进行。将大腿携有 VX2鳞状细胞癌的荷瘤兔全麻(10%水合氯醛 2.5ml/kg,安定 2.5mg/kg,腹腔注射),无菌条件下剥离肿瘤,切取靠近包膜的灰白色鱼肉样肿瘤组织,剔除坏死组织及纤维组织,用眼科剪将肿瘤组织剪碎至 2mm左右大小的瘤块,置于盛有生理盐水的无菌培养皿中备用。实验兔全麻(用药及剂量同前)后,仰卧固定于手术台上,手术野常规剪毛,8%硫化钠脱毛,消毒铺巾,取上腹正中切口,长约 2cm,逐层切口开腹壁各层,暴露肝脏,以平镊将肝左外叶拉出体外,于其组织较厚处,以眼科剪作一长约 3mm的小切口,经切口在肝内潜行分离,形成一个 3mm×5mm大小的腔隙,将一备用的瘤块植入其中,明胶海绵封闭肝脏切口,将肝脏回纳腹腔,4号丝线逐层缝合腹壁切口各层,关闭腹腔。待实验兔复苏后,送回动物中心饲养。术后肌肉注射青霉素及庆大霉素(青霉素 40000U/kg,庆大霉素2000U/kg),每天 1次,共 3天,以预防感染。
1.5 影像检查:接种后采用 CT扫描监测兔 VX2肿瘤生长情况。CT扫描包括上腹部平扫及增强双期(动脉期及门静脉期)扫描。于接种 VX 2肿瘤后2-3周,对实验兔进行 DSA。插管方法:切开股动脉,采用 3FSP微导管(日本 Terumo)进行腹腔动脉和肝动脉插管。造影后采用碘化油进行肝动脉栓塞。
1.6 病理学检查:实验完成后处死实验兔,进行病理学检查。
1.7 统计学处理:采用 SPSS 12.0统计软件对实验数据进行统计学处理。
2 结 果
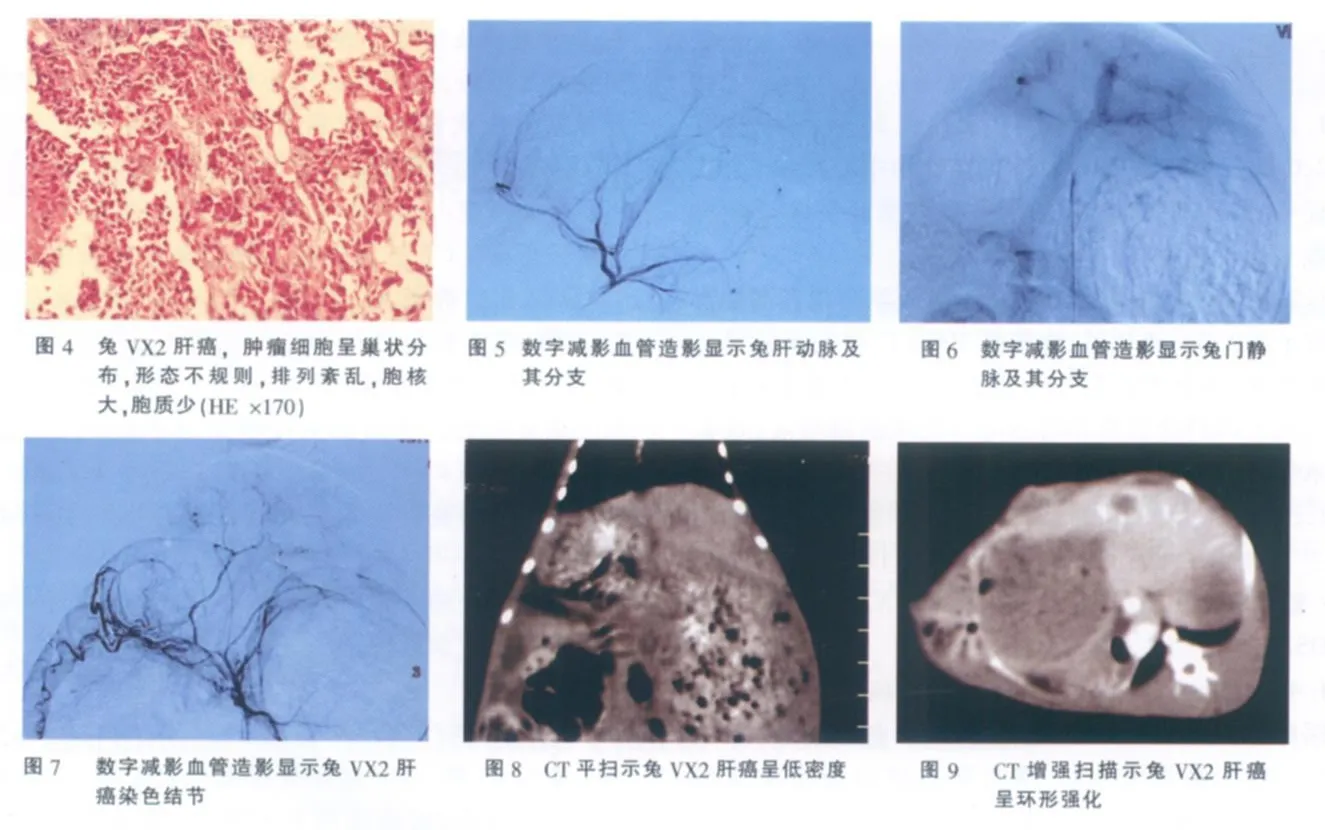
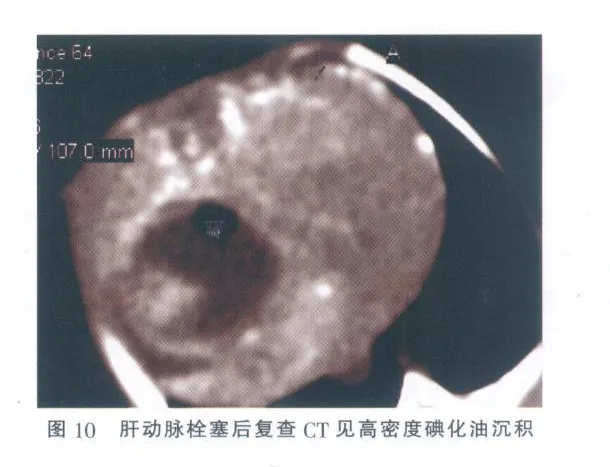
本组 26例,观察期间荷瘤兔生长正常,无感染及其他并发症,接种成功率 100%。肿瘤平均直径约 8.0 mm。在 CT平扫,瘤灶呈低密度,在肝动脉期,瘤灶表现为不同程度的环形强化,在门脉期,瘤灶呈低密度,与周围肝组织分界清楚。DSA可见肿瘤染色。肝动脉栓塞后见病灶内碘化油沉积较明显。病理学检查:肿瘤呈结节状,突出于肝表面,表面较光滑,质硬,切面呈灰白色,部分瘤灶中心有灰黄色凝固性坏死,瘤灶与周围正常肝组织分界清楚,部分可见包膜。光镜下,肿瘤细胞呈巢状分布,细胞较大,形态不规则,排列紊乱,血窦多,胞核大而深染,胞质量少,肿瘤组织与周围肝组织界限清楚(图1-10)。

3 讨 论
兔 VX2肝癌接种方法较多,主要有细胞悬液经皮穿刺肝实质注射种植法,经肠系膜上动脉或门静脉注射法,经肝动脉注射法,开腹直视下注射接种法和瘤块包埋法等[2-4]。种植方法不同,其成功率及其表现亦不尽相同,其中以开腹瘤块包埋法种植成功率较高。由于兔肝左叶体积明显大于右叶,肝左动脉较粗大,肝右动脉较细小,胆囊动脉又多来源于肝右动脉,为便于操作,以及在行肝动脉栓塞时避免栓塞材料进入胆囊动脉,常将瘤组织种植在肝左叶。本实验采用剖腹瘤块包埋法接种兔 VX2肝癌,瘤块多种植于肝左叶;瘤块植入后以明胶海绵块封闭肝切口,既避免了瘤块逆出致腹腔种植,又具有满意的止血效果;术中严格无菌操作,术后予以抗感染治疗,实验动物均无感染和出血,接种成功率 100%。
采用 CT扫描监测兔 VX2肝癌生长情况,无需开腹或处死实验动物,病灶显示清晰。本组兔 VX2肝癌在 CT平扫呈低密度,在动脉期呈不同程度环形强化,在门静脉期呈较低密度[5]。在 CT图像上,兔 VX2肝癌病灶与周围肝组织分界清楚,与病理检查结果一致。
关于兔 VX2肝癌的血供,文献中尚有争议。多数学者认为兔 VX2肝癌为富血供肿瘤[1,5-7]。Burgener等[1]对 VX2肝癌进行血管造影检查,发现VX2肝癌血供丰富。本组兔 VX2肝癌 DSA亦显示出肿瘤染色。但也有作者认兔 VX2肝癌血供并不丰富[8,9]。
目前,应用 CT灌注成像研究肿瘤血供已经成为影像学的热点[10-14],但关于动物肝脏 CT灌注成像(CT perfusion imaging,CTPI)的研究报道却较少。文献中关于正常兔肝血流灌注的研究所测得兔肝血流灌注值的差异也较大[15-18],可能与各研究者所用方法和条件不同有关。Zhang等[19]对移植于兔大腿的 VX2瘤进行 CT灌注成像研究,结果显示 VX2瘤的血流量(blood flow,BF)、血容量(blood volume,BV)和表面通透性(permeability surface,PS)均高于正常肌肉组织,而平均通过时间(mean transit time,MTT)低于正常肌肉组织。Kapanen等[20]采用 CT灌注成像研究 5只新西兰大白兔 VX 2肝癌,发现兔VX2肝癌的动脉灌注量显著高于正常肝脏的动脉灌注量,而门静脉灌注量显著低于正常肝脏的门静脉灌注量。杨林等[21]采用 CT灌注成像技术对比研究 10例兔 VX2肝癌和 8例正常兔(对照组)血流灌注差异,发现兔 VX2肝癌肝动脉灌注量(hepatic arterial perfusion,HAP)和肝动脉灌注指数(hepatic arterial perfusion index,HAPI)高于对照组;门静脉灌注量(hepatic portal perfusion,HPP)、总肝灌注量(total liver perfusion,TLP)和门静脉灌注指数(hepatic portal perfuiosn index,HPPI)低于对照组。以上研究表明兔 VX2肝癌是主要由肝动脉供血的富血供肿瘤,与人类 PHC血流动力学特点相似,是PHC介入治疗实验研究的理想动物模型。
[1] Shop RE,Hurst EW.Infectious papillomatosis of rabbits:with a note on the histopathology[J].JExp Med,1933,58(5):607-624
[2] Kapanen MK,Halavaara JT,Hakkinen AM.Assessment of vascular physiology of tumorous livers:comparison of two differentmethods[J].Acad Radiol,2003,10(9):1021-1029
[3] Lin WY,Chen J,Lin Y,et al.Implantation of VX2 carcinoma into the liver of rabbits:a comparison of three direct-injection methods[J].JVet Med Sci,2002,64(7):649-652
[4] Tada Y,Tabuchi Y,Saito Y.Establishment of an experimental model with a high frequency of liver metastasis and recurrence from gastric VX2 cancer:histological analysisof the developmental process of primary andmetastatic cancer lesions[J].Nippon Geka Gakkai Zasshi,1992,93(8):818-826
[5] 杨 林,周翔平,官泳松,等.兔 VX 2肝癌 MSCT评价及病理特征[J].中国医学影像技术,2007,23(4):623-625
[6] Kim YI,Chung JW,Park JH,et al.Intraarterial gene delivery in rabbit hepatic tumors:transfection with nonviral vector by using iodized oil emulsion[J].Radiology,2006,240(3):771-777
[7] Maruyama H,Matsutani S,Saisho H,et al.Sonographic shift of hypervascular liver tumor on blood poolharmonic images with definity:time-related changes of contrast-enhanced appearance in rabbit VX2 tumor under extra-low acoustic power[J].Eur JRadiol,2005,56(1):60-65
[8] MitsumoriM,Hiraoka M,Shibata T,et al.Targeted hyperthermia using dextranmagnetite complex:a new treatmentmodality for liver tumors[J].Hepatogastroenterology,1996,43(12):1431-1437
[9] Kuszyk BS,Bluemke DA,Choti MA,et al.Contrast-enhanced CT of small hypovascular hepatic tumors:effect of lesion enhancement on conspicuity in rabbits[J].AJR,2000,174(2):471-475
[10]Kaneko A,Naomoto Y,Aoyama M,et al.Tissue levels of chemotherapeutic agents for hepaticmetastasis during hepatic arterial and portal injection[J].In vivo,1999,13(2):195-198
[11]Miles KA,Hayball MP,Dixon AK.Functional images of hepatic perfusion obtained with dynamic CT[J].Radiology,1993,188(2):405-411
[12]Miles KA,Leggett DA,Kelley BB,et al.In vivo assessment of neovascularization of livermetastasesusing perfusion CT[J].Br J Radiol,1998,71(843):276-281
[13]Leggett DA,Kelley BB,Bunce IH,et al.Colorectal cancer:diagnostic potentialofCTmeasurementsofhepatic perfusion and implications for contrast enhancement protocols[J].Radiology,1997,205(3):716-720
[14]Pandharipande PV,K rinsky GA,Rusinek H,etal.Perfusion imaging of the liver:currentchallengesand future goals[J].Radiology,2005,234(3):661-673
[15]Purdie TG,Henderson E,Lee TY.Functional CT imaging of angiogenesis in rabbit VX2 soft-tissue tumour[J].Phys Med Biol,2001,46(12):3161-3175
[16]Kapanen MK,Halavaara JT,Hakkinen AM.Open four-compartmentmodel in themeasurementof liver perfusion[J].Acad Radiol,2005,12(12):1542-1550
[17]Halavaara JT,Hamberg LM,Leong FS,etal.Functional CT with an experimental intravascular contrast agent in the assessment of liver vascular physiology[J].Acad Radiol,1996,3(11):946-952
[18]Materne R,Van Beers BE,Sm ith AM,et al.Non-invasive quantification of liver perfusion with dynam ic computed tomography and a dual-input one-compartmentalmodel[J].Clin Sci(Lond),2000,99(6):517-525
[19]Zhang J,Wang R,Wang M,et al.Experimental study of multislice spiralCT perfusion imaging in VX2 soft-tissue tumor of rabbits[J].JHuazhong Univ SciTechnolog Med Sci,2006,26(3):341-343
[20]Kapanen MK,Halavaara JT,Hakkinen AM.Assessmentofvascular physiologyof tumorous livers:comparison of twodifferentmethods[J].Acad Radiol,2003,10(9):1021-1029
[21]杨 林,张小明,周翔平,等.兔VX 2肝癌血流灌注的 MDCT灌注成像评价[J].当代医学(中国介入放射学),2009,3(4):464-467
