星点设计优化5-氟尿嘧啶壳聚糖微囊的制备工艺
2010-04-06张海峰
张海峰 ,王 玮,白 颖,杨 浩 ,赵 辉
(河南大学药学院药剂学教研室,河南 开封 475004)
星点设计优化5-氟尿嘧啶壳聚糖微囊的制备工艺
张海峰 ,王 玮*,白 颖,杨 浩 ,赵 辉
(河南大学药学院药剂学教研室,河南 开封 475004)
目的:应用星点设计法优化5-氟尿嘧啶壳聚糖微囊的制备工艺,以提高微囊性质的可预测性。方法:以壳聚糖为囊材,采用单凝聚法将5-氟尿嘧啶微囊化,以载药量、包封率、粒径、跨距为因变量对壳聚糖浓度、芯壁比、乳化剂用量和成囊温度4个自变量的各水平进行多元线性回归和二项式拟合,并进行预测分析。结果:通过星点设计法得出微囊的最佳制备工艺条件为:壳聚糖浓度为质量分数0.15%,芯壁比1.5,乳化剂的用量8%,成囊温度50℃。结论:星点设计法优化微囊制备工艺预测性良好,制得的微囊具有囊型好、粒径分布均匀、重现性好、包封率高且制备工艺稳定的特点。
壳聚糖;氟尿嘧啶;微囊;单凝聚法;星点设计法
壳聚糖(Chitosan,CS)来源广泛,性质稳定,生物相容性和降解性好,毒性极小,应用范围广泛,在药剂学领域中应用极为活跃。它在缓释制剂中作为微囊、微球的囊材或载体,也可以作为缓释片、缓释膜的骨架材料[1]。5-氟尿嘧啶(5-fluorouracil,5-fu)是一种时间效应性抗代谢、抗肿瘤药物,已广泛用于消化道癌症及其他实体瘤的治疗[2]。但5-fu血浆半衰期极短,需频繁给药,且毒副作用较大,不易被患者所接受,有必要制备结肠定位给药制剂。为了确立最佳的制备工艺,本文用星点设计法对成囊工艺进行了优化。
星点设计(central composite design,CCD),安排试验方法简便,试验次数较少,且在中心点进行重现性试验,可以提高数学模型预测的准确性[3]。其特点各实验点距中心点的距离相等,自变量的极端水平为实验所允许的极大、极小值,一次设计即可获得较佳条件,与以往常用的正交设计、均匀设计相比,具有精度高、预测性好的优点。
1 材料与仪器
1.1 材料
壳聚糖(济南海得贝海洋生物工程有限公司,脱乙酰度90.5%);5-fu(武汉合中生化制造有限公司,批号20080506);戊二醛(天津博迪化工有限公司);硫酸钠(淄川双丰化工厂,批号 20070520);吐温(天津市红岩化学试剂厂,批号 20060824);冰醋酸(天津市福晨化学试剂厂,批号 20060808);氢氧化钠(天津石英钟厂霸州市化工分厂)等。
1.2 仪器
CL-3型恒温加热磁力搅拌器(郑州长城科工贸有限公司);XS-2000型生物显微镜(济南胜利科学器材有限公司);JSM-5600LV型扫描电子显微镜(日本电子);754型紫外分光光度计(上海精密科学仪器有限公司);YP-600型电子天平(上海第二天平仪器厂)等。
2 实验方法
2.1 5-fu标准曲线的绘制
2.1.1 5-fu紫外测试波长的选择 将5-fu、壳聚糖用0.1mol/L盐酸分别配制成20mg/L的溶液,在200~400nm波长范围内,进行紫外吸收波长扫描,确定5-fu在266nm处有最大吸收,而壳聚糖在266nm处几乎没有吸收。故确定5-fu标准曲线在紫外分光光度计波长266nm处测定。
2.1.2 5-fu的标准曲线的建立 精密称取105℃下干燥至恒重的5-fu 50.0mg,置于100mL容量瓶中,加蒸馏水定容至刻度,溶解摇匀,即得0.5 g/L的5-fu贮备液。精密量取5-fu贮备液5.0mL于25mL容量瓶中,用甲醇定容至刻度,摇匀。分别精密吸取0.2、0.4、0.6、0.8、1.0、1.2、1.4mL 于 10mL 容量瓶中 ,以甲醇定容,在波长266nm处测定吸收度 A值。以吸收度 A值为纵坐标,标准溶液浓度为横坐标进行线性回归,得回归方程:A=0.0506C+0.0480,相关系数 r=0.9995,5-fu在浓度2~14mg/L有较好的线性关系。
2.2 单凝聚法制备微囊
分别称取一定质量的壳聚糖,充分溶解于体积分数为2.0%的稀醋酸溶液中,制得不同浓度的壳聚糖稀酸溶液。量取处方量的5-fu溶液(200 g/L)和吐温加入其中,随后开始水浴加热并搅拌使其乳化。待乳化完成后,调节体系p H至4~5,加入沉淀剂使之凝聚,用一定体积的蒸馏水稀释上述母液,再调节体系的p H至8.5左右,最后加入戊二醛进行固化。放置60min沉降、抽滤、洗涤、干燥,收取微囊。
2.3 微囊制备工艺的实验方案设计
在预试验的基础上,选取对微囊性质影响较显著的4个因素作为考察对象,即壳聚糖浓度、芯壁比、乳化剂的用量和成囊温度。根据CCD的原理[4-5],每个因素设5个水平,各因素的极大和极小水平根据预实验结果和制备的实际需要而定。因素及水平见表1,实验安排见表2。
以载药量、包封率、平均粒径为因变量,分别对各因素(自变量)各水平进行多元线性回归和二项式拟合。多元线性回归:Y=b0+b1X1+b2X2+b3X3+b4X4,二项式拟合:Y = b0+b1X1+b2X2+b3X3+b4X4+b5X12+b6X22+b7X32+b8X42+b9X1X2+b10X1X3+b11X1X4+b12X2X3+b13X2X4+b14X3X4。删除拟合优度不佳(lack of fit)即 P<0.05的各相关系数,再进行拟合,求得简化方程,以该数学模型为基础,描绘三维因变量面(response surface),由因变量面选取较佳工艺条件,按较佳工艺制备微囊,并进行预测分析。

表1 星点设计的因素及水平表

表2 星点设计实验表及各项值
3 结果
3.1 微囊形状及粒径分布
在显微镜下观察大部分微囊为球形单囊,且囊形圆整、分散较好、不粘连。用校正过的带目镜测微尺的显微镜测微囊的囊径大小与分布,计数3批,每批300个。结果发现在壳聚糖浓度较大的条件下制得的微囊粒径相对较大,在壳聚糖浓度较小的条件下制得的微囊粒径相对较小。
3.2 载药量及包封率的测定
将制得的(不同条件)壳聚糖-5-fu微囊置于研钵中研细,精密称取微囊适量Wm(g),用0.1mol/L的盐酸溶液溶解,经超声粉碎,抽滤得提取液,定容至50mL。以0.1mol/L盐酸溶液为空白,在266nm处测定其吸光度值 A,根据5-fu标准曲线的回归方程计算其浓度C(mg/L),再计算载药量和包封率(见表2)。

式中:Wc为被包裹入微囊的5-fu的量;Wm为壳聚糖微囊及所包裹5-fu的总重量;W0为加入的5-fu药物总量。
3.3 最佳实验条件的确定
由图1所示星点设计优化的最佳实验条件是壳聚糖浓度为质量分数0.15%、芯壁比为1.5、乳化剂用量为8%、成囊温度50℃,并由此最佳制备工艺制备的微囊符合要求。此条件下制得的微囊外观见图2。

图1 响应优化器寻优结果

图2 最佳条件下制得的微囊外观图
3.3.1 载药量和包封率 按照3.2中的测定方法,测定以最佳制备工艺条件下制备的CS-5-fu微囊的载药量和包封率。3批CS-5-fu微囊的测定结果见表3。

表3 载药量和包封率结果
3.3.2 微囊形状及粒径分布 按最佳制备工艺条件下制备5-fu微囊,并在光学显微镜下观察。大部分微囊为球形单囊,且囊形圆整、分散较好、不粘连。用校正过的带目镜测微尺的显微镜测微囊的囊径大小与分布,计数3批,每批300个。微囊的平均粒径为(12.66±3.26)μm,跨距为0.78,粒径分布见图3。
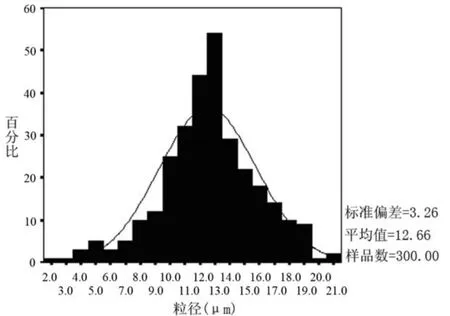
图3 CS-5-fu微囊的粒径分布图
3.3.3 粒径、包封率与载药量的关系 由图4可以看出,当减小粒径时,跨距增大,载药量和包封率减少;当提高载药量时,粒径可能变大。针对这些因素,只有对载药量、包封率等指标综合考虑,其优化的条件才是最佳选择。

图4 粒径、包封率与载药量的3D散点关系图
4 讨论
CS浓度在质量分数为0.1~0.5%左右时候,能形成均匀的圆形微囊,且粒径随着浓度的升高而增大。随着CS浓度升的更高时,CS醋酸溶液的黏度将会增加,不易成囊。
反应温度为50℃时该反应体系所成的微囊包封率理想,微囊粒径均一度高。温度太高时,由于溶剂蒸发,形成局部浓度过浓,囊材相互凝聚而不能成囊,在显微镜下可见CS成絮状凝出。如温度太低,由于囊材相互之间不能很好融熔,因此成囊也不理想。当凝聚成囊后,必须使其在较低的温度下胶凝。
从电解质对胶凝的影响看,阴离子起主要作用,其电荷数愈高胶凝作用愈强。常见的阴离子中,SO42-促进胶凝的作用最强,Cl-次之,而SCN-则可阻止胶凝。据此,本研究所选用的凝聚剂是Na2SO4,所需加入的量与所使用的CS的分子量有关,随着分子量的增加而增加。
在制备工艺和处方筛选中,可采用统计学软件模拟模型对最佳工艺进行预测。本文所选取的指标均为量化指标,以提高优化预测的准确性。本文选定了4个主要指标:载药量、包封率、粒径和跨距,其中载药量、包封率越大越好,提高载药量可以相应减少给药微囊的量;粒径越小,混悬及注射时均较方便,且还能实现靶向部位给药;跨距越小,微囊粒径分布均匀,有利于控制质量,保证平稳的释放曲线。
[1]王小红,马建标,何炳林.甲壳素、壳聚糖及其衍生物的应用[J].功能高分子学报,1999,12(2):199-202.
[2]王海艳,季宇彬.5-氟尿嘧啶现代给药系统研究进展[J].上海医药,2007,28(10):452-455.
[3]吴伟,崔光华.星点设计-效应面优化法及其在药学中的应用[J].国外医学:药学分册,2000,27(5):292-298.
[4]Takayama K,Nagai T.Novel computer optimization methodology for pharmaceutical formulations investigated by using sustained-release granules of indomethacin[J].Chem Pharm Bull,1989,37(1):160-167.
[5]Do B,Robinet S,Pradeau D,et al.Application of central composite designs for optimization of the chromatographic separation of monomerthylarsonate and dimethylarsinate and of selenomethionine and selenite by ion-pair chromatography coupled with plasma mass spectrometric detection[J].Analyst,2001,12(6):594.
[责任编辑 姬 荷]
Optimization of the preparation for chitosan 5 fu microcapsules by central composite design
ZHANG Hai-feng,WANG Wei*,BAI Ying,YANG Hao,ZHAO Hui(Pharmaceutical College ofHenan University,Kaifeng,Henan475004,China)
Objective:To use central composite design to optimize the preparation of chitosan-5-fu microcapsules,and to enhance predicting the properties microcapsules.Methods:Microcapsules were prepared by monophasic coagulation method with chitosan as capsule material.The effects of four independent variables were evaluated on a number of response variables.The response variables selected in this study were the drug loading,the loading efficiency and the mean diameter.The second order polynomial and linear equations were fitted to the data,and the resulting equations were predicted and analyzed.Results:The best technique to prepare the microcapsules is the concentration of CS=0.15%,the proportion of core to wall 1.5,emulsifier dosage 8%,T=50℃.Conclusion:The central composite design to optimize the preparation of chitosan microcapsules containing 5-fu has the good predicting properties,the shape of capsule prepared is good,well-repeated,well-sealed and stable,and the particles are evenly distributed.
chitosan;5-fu;microcapsules;monophasic coagulation;central composite design
O636
A
1672-7606(2010)04-0249-04
2010-08-10
河南大学校内基金项目(04YBRW060)
张海峰(1983-),男,河南信阳人,硕士研究生,从事药物缓控释与微粒靶向制剂的研究工作。
*通讯作者:王玮(1964-),男,河南 开封 人,博士,硕士生导师,教授,从事药物缓控释与微粒靶向制剂的研究工作。
