高效液相色谱法测定蜂王幼虫中辅酶Q10含量
2010-03-25薛晓锋吴黎明
岳 兵,薛晓锋,2,吴黎明,李 熠,赵 静,*
(1.中国农业科学院蜜蜂研究所,农业部蜂产品质量监督检验测试中心(北京),北京 100093;2.国家农产品加工技术研发中心蜂业分中心,北京 100093)
高效液相色谱法测定蜂王幼虫中辅酶Q10含量
岳 兵1,薛晓锋1,2,吴黎明1,李 熠1,赵 静1,*
(1.中国农业科学院蜜蜂研究所,农业部蜂产品质量监督检验测试中心(北京),北京 100093;2.国家农产品加工技术研发中心蜂业分中心,北京 100093)
建立一种用高效液相色谱测定蜂王幼虫中辅酶Q10含量的方法。蜂王幼虫样品研磨均质后,经无水乙醇-正己烷液/液萃取,提取液经浓缩后,无水乙醇定容。以甲醇为流动相,采用XBridge shield RP18柱分离,在紫外检测器275nm波长处对样品中的辅酶Q10进行测定。辅酶Q10在12min内得到较好的分离,方法线性良好,回收率为95.0%~101.8%,相对标准偏差(RSD)小于8%,检出限为0.23mg/L。该方法操作简单、准确、可靠、灵敏度高,适用于测定蜂王幼虫中辅酶Q10的含量,已被用于分析一些实际样品,调查辅酶Q10在蜂王幼虫样品中的含量情况。
辅酶Q10;蜂王幼虫;液/液萃取;高效液相色谱
辅酶Q10(CoQ10)是一种醌类化合物,又叫癸烯醌、泛醌,为脂溶性醌类化合物,化学名称2,3-二甲氧基-5-甲基-6-癸异戊烯基苯醌,因其异戊烯基的聚合度为10而得名(即n=10),如图1所示。1957年从牛心线粒体中分离得到[1],广泛存在于生物体中。辅酶Q10的生物活性主要来自于其醌环的氧化还原特性和其侧链的理化性质。它是细胞自身产生的天然抗氧化剂和细胞代谢激活剂[2]。它的作用是清除氧自由基、维护线粒体结构和功能完整性、稳定细胞膜、抑制自由基形成和增强免疫活性[3]。因此,辅酶Q10已经逐渐成为保健食品、化妆品等评价的重要指标。
蜂王幼虫即蜂皇胎,也称蜂王胎、蜂子等,是由蜜蜂受精卵孵化而成的,专门食用蜂皇浆,长成后即为蜂王,是一种营养物质、生物活性物质极为丰富的
生物资源,但其体内的辅酶Q10的含量尚无文献报道。本研究对蜂王幼虫中辅酶Q10进行测定,旨在建立一种定量蜂王幼虫中辅酶Q10的高效液相色谱法,以进一步证明蜂王幼虫的食用、保健价值。
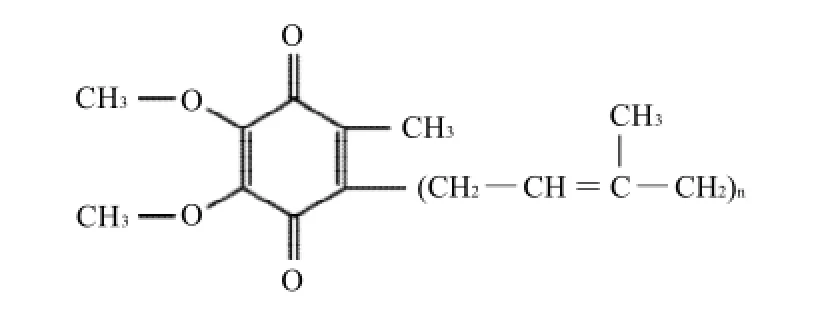
图1 辅酶Q10分子结构Fig.1 Molecular structure of coenzyme Q10
1 材料与方法
1.1 材料与试剂
蜂王幼虫 浙江平湖种蜂场。
辅酶Q10标准品 Sigma公司;甲醇(色谱纯)、正己烷(色谱纯)、无水乙醇(分析纯)。
1.2 仪器与设备
Waters 2695高效液相色谱仪、WatersTM486紫外-可见光波长检测器、Empower 2工作站 美国Waters公司;Heidolph旋转蒸发仪 德国Heidolph公司;UV-2550光谱仪 日本岛津公司;Milli-Q超纯水器 美国Millipore公司;舒美KQ218超声清洗仪 中国昆山市超声仪器有限公司。
1.3 标准溶液的配制
准确称取25mg辅酶Q10标准品溶于100mL无水乙醇,配成250μg/mL的储备液,在避光条件下4℃保存。分别吸取标准储备液,用无水乙醇稀释并在棕色容量瓶中定容得质量浓度分别为1、10、50、100、250μg/mL系列标准工作溶液。
1.4 样品处理
蜂王幼虫自王台中取出后,用生理盐水洗去虫体附着的王浆,滤去水分,装入样品瓶,冷冻保存。实验时,将样品冷冻研磨,均质后,根据样品含量,称取4g左右样品(冻干粉1g),精确至0.0001g,置于50mL棕色容量瓶中,加无水乙醇20mL,超声提取5min后,加20mL正己烷萃取,振荡、摇匀,分层后取上清液,反复萃取3次,合并上清液,旋转蒸发,浓缩后,加2mL无水乙醇溶解,过0.22μm滤膜,避光、4℃保存,待测定。
1.5 色谱条件
色谱柱:XBridgeTMshield RP18(150mm×4.6mm,5μm);流动相:100%甲醇;色谱柱温度:30℃;流速:1mL/min;进样体积:5μL;检测波长:275nm。以保留时间定性,峰面积定量。
2 结果与分析
2.1 前处理条件的选择
吕春茂等[4]比较了辅酶Q10的几种提取方法,分别选用了无水乙醇、正己烷、丙酮几种溶剂。该实验在对蜂王幼虫实际样本的研究基础上,比较无水乙醇和正己烷两种提取剂,通过对样品进行提取、比较,结果显示:用正己烷提取的杂质较少,样品净化的比较好,但回收率偏低,而用无水乙醇提取的杂质比较多,但回收率较高(表1),分别用两种溶剂提取的效果的差异与辅酶Q10的结构密切相关,辅酶Q10更容易溶于极性更强的乙醇。鉴于此,确定了样品的处理方法:用乙醇和正己烷进行液液萃取。

表1 比较不同提取方法对蜂王幼虫中的辅酶Q10的提取效果(n=3)Table 1 Extraction recovery (the average values of 3 replicates) of coenzyme Q10with n-hexane followed by absolute ethanol or each of them alone (n=3)
2.2 色谱条件的优化
2.2.1 色谱柱的选择
文献报道用于测定辅酶Q10的色谱柱有Zobax SB C18、Waters C18、TSK C18、Symmetry C18等[5-8]几种色谱柱,均属于C18柱,因此,该研究以C18柱为考察对象,同时考察了Zobax SB C18、Symmetry C18和XBridgeTMshield RP18柱。发现,不同色谱柱对辅酶Q10的分离情况影响不大,但XBridgeTMshield RP18分离效果好、分析时间短,因此选用XBridgeTMshield RP18作为分析色谱柱。
2.2.2 流动相的选择

图2 蜂王幼虫样品的色谱图(a)和辅酶Q10标样的色谱图(b)Fig.2 HPLC chromatograms of queen bee larva (a) and coenzyme Q10 standard (b)
乙腈、四氢呋喃、正己烷、乙醇、甲醇和异丙醇可用作测定辅酶Q10的流动相[9-11],该实验比较乙腈、甲醇和异丙醇3种流动相,实验结果表明:乙腈、异丙醇的洗脱能力过强,出峰时间过快,与杂质峰无法分开。当用甲醇作为流动相时,辅酶Q10的色谱峰能很好地和溶剂峰、杂质峰分离,在此条件下,标样和实际样品的色谱见图2。
2.3 检测波长的选择
根据辅酶Q10的紫外光谱图(图3)可以看出其最大特征波长为202nm,另一特征波长为274.5nm。由于202nm属于紫外末端吸收,在此波长处,样品的测定受到基质的干扰严重。故将检测波长定在274.5nm左右,所以选定在275nm,这样基质本身较小的杂质峰就不再显现,从而可以保证测定结果的准确性。图3为辅酶Q10的紫外光谱图。

图3 辅酶Q10的紫外光谱图Fig.3 UV-visible absorption spectrum of coenzyme Q10
2.4 线性范围和检出限
从1、10、50、100、250μg/mL系列标准工作溶液分别移取适量辅酶Q10,进样5μL,并以峰面积对质量浓度做回归方程。按上述色谱条件分析,结果表明,在1~250μg/mL范围内,峰面积与质量浓度呈良好的线性关系:Y=10623X-11529(R2=0.9999)。检出限为0.23mg/L (RSN=3)。
2.5 方法加标回收率和精密度
采用在实际样品(蜂王幼虫)中添加1、10、50mg/kg 3个水平标样,测定方法的回收率和精密度,每个水平平行分析6次(n=6)。不同添加水平下,辅酶Q10的回收率为95.0%~101.8%,RSD均小于8%,见表2。

表2 辅酶Q10的加标回收率(n=6)Table 2 Average recoveries of 6 replicates for coenzyme Q10in a real sample spiked at 3 levels
2.6 实际样品的测定
应用本方法测定一些来自蜂场蜂王幼虫与市场的蜂王幼虫冻干粉样品中的辅酶Q10的含量,分析结果见表3。

表3 实际样品中辅酶Q10测定结果Table 3 Results of determination of coenzyme Q10in fresh and commercial lyophilized queen bee larvae samples
从表3可以看出,从蜂场取出的新鲜蜂王幼虫样品中,辅酶Q10的含量明显低于来自市场的蜂王幼虫冻干粉,有的甚至低几倍。这种结果说明,蜂王幼虫经过浓缩、加工制成商品蜂王幼虫冻干粉后,辅酶Q10也得到了富集。调查了几种保健产品和天然产物含量,都低于蜂王幼虫和其市售的蜂王幼虫冻干粉。可见,蜂王幼虫的保健价值非常高。
3 结 论
本研究建立了一种高效液相色谱方法并对蜂王幼虫中辅酶Q10进行了定量测定,本方法快速、简单、准确,适用于测定蜂王幼虫及冻干粉中辅酶Q10。应用本方法对市场上的一些蜂王幼虫产品中的辅酶Q10含量进行测定,结果发现在这些样品中辅酶Q10的含量较高,辅酶Q10作为一种活性物质,有可能作为一种指标来评价蜂王幼虫的质量。
[1]黄伟, 徐建忠, 冯晓亮, 等. 辅酶Q10研究新进展[J]. 河南化工, 2003 (2): 12-14.
[2]张鸿, 吴玉荷. 类维生素物质-辅酶Q10的研究进展[J]. 国外医学: 卫生学分册, 2002, 29(6): 370-372.
[3]肖新才, 冯翔. 辅酶Q10抗氧化作用研究进展[J]. 国外医学: 卫生学分册, 2003, 30(4): 216-217.
[4]吕春茂, 李英华, 安艳秋, 等. 辅酶Q10几种提取工艺的优化研究[J].食品科学, 2007, 28(12): 132-135.
[5]LEE L B, CHOON N O. Comprehensive high-performance liquid chromatographic method for the measurements of lipophilic antioxidants in human plasma[J]. Journal of Chromatography A, 2009, 1216(15): 3131-3137.
[6]JIMENEZ J R, CAPOTE F P, MATA J M, et al. Determination of the ubiquinol-10 and ubiquinone-10 (coenzyme Q10) in human serum by liquid chromatography tandem mass spectrometry to evaluate the oxidative stress[J]. Journal of Chromatography A, 2007, 1175(2): 242-248.
[7]方从容, 杨大进, 马兰, 等. 反相高效液相色谱法测定保健食品中辅酶Q10的含量[J]. 中国卫生工程学, 2007, 6(3): 165-166.
[8]王辛, 乔海鸥, 穆敏杰, 等. 保健食品中辅酶Q10含量的测定及其提取条件的研究[J]. 中国卫生检验杂志, 2008, 18(7): 1321-1322.
[9]江平, 辛剑, 郑育芳, 等. 反相高效液相色谱法测定化妆品中辅酶Q10的含量[J]. 分析试验室, 2004, 23(11): 30-32.
[10]李万仓, 郑宏燕, 张惠娟, 等. 高效液相色谱测定构树叶中辅酶Q10含量[J]. 营养学报, 2008, 30(4): 417-419.
[11]孙心齐, 焦贺贤, 王金中, 等. 非极性流动相高效液相色谱法定量测定辅酶Q10[J]. 化学研究, 2004, 15(3): 56-58.
HPLC Determination of Coenzyme Q10 in Queen Bee Larvae
YUE Bing1,XUE Xiao-feng1,2,WU Li-ming1,LI Yi1,ZHAO Jing1,*
(1. Institute of Apicultural Research, Chinese Academy of Agricultural Sciences, Bee Products Quality Supervision and Testing Center, Ministry of Agriculture (Beijing), Beijing 100093, China;2. Apicultural Branch Center, Research and Development Center of National Agro-food Processing Technology, Beijing 100093, China)
A high performance liquid chromatographic (HPLC) method was established to determine coenzyme Q10 in queen bee larvae. Samples were ground and extracted with absolute ethanol under the assistance of ultrasonic and the resulting extract was then reextracted with n-hexane. The n-hexane layer was finally condensed by rotation evaporation and rediluted with absolute ethanol. The chromatographic separation was achieved on an XBridge shield RP18column using methanol as a mobile phase prior to UV detection at 275 nm wavelength. Results showed that a good separation of coenzyme Q10 was observed within 12 min. The developed standard curve exhibited good linearity. Average recoveries for coenzyme Q10 in a real sample spiked at 3 levels, each of which was performed in 6 replicates, were within the range of 95.0% to 101.8%, with a RSD of less than 8%. The limit of detection for coenzyme Q10was 0.23 mg/L. The analytical method proved to be simple, accurate, reliable and sensitive so as to be most suitable for the determination of coenzyme Q10 in queen bee larvae. Satisfying results from the analysis of coenzyme Q10in some real samples by the method were obtained.
coenzyme Q10;queen bee larvae;liquid/liquid extraction;high performance liquid chromatography
TS201.4;TS218
A
1002-6630(2010)10-0206-03
2009-09-18
国家蜜蜂产业技术体系建设专项(nycytx-43)
岳兵(1983—),男,硕士研究生,研究方向为蜂产品质量与安全。E-mail:mooncake_333@126.com
*通信作者:赵静(1956—),女,研究员,学士,研究方向为蜂产品质量与安全。E-mail:zhaojingjun@sina.com
